
ЛЕКЦИЯ 4
ПРОТОЛИТИЧЕСКОЕ РАВНОВЕСИЕ В РЕАКЦИЯХ ГИДРОЛИЗА
ПЛАН
4.1 Гидролиз как частный случай протолитических реакций
4.2 Константа и степень гидролиза. Расчёт рН в растворах гидролизующихся солей
4.1 Гидролиз как частный случай протолитических реакций
Помимо кислот и оснований, растворы которых отличаются соответственно кислой и щелочной реакцией, растворы многих солей также имеют кислую или щелочную реакцию среды. Кислая реакция характерна для растворов солей, образованных катионами слабых оснований и анионами сильных кислот (например, NH4Cl); щелочная – образованных катионами сильных оснований и анионами слабых кислот (например, KCN). Причем это свойство солей проявляется не только в водных растворах, но и в неводных тоже (сольволиз).
Гидролизом в широком смысле слова называют реакции взаимодействия различных веществ (солей, гидридов, белков, жиров) с водой, сопровождающиеся образованием слабых электролитов. При гидролизе обычно происходит изменение реакции среды.
Гидролизу подвергаются растворимые соли сильных кислот и слабых оснований, сильных оснований и слабых кислот, а также слабых оснований и слабых кислот, т.е. соединения, содержащие анионы слабых кислот (сопряженные основания) и катионы слабых оснований (сопряженные кислоты). Ионизация таких солей происходит обычно полностью. При этом образуются анионы слабых кислот или катионы оснований, которые вступают во взаимодействие с молекулами растворителя, образуя соответственно слабые кислоты или основания.
Реакция гидролиза является разновидностью протолитической реакции, сопровождаемой передачей протона. Например,
CH3COO- + H2O ↔ CH3COOH + OH-
осн.2 к-та 1 к-та 2 осн.1
NH4+ + HOH ↔ NH3 + H3O+
к-та 1 осн.2 осн.1 к-та 2
Чем больше заряд иона, меньше радиус и устойчивее электронная оболочка, тем сильнее поляризующее действие ионов и тем в большей степени протекает гидролиз.
В некоторых случаях явление гидролиза мешает проведению анализа, поэтому необходимо знать способы усиления и подавления гидролиза:
1) прибавление к раствору соли другого гидролизующего электролита, кислоты или щёлочи;
2) изменение концентрации раствора соли;
3) повышение или понижение температуры
4.2 Константа и степень гидролиза. Расчёт рН в растворах гидролизующихся солей
Процесс гидролитического расщепления солей количественно характеризуется 2 величинами:
1) константой гидролиза (Кг)
2) степенью гидролиза (h)
Степень гидролиза выражает отношение концентрации гидролизованной части соли к общей её концентрации в данном растворе:
h = Сгидр/Собщ
Степень гидролиза при разбавлении растворов солей и при их нагревании увеличивается.
Константа гидролиза определяет равновесие , устанавливающееся в растворе данной гидролизующейся соли.
Степень гидролиза связана с константой ионизации образующегося слабого электролита. Чем меньше константа ионизации слабого электролита, тем выше степень гидролиза.
Степень и константа гидролиза связаны между собой законом разведения Оствальда.
Соли, образованные сильным основанием и слабой кислотой:
NaNO2, CH3COONa, Na2CO3, Na3PO4, K2SO3 и т.д.
Растворы этих солей имеют щелочную реакцию:


Кс- константа равновесия концентрационная


![]()
![]()
Чем слабее кислота, тем сильнее проходит гидролиз.
Степень гидролиза (h) – отношение количества соли, подвергшейся гидролизу к общей концентрации соли в растворе.
![]()
Пусть с – концентрация соли, h – степень гидролиза, сh – число молей соли, подвергшихся гидролизу; с-сh – число молей соли, негидролизовавшейся (с(1-h)).
[соли ]= [СН3СОО─]
[ОН─] =[кислоты]

![]() ;
;
![]()
Для подавления гидролиза следует добавить щелочь.
Расчст рН гидролизующейся соли
![]()
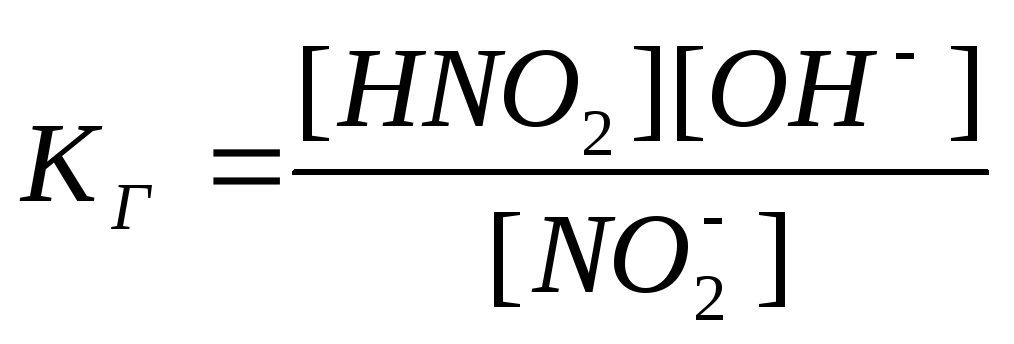
![]()
![]()
![]()
![]()
![]()
Соли, образованные многоосновными кислотами, гидролизуются ступенчато:



Соли, образованные слабым основанием и сильной кислотой:
NH4Cl, CuSO4, FeCl2, FeCl3.
Растворы этих солей имеют кислую реакцию



![]()

Расчет рН гидролизующейся соли
![]()

![]()
![]()
![]()
![]()
![]()
![]()
Соль, образованная многокислотным основанием, гидролизуется ступенчато:

![]()

![]()
![]()
Соли, образованные слабым основанием и слабой кислотой:
NH4CN, NH4CH3COO. Реакция среды зависит от силы слабых основания и кислоты.

![]() h
≈
h
≈
![]()

![]()
![]()
При проведении анализа катионов для разделения их внутри групп применяют в качестве реактивов соли, гидролизующиеся в воде. рН растворов этих солей необходимо учитывать (Na2CO3, Na2HPO4, (NH4)2S, NH4Cl и др.). Так, с Al3+, Zn2+, Sn2+, Cr3+ при действии Na2CO3 в растворе происходят следующие изменения: Al3+, Zn2+ и Sn2+ выпадают в осадок в виде основной соли.


Реакции гидролиза, протекающие в организме (гидролиз полипептидов, белков, полисахаридов, триацилглицеринов, полинуклеотидов и др. соединений), играют важную роль в метаболизме.
Реакции гидролиза применяются в аналитической химии для обнаружения отдельных ионов, регулирования кислотности и щёлочности анализируемых растворов, разделения ионов при систематическом качественном анализе. Так, обнаружение Bi3+ осуществляют, используя реакцию гидролиза, при которой образуется белый осадок висмутила хлорид BiOCl. Процесс гидролиза солей оказывает влияние на проведение количественного анализа. Например, при определении слабых кислот с помощью растворов оснований, рН точки эквивалентности вследствие гидролиза образующейся соли становится больше 7, что учитывают в процессе анализа.
