
- •Реакции комплексообразования в аналитической химии
- •6.1 Комплексные соединения, их строение и классификация
- •Трилон б – Na2h2y (дентантность 4–6)
- •Классификация
- •6.2 Металлолигандное равновесие в водном растворе
- •6.3 Металлолигандный гомеостаз и способы его коррекции
- •Важнейшие принципы хелатотерапии
- •6.4 Применение реакций комплексообразования в аналитической химии.
ЛЕКЦИЯ 6
Реакции комплексообразования в аналитической химии
ПЛАН
6.1 Комплексные соединения, их строение и классификация
6.2 Металлолигандное равновесие в водном растворе
6.3 Металлолигандный гомеостаз и способы его коррекции
6.4 Применение реакций комплексообразования в аналитической химии.
6.1 Комплексные соединения, их строение и классификация
Свойства комплексных соединений (устойчивость, интенсивная окраска, малая растворимость, летучесть и др.) широко используют для получения информации о качественном и количественном составах пробы. Они лежат в основе многих химических и физических методов анализа.
Комплексными (КС) называют соединения, в узлах кристаллической решётки которых находятся сложные частицы – комплексные ионы, состоящие из центрального атома и окружающих его молекул или ионов.
КС имеет внутреннюю координационную сферу, состоящую из комплексообразователя и лигандов, и внешнюю координационную сферу.
K 3[Fe(CN)6]
3[Fe(CN)6]

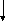

Ионы внешней лиганды
сферы Комплексооб-
разователь
Теория комплексных соединений разработана А.Вернером. Основателем русской химической школы комплексных соединений является Л.А.Чугаев. По Вернеру:
-
Все атомы могут образовывать ограниченное число связей, которое зависит от числа неспаренных электронов на внешнем слое.
-
Могут образовываться дополнительные связи за счёт донорно-акцепторного взаимодействия.
Важнейшей характеристикой комплексообразователя является его координационное число (к.ч.). Координационное число – это число ковалентных связей, образованных комплексообразователем с лигандами . Наблюдается некоторая взаимосвязь между к.ч. и степенью окисления комплексообразователя:
СО (Ме) к.ч.
+ 1 2
+2 4, 6
+3 4, 6
+ 4 6, 8
Обычно в роли комплексообразователей выступают металлы:
s- p- d-

увеличение комплексообразующей способности
реже неметаллы: Si, P, S и др.
К.Ч. комплексообразователя определяет геометрию (конфигурацию) комплекса.
Таблица 1
Зависимость конфигурации КС от к.ч. комплексообразователя
|
Координационное число |
Конфигурация |
Примеры |
|
2 |
Линейная
|
[Ag(NH3)2]+ [Ag(CN)2]2‾ |
|
4 |
Тетраэдрическая
Квадратно-плоскостная
|
[Zn(OH)4]2‾
[AuCl4]‾ |
|
6 |
Октаэдрическая
|
[Co(CN)6]3‾
[Co(NH3)6]3+ |
В роли лигандов выступают молекулы и ионы.
Важной характеристикой лиганда является его дентантность, т.е. число ковалентных связей, образованных лигандом с комплексообразователем.
Различают:
а) монодентантные лиганды:
-
молекулы: CO, NH3, H2O, NO
-
анионы: OH‾, F‾, Cl‾, Br‾, NO2‾, CN‾
-
катионы: NH2NH3+ (гидразиниум-катион)
б) бидентантные лиганды:
-
анионы: SO42‾, SO32‾, S2O32‾, C2O42‾
-
молекулы органических соединений: аминокислот, аминов
(NH2–CH2–CH2–NH2) – этилендиамин
в) полидентантные лиганды:
-
комплексоны (полиаминокарбоновые кислоты и их соли):




