
- •326. Какой объем воздуха (объемная доля кислорода 20 %) нужен для полного сжигания смеси массой 20 г, состоящей из паров 4-хлорпентена-2, 2-метил-1-хлорбутена-2 и хлор-циклопентана?
- •157. При прокаливании смеси AgNo3 и BaCo3 образовалась газовая смесь, которая на 6% тяжелее аргона. Во сколько раз уменьшилась масса исходной твердой смеси при прокаливании?
- •5. Рассчитайте массовую долю более легкого газа в смеси, состоящей из метана и оксида углерода (IV) и имеющей плотность 1,72 г/л при давлении 95 кПа и температуре 253k.
- •4. Через 504 г 10%-ного раствора гидроксида калия было пропущено 17,2 л оксида серы (IV) при давлении 101,5 кПа и температуре 27 °с. Вычислите массовые доли веществ в полученном растворе.
- •7. В 15 %-ном растворе серной кислоты массой 300 г растворили карбид алюминия. Выделившийся при этом метан занял объём 2,24 л (н. У.). Рассчитайте массовую долю серной кислоты в полученном растворе.
- •18. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
5. Рассчитайте массовую долю более легкого газа в смеси, состоящей из метана и оксида углерода (IV) и имеющей плотность 1,72 г/л при давлении 95 кПа и температуре 253k.
PV = nRT = mRT/M
ρ = m/V = PM/RT
M = ρRT/P = 1,72*8,314*253/95 = 38 г/моль
Пусть в смеси 1 моль газов, а доля метана x. Тогда
38 = (16x + 44(1 - x))/1 = 44 – 28x
28x = 6
x = 0,21
ω(CH4) = 100%*0,21*16/(0,21*16 + 0,79*44) = 8,8%
Ответ: 8,8%
6. На образец красного фосфора массой 11,16 г подействовали хлором, который занимал 15,4 л при температуре 20 °С и нормальном давлении. К полученной жидкости добавили 500 г 18%-ного раствора гидроксида натрия. Рассчитайте состав образовавшегося раствора (в массовых долях).
n(P) = 11,16/31 = 0,36 моль
n(Cl2) = 15,4*101,3/(8,314*293) = 0,64 моль
n(P)/n(Cl2) = 9/16
3/2 < n(P)/n(Cl2) < 5/2
Образовалась смесь пента- и трихлорида фосфора.
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
 Пусть
образовалось x
моль PCl3
и y
моль PCl5.
Пусть
образовалось x
моль PCl3
и y
моль PCl5.
x + y = 0,36
(3/2)x + (5/2)y = 0,64
x = 0,36 – y
0,54 – 1,5y + 2,5y = 0,64
y = 0,1
x = 0,26
n(NaOH) = 500*0,18/40 = 2,25 моль
PCl3 + 5NaOH = Na2(PHO3) + 3NaCl + 2H2O
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O
n(Na2(PHO3)) = x = 0,26 моль
n(Na3PO4) = y = 0,1 моль
n(NaCl) = 3x + 5y = 1,28 моль
n(NaOH) = 2,25 – 5x – 8y = 0,15 моль
m(Na2(PHO3)) = 0,26*126 = 32,76 г
m(Na3PO4) = 0,1*164 = 16.4 г
m(NaCl) = 1,28*58,5 = 74,88 г
m(NaOH) = 0,15*40 = 6 г
m(р-ра) = 500 + 0,36*31 + 0,64*71 = 556,6 г
ω(Na2(PHO3)) = (32,76/556,6)*100% = 5,89%
ω(Na3PO4) = (16.4/556,6)*100% = 2,95%
ω(NaCl) = (74,88/556,6)*100% = 13,44%
ω(NaOH) = (6/556,6)*100% = 1,08%
Ответ: ω(Na2(PHO3)) = 5,89%; ω(Na3PO4) = 2,95%; ω(NaCl) = 13,44%; ω(NaOH) = 1,08%
6. К 42 г смеси пирита (FeS2) и сульфида алюминия при нагревании добавили 605,5 мл 60%-ного раствора азотной кислоты (плотность 1,37 г/мл). Выделилось 148,7 л бурого газа (27 °С, 105,6 кПа). Раствор обработали избытком водного раствора гидроксида натрия. Рассчитайте массу образовавшегося осадка и массовые доли веществ в исходной смеси.
FeS2 + 18HNO3 = 15NO2 + Fe(NO3)3 + 2H2SO4 + 7H2O
Al2S3 + 30HNO3 = 24NO2 + 2Al(NO3)3 + 3H2SO4 + 12H2O
Пусть n(FeS2) = x моль, n(Al2S3) = y моль. Тогда:
120x + 150y = 42
n(NO2) = PV/RT = 105,6*148,7/(8,31*(273+27)) = 6,3 моль
n(HNO3) = 605,5*1,37*0,6/63 = 7,9 моль
Если предположить, что HNO3 в избытке, то количество NO2 определяется количеством сульфидов: n(NO2) = 15x + 24y = 6,3
Решая полученную систему двух уравнений, находим:
x = 0,1
y = 0,2
Для растворения такого количества смеси требуется 18*0,1 + 30*0,2 = 7,8 моль HNO3, так что 7,9 моль HNO3 – действительно избыток.
HNO3 + NaOH = NaNO3 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3
В осадке – только Fe(OH)3.
n(Fe(OH)3) = n(FeS2) = 0,1 моль
m(Fe(OH)3) = 0,1*107 = 10,7 г
ω(FeS2) = 0,1*120/42 = 28,6%
ω(Al2S3) = 71,4%
Ответ: 10,7 г Fe(OH)3. ω(FeS2) = 28,6 %, ω(Al2S3) = 71,4 %.
4. Через 504 г 10%-ного раствора гидроксида калия было пропущено 17,2 л оксида серы (IV) при давлении 101,5 кПа и температуре 27 °с. Вычислите массовые доли веществ в полученном растворе.
n(KOH) = 504*0,1/56 = 0,9 моль
n(SO2) = PV/RT = 101,5*17,2/(8,314*(273 + 27)) = 0,7 моль
2KOH + SO2 = K2SO3 + H2O
SO2 в избытке. Образуется 0,9/2 = 0,45 моль K2SO3, остается 0,7 – 0,45 = 0,25 моль SO2.
K2SO3 + SO2 + H2O = 2KHSO3
Образуется 0,25*2 = 0,5 моль KHSO3, остается 0,45 – 0,25 = 0,2 моль K2SO3.
m(р-ра) = 504 + 0,7*64 = 548,8 г
m(K2SO3) = 0,2*158 = 31,6 г
m(KHSO3) = 0,5*120 = 60 г
ω(K2SO3) = (31,6/548,8)*100% = 5,76%
ω(KHSO3) = (60/548,8)*100% = 10,93%
Ответ: 5,76% K2SO3, 10,93% KHSO3
6. Смесь сероводорода и неизвестного алкана, взятых в объемном соотношении 1 : 3, сожжена, и продукты сгорания полностью поглощены избытком водного раствора гидроксида бария. В результате выпало 19,9 г осадка, масса которого при обработке избытком раствора перманганата калия, подкисленного азотной кислотой, уменьшилась до 2,33 г. Установите формулу алкана и напишите уравнения упомянутых реакций.
H2S + 1,5O2 = SO2 + H2O
CnH2n+2 + (1,5n + 0,5)O2 = nCO2 + (n+1)H2O
Ba(OH)2 + SO2 = BaSO3↓ + H2O
Ba(OH)2 + CO2 = BaCO3↓ + H2O
5BaSO3 + 2KMnO4 + 6HNO3 = 5BaSO4↓ + 2Mn(NO3)2 + 2KNO3 + 3H2O
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O
Пусть было сожжено x моль H2S (и, соответственно, 3x моль алкана). Тогда:
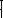 19,9
= x*217
+ 3nx*197
19,9
= x*217
+ 3nx*197
2,33 = x*233
x = 0,01
n = (19,9 – 2,17)/(0,03*197) = 3
Ответ: C3H8
6. 8,35 г соединения, содержащего 23,35% калия, 47,90% брома и 28,75% кислорода по массе, нагрели при температуре более 450 °С с 1,86 г фосфора. Продукты реакции растворили в 150 мл воды и через раствор пропустили 1,92 л аммиака (давление 1 атм, температура 20 °С). Вычислите массовые доли веществ в полученном растворе.
KxBryOz
x : y : z = 23,35/39 : 47,90/80 : 28,75/16 = 0,599 : 0,599 : 1,797 = 1 : 1 : 3
KBrO3
5KBrO3 + 6P = 3P2O5 + 5KBr
n(KBrO3) = 8,35/167 = 0,05 моль
n(P) = 1,86/31 = 0,06 моль
Вещества взяты в стехиометрических соотношениях.
В результате реакции образовалось 0,03 моль P2O5 и 0,05 моль KBr.
P2O5 + 3H2O = 2H3PO4
n(NH3) = 101,3*1,92/(8,31*293) = 0,08 моль
m(NH3) = 0,08*17 = 1,36 г
При растворении такого количества аммиака в этом количестве фосфорной кислоты образуются две кислые соли.
H3PO4 + NH3 = NH4H2PO4
H3PO4 + 2NH3 = (NH4)2HPO4
 Пусть
n(NH4H2PO4)
= x
моль, n((NH4)2HPO4)
= y
моль. Тогда:
Пусть
n(NH4H2PO4)
= x
моль, n((NH4)2HPO4)
= y
моль. Тогда:
x + y = 0,06
x + 2y – 0,08
x = 0,04
y = 0,02
m(р-ра) = 150 + 8,35 + 1,86 + 1,36 = 161,6 г
ω(NH4H2PO4) = (0,04*115/161,6)*100% = 2,84%
ω((NH4)2HPO4) = (0,02*132/161,6)*100% = 1,63%
ω(KBr) = (0,05*119/161,6)*100% = 3,68%
Ответ: 2,84% NH4H2PO4, 1,63% (NH4)2HPO4, 3,68% KBr
8-47. Какую массу AgNO3 необходимо добавить к 100,0 г 5,5 М раствора HCl (ρ = 1,10 г/мл), чтобы получить раствор, в котором массовая доля азотной кислоты равна 10,0%?
AgNO3 + HCl = AgCl↓ + HNO3
Пусть n(AgNO3) = x моль. Тогда:
0,1 = 63x/(100*1,1 + 170x – 143,5) = 63x/(110 + 26,5x)
11 + 2,65x = 63x
x = 0,18
m(AgNO3) = 170x = 31 г
Ответ: 31 г
119. Известно, что 40 см3 раствора, содержащего нитрат меди (II) и серную кислоту, может прореагировать с раствором гидроксида натрия объемом 25,4 см3 (ω = 16,02%, плотность раствора 1,18 г/см3), а прокаливание выпавшего при этом осадка дает 1,60 г твердого вещества. Вычислите концентрации (в моль/дм3) нитрата меди (II) и серной кислоты в исходном растворе.
n(NaOH) = 25,4*1,18*0,1602/40 = 0,12 моль
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
H2SO4 + 2NaOH = Na2SO4 + H2O
Cu(OH)2 = CuO + H2O
n(Cu(NO3)2) = n(CuO) = 1,6/80 = 0,02 моль
с(Cu(NO3)2) = 0,02/0,04 = 0,5 моль/л
n(H2SO4) = 0,5(n(NaOH) – 2*0,02) = 0,04 моль
с(H2SO4) = 0,04/0,04 = 1 моль/л
Ответ: с(Cu(NO3)2 = 0,5 моль/л, с(H2SO4) = 1 моль/л
15. Нитрат меди (II) массой 37,6 г прокалили и получили 8,96 дм3 (н. у.) смеси газов. Рассчитайте: а) массу твердого остатка; б) массовые доли веществ в твердом остатке; в) массу соляной кислоты с ω(HCl) = 20,4%, которая может прореагировать с твердым остатком.
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
n(смеси газов) = 8,96/22,4 = 0,4 моль
n(O2) = 0,4/5 = 0,08 моль
n(NO2) = 0,4*4/5 = 0,32 моль
m(смеси газов) = 0,32*46 + 0,08*32 = 17,28 г
m(тв. остатка) = 37,6 – 17,28 = 20,32 г
m(CuO) = 0,08*2*80 = 12,8 г
ω(CuO) = (12,8/20,32)*100% = 63%
ω(Cu(NO3)2) = 100 – 63 = 37%
CuO + 2HCl = CuCl2 + H2O
n(HCl) = 2n(CuO) = 4n(O2) = 0,32 моль
m(HCl, 20,4%) = 0,32*36,5/0,204 = 57,3 г
Ответ: а) 20,32 г; б) 63% CuO, 37% Cu(NO3)2; в) 57,3 г
1.Смешали 100 мл 30 %-ного раствора хлорной кислоты (ρ = 1,11 г/мл) и 300 мл 20 %-ного раствора гидроксида натрия (ρ = 1,10 г/мл). Сколько миллилитров воды следует добавить к полученной смеси, чтобы массовая доля перхлората натрия в ней составила 8 %?
HClO4 + NaOH = NaClO4 + H2O
n(HClO4) = 100*1,11*0,3/100,5 = 0,33 моль
n(NaOH) = 300*1,1*0,2/40 = 1,65 моль
NaOH в избытке.
n(NaClO4) = 0,33 моль
m(NaClO4) = 122,5*0,33 = 40,5 г
m(конеч. р-ра) = 40,5/0,08 = 506,25 г
m(нач. р-ра) = 100*1,11 + 300*1,1 = 441 г
m(H2O) = 506,25 – 441 = 65,25 г = 65,25 мл
Ответ: 65,3 мл
2. Карбид кальция массой 6,4 г растворили в 87 мл бромоводородной кислоты (плотность 1,12 г/мл) с массовой долей 20 %. Какова массовая доля бромоводорода в образовавшемся растворе?
n(CaC2) = 6,4/64 = 0,1 моль
CaC2 + 2HBr = CaBr2 + C2H2↑
HBr в избытке.
n(C2H2) = n(CaC2) = 0,1 моль
m(C2H2) = 0,1*26 = 2,6 г
m(р-ра) = 6,4 + 87*1,12 – 2,6 = 101,24 г
n(HBr) = 87*1,12*0,2/81 – 2*0,1 = 0,04 моль
m(HBr) = 0,04*81 = 3,3 г
ω(HBr) = (3,3/101,24)*100% = 3,25%
Ответ: 3,25%
3. Оксид меди (II) массой 16 г обработали 40 мл 5,0 %-ного раствора серной кислоты (р = 1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
CuO + H2SO4 = CuSO4 + H2O
n(CuO) = 16/80 = 0,2 моль
n(H2SO4) = 40*1,03*0,05/98 = 0,021 моль
CuO в избытке
n(CuSO4) = n(CuSO4*5H2O) = 0,021 моль
m(CuSO4*5H2O) = 0,021*250 = 5,25 г
Ответ: 5,25 г
4. В 120 мл раствора азотной кислоты с массовой долей 7 % (плотностью 1,03 г/мл) внесли 12,80 г карбида кальция. Сколько миллилитров 20 %-ной соляной кислоты (плотностью 1,10 г/мл) следует добавить к полученной смеси для её полной нейтрализации?
CaC2 + 2HNO3 = Ca(NO3)2 + C2H2↑
n(CaC2) = 12,8/64 = 0,2 моль
n(HNO3) = 120*1,03*0,07/63 = 0,14 моль
CaC2 в избытке.
Остается 0,2 – 0,14/2 = 0,13 моль CaC2
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
n(HCl) = 2n(CaC2 ост.) = 0,26 моль
V(HCl, 20%) = 0,26*36,5/(0,2*1,1) = 43,14 мл
Ответ: 43,14 мл
5. Нитрит натрия массой 13,8 г внесли при нагревании в 220 г раствора хлорида аммония с массовой долей 10 %. Какой объём (н. у.) азота выделится при этом и какова массовая доля хлорида аммония в получившемся растворе?
NaNO2 + NH4Cl = N2↑ + NaCl + 2H2O
n(NaNO2) = 13,8/69 = 0,2 моль
n(NH4Cl) = 220*0,1/53,5 = 0,41 моль
NH4Cl в избыке.
n(NH4Cl ост.) = 0,41 – 0,2 = 0,21 моль
m(NH4Cl ост.) = 0,21*53,5 = 11,3 г
n(N2) = 0,2 моль
V(N2) = 0,2*22,4 = 4,48 л
m(р-ра) = 13,8 + 200 – 0,2*28 = 228,2 г
ω(NH4Cl) = (11,3/228,2)*100% = 4,9%
Ответ: 4,48 л, 4,9%
6. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (р = 1,04 г/мл) с массовой долей 9 %. Какова массовая доля хлороводорода в образовавшемся растворе?
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
n(CaCO3) = 10/100 = 0,1 моль
n(HCl) = 150*1,04*0,09/36,5 = 0,38 моль
HCl в избытке.
n(HCl ост.) = 0,38 – 2*0,1 = 0,18 моль
m(р-ра) = 10 + 150*1,04 – 0,1*44 = 161,6 г
ω(HCl) = (0,18*36,5/161,6)*100% = (6,74/161,5)*100% = 4,2%
Ответ: 4,2%
