
Практична мікробіологія - Климнюк С. І. - 2004
.pdf
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
221 |
лерних і холероподібних вібріонів можна, в основному, за біохімічними тестами
(табл. 45)
|
Диференціація вібріонів від інших споріднених родів |
Таблиця 45 |
||||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
Рід |
Оксидаза |
Жела- |
|
Ферментація |
|
Тест |
||
тиназа |
Глюкози |
Манози |
Маніту |
Інозиту |
“тяжа” |
|||
|
|
|||||||
Vibrio |
++++ |
+ |
+ |
+ |
+ |
- |
+ |
|
Aeromonas |
++++ |
+ |
+ |
+ |
+ |
- |
± |
|
Pseudomonas |
++ |
± |
- |
- |
- |
- |
- |
|
Plesiomonas |
++ |
- |
- |
- |
- |
+ |
- |
|
Для видової ідентифікації холерних вібріонів провідними тестами є аглютинація культури О1 холерною сироваткою, лізис холерним фагом С ІV або eltor 2.
Кампілобактеріози і гелікобактеріози
Інфекційнізахворювання, щоспричиняютьбактеріїродуCampylobacter, дістали загальну назву кампілобактеріози. Вони мають гострий перебіг, супроводжуються гарячкою, ураженням шлунка і кишечника і з кожним роком зустрічаються все частіше. Серед 13 видів кампілобактерій найголовнішими є: Campylobacter jejuni, C.coli, C.lari. У 1991 р. виділено окремий видHelicobacter pylorі. Його ста-
більно виявляють у хворих на виразку шлунка, гастрит і дуоденіт. Цим захворюванням дали загальну назву гелікобактеріози.
Окрім ентеритів і ентероколітів, цих найчастіших кампілобактеріозів, значнорідшезустрічаютьсясептицемії, ендокардити, перикардити, менінгіти, ураженнясечостатевоїсистеми. Увагітнихжінокможливіаборти, передчасніроди, інфікування новонароджених під час пологів.
У зв’язку з тим, що клінічна картина цих захворювань не має характерних симптомів і подібна до викликаних іншими бактеріями, лабораторні дослідження набувають важливогозначення. Длядіагностикишироко використовуютьмікроскопічний, бактеріологічний і дещо менше серологічний методи.
Матеріалом для дослідження служить кров, ліквор, випорожнення або вміст прямої кишки, взятий за допомогою ректальних тампонів, плацентарна і навколоплідна рідина, вміст абсцесів, біоптати слизової оболонки шлунка і 12-палої кишки. Досліджують також воду, молоко, інші харчові продукти, змиви з предметів тощо.
Бактеріоскопічний метод використовують для швидкої ідентифікації кампілоігелікобактерій. Тонкімазкизфекалійабоіншихклінічнихматеріалівфіксують на вогні, забарвлюють фуксином Пфейфера протягом 10-20 с і промивають водою. Оскільки длязабарвлення інших бактерій потрібно3-5 хв, то протягом1020 сек встигають зафарбуватись лише кампілобактерії. Особливо чітко їх типові формивиявляютьпризабарвленнікристалічнимфіолетовим. Підзвичайнимсвітловим мікроскопом вони виглядають як тонкі, спірально зігнуті бактерії, що мають

222 |
Частина ІІІ. Спеціальна мікробіологія |
один повний завиток, С- іSподібну форму або нагадують крила чайки. Helicobacter pylori має дещо більші розміри. Можна також використати фазовоконтрастну мікроскопію суспензії випорожнень у бульйонідлякультивуваннябруцелаборідкомусередовищі Мюллера-Хінтона (МПБ з крохмалем і казеїном). При цьому виявляють не тільки типові особливості морфології кампілобактерій, айдуже характерну їх рухливість (рис. 67).
Бактеріологічнийметод. Оптимальнірезульта-
Рис. 67. Кампілобактерії. ти отримують, коли матеріал беруть у транспортне тіогліколеве середовище і в ньому доставляють до лабораторії. Якщо ж посіви роблять не пізніше 24 год, транспортне середовище не використовують.
Для виділення кампіло- і гелікобактерій найчастіше застосовують середовище Бутцлера (до кров’яного агару додають цефоперазон – 30 мг/л, рифампіцин – 10 мг/ліамфотеріцинВ– 2 мг/л). Антибіотикипригнічуютьрістсупутньоїмікрофлори. Посіви інкубують в атмосфері 10 % СО2 при температурі 25 °С, 37 °С і 42 °С протягом 24-72 год.
Кампілобактерії утворюютьдва типи колоній: 1) правильної круглої формиз рівними краями діаметром 1-2 мм, блискучою опуклою поверхнею, прозорі, гомогенні; 2) неправильної округлої форми діаметром 2-8 мм, безбарвні або світлосірого кольору, прозорі, нагадують краплі води.
Припосівікількіснимметодомрістколоній, якправило, виявляютьнатретьому і четвертому квадрантах, але потрібно ретельно оглядати всю чашку, оскільки вони можуть вирости лише на першому квадранті в оточенні колоній супутньої фекальної мікрофлори.
Ідентифікація колоній кампіло- і гелікобактерій не викликає труднощів для досвідченого бактеріолога. Типові колонії досліджують мікроскопічно, забарвлюючи препарати за Грамом. У мазках збудники мають вигляд тонких, зігнутих, частіше спіралеподібних клітин, можуть мати один і більше витків і досягати в довжину до 8 мкм. У культур, які вирощували протягом 72 год і довше, клітини можуть набувати кокоподібної форми, що може привести до помилок в ідентифікації. Потім виділяють чисту культуру, яку ідентифікують за рядом ознак: виділенняоксидази, каталази, уреази, рістпритемпературі25 °С, 37 °Сі42 °С, гідроліз гіппурату, відновлення нітратів, чутливість до цефалотину (табл. 46).
Для серотипування кампіло – і гелікобактерій використовують реакцію аглютинації зі стандартними діагностичними сироватками і суспензією прогрітих культур. Хороші результати типування отримані також в реакціях коаглютинації, латекс-аглютинації інепрямоїгемаглютинації. Встановлено 50 серотипівC. jejuni і 20 серотипівC. coli, але їх кількість з року в рік зростає. Ще точніші результати серотипування отримані при використанні методу імуноферментного аналізу. Зокрема, розроблена надійна тест-система для визначення антигенів Н. pylorі в біоптатах слизової оболонки шлунка і кишечника.

Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
223 |
|||||||
|
Диференціальні ознаки кампілобактерій і гелікобактерій |
Таблиця 46 |
||||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
Вид |
Оксидаза |
Каталаза |
Уреаза |
|
Ріст при |
|
Гіппурат- |
Цефа- |
25 °С |
37 °С |
42 °С |
Na |
лотин |
||||
C.jejuni |
+ |
+ |
- |
- |
+ |
+ |
+ |
P |
C.fetus |
+ |
+ |
- |
+ |
+ |
- |
- |
Ч |
C.coli |
+ |
+ |
- |
- |
+ |
+ |
- |
Р |
C.lari |
+ |
+ |
- |
- |
+ |
+ |
- |
Р |
Н.pylori |
+ |
+ |
+ |
- |
+ |
- |
- |
Ч |
|
|
|
|
|
|
|
|
|
Примітка: “+” – позитивна ознака; “–” – негативна ознака; Р – резистентні; Ч – чутливі
Серологічний метод діагностики захворювань проводять значно рідше. Він відіграє важливу роль при масових епідеміологічних обстеженнях в ряді країн американського і африканського континентів. В Україні такі дослідження поки що не проводились.
Для виявлення антитіл можна використовувати практично всі серологічні тести. Алеперевагувіддаютьреакціїнепрямоїімунофлуоресценціїтаметодуімуноферментного аналізу. Можна застосовувати і реакції звичайної аглютинації, латекс-аглютинації та непрямої гемаглютинації. Є повідомлення про використання імуноблотінгу та радіоімунного методу для визначення антитіл до С.jejuni і H.pylorі. Вони мають винятково високу чутливість, але досить дорогі і широкого вжитку не набудуть.
Чума
Чума– гостра, зоонознаособливонебезпечна, карантиннаінфекційнахворобазураженнямишкіри, лімфатичнихвузлів, легень, геморагічноюсептицемієюй інтоксикацією. Збудник чуми – Yersinia pestis – належить до роду Yersinia родини Enterobacteriaceae. До цього роду входять ще два патогенних для людини види ієрсиній: Y. рseudotuberculosis, Y. еnterocolitica. Крім трьох основних збудників ієрсиніозів виділяють ще 8 видів, які в інфекційній патології людини значення не мають, правда, окремі з них можуть зрідка викликати опортуністичні інфекції.
Джерелом чуми в природі є різні види диких і домашніх тварин, гризунів, а перенощиками– їхблохи. Проникаючивлюдськуспільноту, чумнаінфекціяможе стати антропонозом, який розповсюджується у вигляді епідемій і пандемій.
Збудник чуми має кілька антигенів, із них найбільш вивчені D-, F1-, T-, V-, W. Алесерологічнейоготипуваннярозробленощенедостатньоіврутиннійлабораторній практиці не використовується.
Мікробіологічнедослідженняпроводитьсязметоюдіагностикизахворювання, виявлення інфікування тварин і перенощиків в ендемічних осередках та встановлення контамінації ієрсиніями різних об’єктів оточуючого середовища. При цьому використовують бактеріоскопічний, бактеріологічний, біологічний і серологічнийметоди, атакожалергічнупробузпестиномдляретроспективноїдіагнос-

224 Частина ІІІ. Спеціальна мікробіологія
тики. Першийвипадокзахворюванняначумуулюдиниповиненбутиобов’язково підтверджений виділенням збудника.
Взяття матеріалу для дослідження як і всі етапи виділення збудника та роботи з гризунами чи лабораторними тваринами проводять у протичумних костюмахпершоготипу. В лабораторії потрібностворити суворийпротиепідемічний і дезінфекційний режими, які регламентовані спеціальними інструкціями. Залежно від клінічної форми чуми, від хворого беруть такі матеріали: виділення з виразки або карбункула (шкірна форма); пунктат із бубону (бубонна форма), кров (при всіх формах), фекалії та спинномозкову рідину (при ураженнях кишечника або мозкових оболонок). Матеріал важливо взяти до початку антибіотикотерапії. При направленні секційного матеріалу беруть кров, кістковий мозок, шматочки паренхіматознихорганів. Крімтого, долабораторіїдоставляютьживихізагиблих гризунів, бліх, харчові продукти, воду. В окремих випадках досліджують повітря, змиви з поверхні об’єктів.
Взятий матеріал вміщують у скляні банки з притертими пробками, обгортають вощаним папером, зовні їх обтирають 5 % розчином лізолу, наклеюють етикетку, наякійвказуютьдату, місце, характерматеріалу, прізвищехворого, діагноз. Банки щільно вкладають у герметичну тару, надписують “верх” і направляють службовим транспортом із довіреною особою до найближчої протичумної установи або лабораторії для діагностики особливо небезпечних інфекцій. Персонал, що проводив забір матеріалу, підлягає повній санітарній обробці.
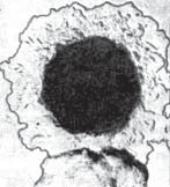
Бактеріоскопія. Здосліджуваного матеріалу влабораторіївиготовляють 5-6 мазків, фіксують їх етанолом або сумішшю спирту й ефіру протягом 15-20 хв. Один мазок забарвлюють за Грамом, другий – метиленовою синькою, третій – міченоюлюмінесцентноюсироваткоюпротиY. pestis (прямаРІФ), 2-3 мазкизалишають у резерві. Виявлення в мазках характерних, біполярно забарвлених, овоїдних, грамнегативних бактерій (рис. 68; див. вкл., рис. 15), які дають до того ж специфічне люмінесцентне світіння у вигляді яскравого зеленуватого ореолу навколо клітин, при характерних клінічних симптомах та врахуванні епідеміологічної ситуації, дає право поставити попередній діагноз чуми.
|
Бактеріологічне дослідження. Незважаючи |
|
нахарактернуклінічнукартинузахворювання, бак- |
|
теріологічнудіагностикутребапроводитиобов’яз- |
|
ково в усіх випадках. Для посівів використовують |
|
високопоживні середовища з додаванням стимуля- |
|
торів росту, хоч палички чуми невибагливі до жи- |
|
вильних середовищ. Досліджувані матеріали, не |
|
контамінованісторонньоюмікрофлорою(кров, пун- |
|
ктат бубонів, ліквор), сіють у флакони, що містять |
|
50-100 мл МПБ і паралельно в чашки з МПА або |
|
агаром Хотінгера. Матеріал, забруднений супут- |
Рис. 68. Збудник чуми у мазку |
ньою флорою, висівають на МПА з сульфітом на- |
з бубону. |
трію, середовища Туманського (МПА з 1 % гемо- |
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
225 |
лізованої крові та генціановим фіолетовим в концентрації 1:100000-1:400000) або Коробкової (0,15 % напіврідкий агар з 0,3 % гемолізованої крові та генціановим фіолетовим 1:200000). Для інактивації чумного фагу на поверхню щільних середовищ наносять і рівномірно розподіляють 0,1 мл антифагової сироватки. Посіви вирощують при 28 °С і 37 °С.
Через 18-20 год на рідких середовищах появляється плівка із спущеними донизу ниткоподібними утвореннями, подібними до сталактитів, на дні утворюється пухкий осад. Розвиток колоній на щільних середовищах проходить три стадії. Через 10-12 год під мікроскопом ріст нагадує скупчення безбарвних пластинок (стадія “битого скла”). Пізніше (18-20 год) утворюються колонії з опуклим кала- мутно-білим центром, оточеним фестончастою каймою (стадія “мереживної хустинки”). Через 40-48 год наступає фаза “дорослих колоній” із буруватим центром і зазубреною периферичною зоною (рис. 69).
Із типових колоній готують мазки, забарвлюють за Грамом і метиленовим синім, роблятьпересівнаскошенийагар(абобульйон) длявиділеннячистоїкультури. Наступного дня, переконавшись що культура чиста, приступають до її ідентифікації. Для цього проводять реакцію аглютинації і преципітації з діагностичнимиантисироваткамипротисоматичногоікапсульногоантигенів, ставлятьРНГА зліофілізованимиеритроцитарнимиантитільнимидіагностикумами, пробуналізис чумним бактеріофагом і заражають чистою культурою гвінейських свинок. Обо- в’язкововизначаютьантибіотикочутливістьдискодифузійнимметодомнаагаріабо методом серійних розведень у бульйоні.
Чисту культуру засівають в середовища Гісса для визначення ферментативних властивостей. Збудник чуми розкладає до кислоти глюкозу, маніт, галактозу, левульозу, ксилозу, окремі штами ферментують арабінозу і гліцерин.
Свіжовиділені штами не розкладають адоніт, рамнозу і сахарозу, не виділяють оксидазу, уреазу, але мають фермент каталазу, не згортають молоко, не утворюють індол. Необхідно провести диференціацію Y. pestis від інших ієрсиній
(табл. 47).
Визначальнмиознакамиприідентифікаціїзбудникачумиєаглютинаціякультуриантисироватками, лізисчумнимбактеріофагом і позитивна біопроба.
Біологічне дослідження при діагностиці чуми єобов’язковим. Біологічнупробуставлятьякізпервинним матеріалом, так і з виділеною чистою культурою. Для зараження використовують гвінейських свинок, рідше– білихмишей. Якщоматеріалнеконтамінований супутньою мікрофлорою (кров, пунктат бубону), йоговводять підшкірно або внутрішньоочеревинно. Призабрудненніматеріалусторонньою флорою зараження проводять шляхом втирання емульгованого матеріалу в депільовану і скарифіковану шкіру живота гвінейської свинки. При пози-

226 |
|
Частина ІІІ. Спеціальна мікробіологія |
||
|
|
|
Таблиця 47 |
|
Диференціація збудників чуми, псевдотуберкульозу і кишкового ієрсиніозу |
||||
|
|
|
|
|
Ознаки |
Yersinia |
Yersinia |
Yersinia |
|
pestis |
pseudotuberculosis |
enterocolitica |
||
|
||||
Рухливість |
– |
+ |
+ |
|
Ферментація адоніту |
– |
+ |
– |
|
Ферментація рамнози |
– |
+ |
– |
|
Ферментація сахарози |
– |
– |
+ |
|
Лізис чумним фагом |
+ |
– |
– |
|
Утворення H2S |
+ |
+ |
+ |
|
Плазмокоагулаза |
+ |
- |
- |
|
Каталаза |
+ |
+ |
+ |
|
Уреаза |
– |
+ |
+ |
|
Колонії на цитратному |
червоні |
жовті |
жовті |
|
дезоксихолевомуагарі |
|
|
|
|
|
|
|
|
|
тивнійбіопробітваринигинутьчерез2-3 дніпризараженнівчеревнупорожнину, або через 5-7 днів – при нанесенні матеріалу на шкіру. Роблять розтин загиблих свинок, вивчають патологоанатомічні зміни: гіперемія судин, збільшення печінки, селезінки, лімфатичних вузлів, наявність на їх поверхні та на розрізі некротичних ділянок. Із крові і паранхіматозних органів роблять мазки і мазки-відбит- ки, проводять висіви на живильні середовища. У мазках виявляють величезну кількість біполярно забарвлених грамнегативних овоїдних паличок. Виділені від тварин чисті культури ідентифікують так само, як і культури після бактеріологічного дослідження. Трупи гвінейських свинок, як і досліджуваних диких гризунів, занурюють у 5 % розчин лізолу, а потім спалюють.
Серологічнадіагностикачуми не набулаширокого використання. Останнім часом проводять постановку РНГА з еритроцитарним діагностикумом, на якому адсорбований капсульний антиген Y. pеstis. Діагностичним титром вважають розведення сироватки 1:40. Взагалі ж серологічні реакції проводять здебільшого з метою ретроспективної діагностики та при масових епізоотичних обстеженнях гризунів в ендемічних осередках чуми.
Прискореніметодидіагностики. Запропонованіекспресніметодивиявлення збудника чуми за допомогою флуоресцуючих антитіл, в РНГА з використанням антитільних еритроцитарних діагностикумів. Вони дають змогу виявити Y. pеstis у досліджуваному матеріалі через 2 год.
Доприскоренихметодівдіагностикивідносятьтакож реакціюпреципітаціїв стандартних агарових пластинках з протичумною сироваткою та метод швидкого росту збудника чуми на елективному середовищі з використанням бактеріофага. Для цього 0,2-0,3 мл матеріалу сіють в 4 пробірки з середовищем Коробкової і 0,1 мл на агар в чашці Петрі. В одну з пробірок вносять 0,2-0,3 мл чумного фага. Посіви інкубують при 28 °С протягом трьох годин. Із пробірок, в яких видно ріст, готують 2 мазки, забарвлюють за Грамом і метиленовим синім. При позитивному результаті в мазках видно ланцюжки грамнегативних овоїдних паличок, забарвлених біполярно. У пробірці з фагом росту немає. Із пробірки з ростом по 0,4 мл
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
227 |
матеріалу вводять у черевну порожнину декількох мишей. Через 8-10 год проглядають чашки з агаром для виявлення росту збудника чуми.
Через 10-12 год забивають мишей, від них сіють ексудат і матеріал із паренхіматозних органів у пробірки з напіврідким агаром і досліджують так само, як вище описано. Отже, попередній результатотримуютьчерез4 год, а остаточний– через 18-20 год.
Дляретроспективноїдіагностикичумичасомвикористовуютьалергічнупробу з пестином.
Псевдотуберкульоз
Псевдотуберкульоз– гостраінфекційнахворобазгрупибактерійнихзоонозів, характеризуєтьсягарячкою, поліморфнимвисипом, гепатолієнальнимсиндромом, ураженнями травного каналу, суглобів, лімфатичної системи. Збудник – Yersinia pseudotuberculosis. Псевдотуберкульозні бактерії мають соматичні О-антигени і джгутикові Н-антигени, поділяються на 13 сероварів і підсероварів. ЗахворюванняулюдейнайчастішевикликаютьієрсиніїсероварівІ, ІІІ, IV. Основнимрезервуаром і джерелом інфекції длялюдини єдикі ісинантропнігризуни, звиділеннями яких ієрсінії потрапляють на різноманітні продукти харчування. Основний шлях передачі збудників псевдотуберкульозу аліментарний, хоч не можна виключити і респіраторне інфікування. Зараження відбувається після вживання контамінових ієрсиніями продуктів, що зберігалися при низьких температурах (4-12 °С) в холодильниках і овочесховищах. В силу своєї психрофільності при таких умовах бактерії можуть розмножуватись і нагромаджуватись у харчових субстратах.
При лабораторній діагностиці псевдотуберкульозу використовують бактеріологічний, серологічний, біологічний іалергічний методи. Матеріалом для дослідження служить кров, пунктат із лімфатичних вузлів, змиви з носоглотки, харкотиння, блювотні маси, кал, сеча, жовч.
Бактеріологічнедослідження. Первинну бактеріоскопіюможна використати лише при дослідженні пунктатів лімфовузлів або органів від трупа. Мазкивідбитки краще забарвлювати за методом Грама і Романовського-Гімзи. Цей метод самостійного діагностичного значення не має і є допоміжним. Він орієнтує бактеріолога на вибір живильних середовищ.
Посіви досліджуваних матеріалів роблять на середовище Ендо та Сєрова (100 мл 1 % ПВ, 1 мл індикатора фенолрот, 0,75 г глюкози, рН 7,4-7,6) інкубують при 37 °С 48-72 год. Посіви на середовище Сєрова витримують 15-20 діб у холодильнику з наступним висівом на диференціальні середовища. Підозрілі колонії дрібні, круглі, опуклі, безбарвнідосліджуютьмікроскопічнойпересіваютьнасередовище Олькеницького. Колонії Y. pseudotuberculosis у R-формі майже такі самі, як у збудника чуми, але в своєму розвитку не мають стадії “битого скла”. Ідентифікують культури за звичайною схемою (посів на середовище Гісса, фаголізис, визначеннясеротипівзадопомогоюдіагностичнихаглютинуючихсироваток). Диференціацію з іншими ієрсиніями проводять за додатковими тестами (табл. 47).
228 |
Частина ІІІ. Спеціальна мікробіологія |
Длясерологічноїдіагностикипсевдотуберкульозуставлятьрозгорнутуоб’ємну реакцію аглютинації (подібно до реакції Відаля) з відповідними діагностикумами. Антитілавкровіхворихнакопичуються надругомутижні хвороби. Діагностичний титр 1:200 і вище. Ще кращі результати дає постановка РНГА з антигеннимеритроцитарнимдіагностикумом. Позитивноюцюреакціювважаютьпрититрі антитіл 1:400 і вище. Розроблена також схема постановки реакції ензиммічених антитілзвикористаннямполістириловихпланшетзадсорбованимнатвердійфазі антигеном.
Біологічнупробукращепроводитинагвінейськихсвинках, оскількиієрсинії, виділені від людини, мало патогенні для мишей. Заражені свинки гинуть через 4- 12 днів. У тварин досліджують мазки – відбитки з органів і роблять посіви на живильні середовища з наступною ідентифікацією виділених культур.
Алергічну пробу ставлять, починаючи з другого тижня захворювання. Стан сенсибілізації розвивається з 7-20-го дня і зберігається протягом 2-5 років. Алергенвводятьвнутрішньошкірновоб’ємі0,1 мл. Облікреакціїпроводятьчерез48 год. При позитивній пробі виникає почервоніння й інфільтрат, які часом сверблять і болючі.
Кишечнийієрсиніоз
Ієрсиніоз кишечника викликаєYersinia enterocolitica. Захворювання характеризуєтьсягарячкою, переважним ураженнямтравногоканалу, токсико-алергічни- мипроявами, різноманітністю клінічних форм. Зараження людини настає аліментарнимшляхом черезхарчовіпродуктиіводу, контаміновані виділеннями хворих тварин. Джерелом інфекції для людини є хворі на ієрсиніоз гризуни і синатропні тварини(корови, свині, кози, телята, коні). Цезахворюваннямаємісцеубільшості країнсвіту, аленайчастішезустрічаєтьсяускандинавськихкраїнах. ВУкраїніспостерігаються спорадичні випадки.
АнтигеннаструктураY. enterocolitica складна. ЗахарактеромО-антигенуроз- різняють34 серовари. Переважнабільшістькультур, виділенихвідхворихлюдей, відносяться до сероварів 03, 05, 08, 09.
Мікробіологічна діагностика кишечного ієрсиніозу багато в чому подібна до бактеріологічнихдослідженьприпсевдотуберкульозі. Припідозріннінацезахворюванняобов’язководосліджуютькров, випорожнення, блювотнімаси, дуоденальнийвміст, сечу, ліквор. Приоперативнихвидаленняхчервоподібноговідростка та лімфатичних вузлів посіви роблять з цих емульгованих органів. Якщо на початку хвороби є запалення глотки і мигдаликів, досліджують слиз із носоглотки.
Посівироблятьнащільнідиференціально-діагностичніагариЕндоабоПлос- кирєва та середовище збагачення (селенітовий бульйон). Для виділення Y.enterocolitica із фекалій зарубіжні фірми пропонують щільні селективні середовища, що містять цефсулодин, іргазан і новобіоцин (CIN-агар) та агар Мак Конкі.
Оптимальна температура для культивування 28-30 °С. На цих середовищах колонії дрібні, блискучі, часто опуклі, мають голубуватий відтінок. На агарі Ендо
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
229 |
мають слабо рожевеве забарвлення. R-форми колоній для цього виду ієрсиній не характерні.
Ізольовані колонії досліджують мікроскопічно, на рухливість при 25 °С, відсівають на середовище Олькеницького й ідентифікують так само, як і Y. enterocolitica.
Для серологічноїдіагностики кишечного єрсиніозу використовуютьреакцію об’ємної аглютинації, РНГА, метод ІФА. Важливо ставити ці реакції з парними сироватками. Наростання титру антитіл в 4 рази і більше свідчить про специфічність інфекційного процесу.
Можливатакож постановкаалергічноїпробиздіагностичноюметоюіекспериментальне зараження лабораторних тварин.
Туляремія
Туляремія– гостра інфекційна хвороба з природною вогнищевістю, характеризується гарячкою, ураженням лімфатичних вузлів, шкіри, мигдаликів, легень, очей та інших органів. Збудник захворювання Francisella tularensis. Туляремійні бактерії в S-формі мають два антигени – О і Vi (капсульний). О-антиген виявляє спорідненість до антигенів бруцел. Розрізняють три підвиди збудника туляремії: голарктичний (для країн північного регіону), неарктичний (американський) і середньоазіатський. Резервуаром і джерелом інфекції є різні види диких і домашніх гризунів (ондатри, водяні пацюки, зайці, миші, хом’яки та ін.), а також свійські тварини (свині, вівці, корови). Людина заражується тільки від тварин, від людини до людини збудник не передається.
Зараженнявідбуваєтьсяконтактно-побутовимшляхом(приконтактізхвори- митваринамиіїхвиділеннями); аліметарним(привживанніінфікованихпродуктів харчування і води); повітряно-пиловим (під час обмолоту зернових, обробки фуражу тощо); трансмісивним (через укуси кровосисних комах). Для людини мінімальна інфікуюча доза – одна мікробна клітина.
Припроведеннідіагностикитуляреміївикористовуютьбактеріологічний, біологічний, серологічний і алергічний методи. Перевагу надають серологічним реакціям і алергічним пробам, які можна провести в будь-яких клінічних і мікробіологічнихлабораторіях. Зараженнялабораторнихтваринівиділеннячистихкультурможливетількивлабораторіяхдлядіагностикиособливонебезпечнихінфекцій.
Залежно від клінічної форми туляремії, у хворих беруть такі матеріали для дослідження: слизізротоглотки, пунктатбубону, харкотиння, кров, гнійізкон’юнктиви, вміст пустул і виразок. Досліджують також органи загиблих гризунів, воду, повітря, кровосисних комах, харчові продукти, контаміновані виділеннями тваринігризунів. Взяттяматеріалутайогодоставкадолабораторіїздійснюєтьсяпри суворомудотриманніправилроботиіззбудникамиособливонебезпечнихінфекцій.
Біологічне і бактеріологічне дослідження. Бактеріологічний метод діагно-
стикитуляремії маєважливу особливість – виділитизбудниквпершихгенераціях безпосередньовідхворогомайженіколиневдається. Томудосліджуванимматері-
230 |
Частина ІІІ. Спеціальна мікробіологія |
алом спочатку заражають гвінейських свинок (краще) або білих мишей, а потім від них виділяють та ідентифікують чисту культуру. Цей метод є самим чутливим для виявлення туляремійних бактерій у будь-якому матеріалі. DLM для цих тварин – одна мікробна клітина.
Заражають дві гвінейські свинки або 3-5 білих мишей. Тварини гинуть на 5-14 добу. Якщо вони залишаються живими, їх забивають, роблять розтин; кров, кістковий мозок, емульговані лімфатичні вузли і паренхіматозні органи сіють на згорнуте жовтковесередовищеМак-КояіЧепіна абоглюкозо-цистиновий кров’я- ний агар Френсіса. При необхідності до середовищ додають 100 ОД пеніциліну для пригнічення росту сторонньої мікрофлори. Запропоновано також рідке елективне середовище з амінокислотами, вітамінами, мікроелементами. На простих середовищахзбудниктуляреміїнеросте. Туляремійнібактеріїможнатакожвиділити шляхом зараження в жовтковий мішок курячих ембріонів, де їх легко виявити задопомогоюметодуімунноїфлуоресценції. Посівивирощуютьутермостатіпротягом 3-5 днів при температурі 37 оС. Паралельно з посівами з тих же матеріалів загиблихтваринготуютьмазки-відбиткийзабарвлюютьїхзаметодомРомановсь- кого-Гімзи. Збудники туляремії мають вигляд маленьких (0,2-0,7 мкм) кокоподібнихабопаличкоподібнихбактерій. Умазкахізорганіввонимаютьніжнукапсулу.
НасередовищіМак-КояіЧепінатуляремійнібактеріїростутьувиглядініжних маленькихколоній, щонагадуютькрапелькироси. НаагаріФренсісаколоніїкруглі згладенькоюповерхнею, молочногокольору, слизуваті, оточенізеленимореолом. Рідке середовище мутніє, на дні утворюється слизовий осад.
Типові колонії досліджують мікроскопічно, пересівають у напіврідке елективне середовище в пробірці; культури, що виросли, ідентифікують за морфологічними (дуже дрібні грамнегативні кокобактерії), культуральними ознаками (не ростутьнапростихсередовищах), біохімічнимивластивостями(розкладаютьглюкозу, мальтозу, левульозу, виділяють сірководень, не утворюють індолу) та в реакції аглютинації із специфічною аглютинуючою сироваткою. Остання реакція і позитивна біопроба є вирішальними при визначенні збудника туляремії.
Для виділення туляремійних мікробів із води 1 л її попередньо фільтрують через мембранні фільтри або центрифугують. Ресуспензованим осадом із мембрани або з дна центрифужної пробірки заражають білих мишей. Змиви з різних об’єктів тахарчовіпродуктидосліджують нанаявність збудників туляремії також методом біопроби.
Серологічна діагностика. У звичайних клінічних умовах для діагностики туляремії проводять тільки серологічні реакції й алергічну пробу з тулярином. Починаючи з 10-12 дня хвороби ставлять об’ємну реакцію аглютинації, яка за методикою не відрізняється від реакції Райта. У хворого беруть 2-3 мл крові з ліктьової вени або пальця, отримують сироватку, яка повинна бути абсолютно прозорою. Реакцію ставлять із розведеннями сироватки від 1:50 до 1:800, супроводжуючи її відповідними контролями (табл. 48).
Антигеном в реакції аглютинації служить туляремійний діагностикум, в 1 мл якогоміститься10 млрдмікробнихтіл. Передвживаннямйогорозводятьу10 разів.
