
- •Денної форми навчання за напрямом
- •6.050201 – “Системна інженерія”
- •(Розділи “фізичні основи механіКи", "основи молекулярНої фізиКи і термодинаміКи”)
- •Укладач к.Ф.-м.Н., доц. О.В. Сукачов
- •Кафедра фізики
- •Заступник голови методичної ради __________________ доц. С.А. Сергієнко
- •1 Фізичні основи механіки програма розділу
- •Основні закони і формули
- •Загальні вказівки
- •Приклади розв’язування типових задач
- •2 Основи молекулярної фізики і термодинаміки програма розділу
- •2.1 Макроскопічні стани речовини. Молекулярно-кінетична теорія газів
- •2.2 Статистичні розподіли
- •2.3 Основи термодинаміки
- •2.4 Реальні гази, рідини і тверді тіла
- •Основні закони і формули
- •Загальні вказівки
- •Список літератури
- •Табличні дані
- •Робочої навчальної програми з фізики
- •Укладач к.Ф.-м.Н., доц. О.В. Сукачов
- •39600, М. Кременчук, вул. Першотравнева, 20
Загальні вказівки
Приблизний алгоритм розв’язання задач цього розділу такий:
-
записати коротку умову задачі, подавши всі величини в системі СІ;
-
якщо в задачі розглядаються два різних стани газу, необхідно встановити, чи змінюється маса газу при переході з одного стану в інший:
-
якщо маса газу не змінюється, щоб застосувати рівняння ізопроцесу газу, необхідно побачити, який термодинамічний параметр стану газу (P, V або T) не змінюється за умовою задачі, щоб правильно вибрати і застосувати відповідний газовий закон;
-
якщо у двох станах газу маса різна, то для кожного стану треба застосувати рівняння Менделєєва–Клапейрона;
-
якщо в задачі задається один стан газу й потрібно визначити якийсь параметр цього стану, треба використати рівняння Менделєєва–Клапейрона;
-
застосовуючи перший закон термодинаміки, треба враховувати, що в його рівнянні кожна величина може бути додатною або від’ємною залежно від характеру процесу;
-
у задачах на теплову машину треба пам’ятати, що формула її ККД = А/Q1 використовується для будь-якої теплової машини, а формула максимального ККД = (Т1 –Т2)/Т1 – тільки для ідеальної, що працює за циклом Карно;
-
використовуючи зв’язки між фізичними величинами, що подані в умові задачі, треба написати додаткові рівняння таким чином, щоб число рівнянь дорівнювало числу невідомих величин;
-
розв’язати отриману систему рівнянь, записавши відповідь у загальному вигляді (тобто у вигляді формули) і виділити її;
-
підставити числові значення величин, що входять до відповіді, виконати обчислення й отримати числове значення відповіді;
-
проаналізувати відповідь, оцінити її реальність, за необхідності перевірити розмірність отриманого результату.
Рівняння стану ідеального газу. Ізопроцеси в газах.
№17. Визначити масу молекули метану (СН4).
Д ано:
ано:
NА = 6,021023 1/моль Визначаємо молярну масу метану:
М(СН4) = 1610-3 кг/моль М = (12+41)10-3 кг/моль = 1610-3 кг/моль.
то – ?
Ураховуючи, що в 1 молі речовини
міститься NА –
число Авогадро молекул, маємо:
![]() .
.
Обчислюючи, отримуємо:
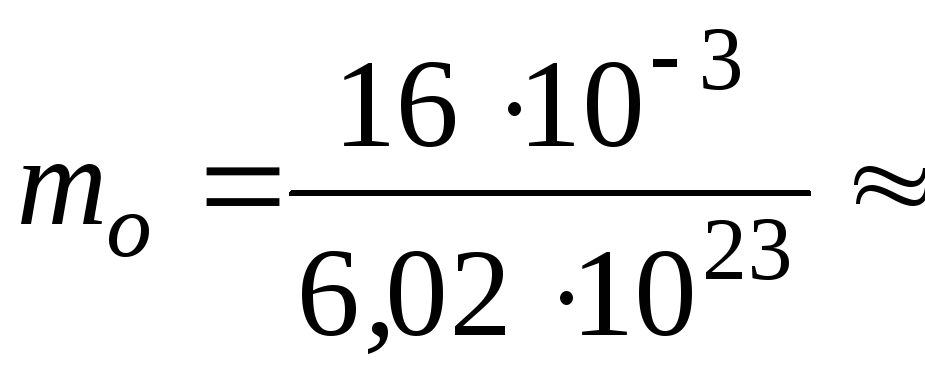 2,6610-23
(кг).
2,6610-23
(кг).
№18. Визначити густину повітря за нормальних умов.
Д ано:
Записуємо коротку умову задачі,
враховуючі табличні
PА
100 кПа = 105 Па дані М і R.
Запишемо рівняння Менделєєва–Клапейрона:
ано:
Записуємо коротку умову задачі,
враховуючі табличні
PА
100 кПа = 105 Па дані М і R.
Запишемо рівняння Менделєєва–Клапейрона:
Т =
0С = 273 К ![]() .
Ураховуючи, що
.
Ураховуючи, що
![]() ,
маємо:
,
маємо:
М = 2910-3 кг/моль ![]() ,
звідки
,
звідки ![]() .
.
R = 8,31 Дж/мольК Тепер підставляємо дані з умови задачі й обчислюємо:
– ?
 1,28
(кг/м3).
1,28
(кг/м3).
№19. Газ стиснуто ізотермічно від об’єму 4 л до об’єму 3 л. Тиск при цьому збільшився на 4 кН. Визначити початковий тиск газу.
 Дано:
Дано:
V1 = 4 л = 4 10-3 м-3 За законом Бойля-Маріотта (оскільки Т = const):
V2 = 3 л = 4 10-3 м-3 P1V1=P2V2 .
P = 4 кПа = 4103 Па Ураховуючи, що Р2=Р1+Р, отримаємо:
Т1 = Т2 P1V1=(Р1+Р)V2.
Р1 - ? Звідси маємо: P1V1 = Р1V2 + РV,
![]() .
.
Обчислюємо: ![]() =12103
(Па).
=12103
(Па).
№20. У балоні міститься суміш метану і кисню. Визначити молярну масу сіміші, якщо масова доля метану складає 2/3.
 m1
/m
= w1
= 2/3 Молярну
масу суміші визначимо за формулою:
m1
/m
= w1
= 2/3 Молярну
масу суміші визначимо за формулою:
M1 = 1610-3 кг/моль М = т/,
M2 = 3210-3 кг/моль де т = т1 + т2 – масса суміші,
M –
? =
1+ 2 =
![]() – її кількість.
– її кількість.
Ураховуючи, що m2 /m = (т – m1) /m = 1 – w1, звідси маємо:
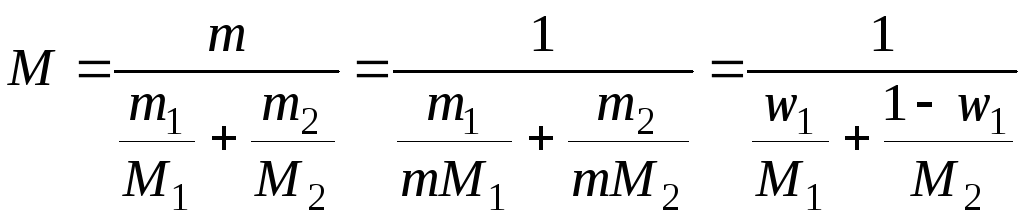 .
Обчислюємо:
.
Обчислюємо:
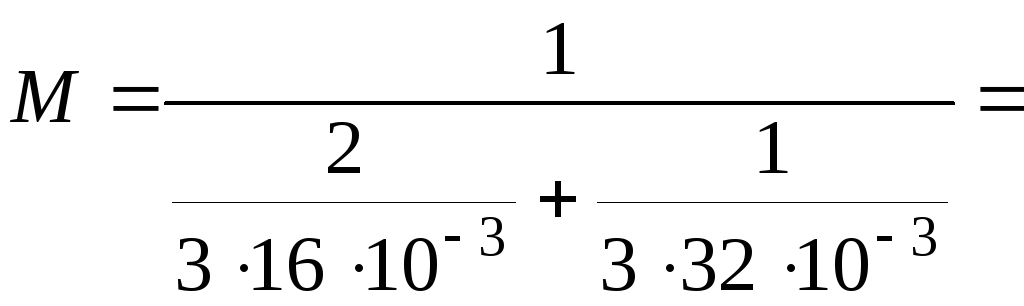 19,210-3
(кг/моль).
19,210-3
(кг/моль).
№ 21. Балон
вміщує суміш 64 г кисню і 320 г аргону. Тиск
суміші 600 кПа, температура 27С.
Визначити об’єм балона.
21. Балон
вміщує суміш 64 г кисню і 320 г аргону. Тиск
суміші 600 кПа, температура 27С.
Визначити об’єм балона.
Дано:
m1 = 64 г = 6410-3 кг Запишемо рівняння Менделєєва-Клапейрона окремо
m2 = 320 г = 32010-3 кг для кисню і для аргону:
Т =
27С = 300 К ![]() ,
, ![]() ,
,
Р = 6105 Па де Р1 і Р2 – парціальні тиски кисню і аргону.
M1 = 3210-3 кг/моль Складемо окремо ліві й праві частини цих двох рівнянь:
M2
= 4010-3 кг/моль ![]() .
.
R = 8,31 Дж/мольК Згідно з законом Дальтона Р = Р1 +Р2 ,
V - ?
звідси
одержимо: ![]() .
.
Виконаємо розрахунки:
![]() 41,510-3
(м3).
41,510-3
(м3).
№ 22. З
балона зі стиснутим киснем витратили
частину газу таким чином, що його тиск
зменшився від 10 МПа до 7 МПА.
Температура змінилася від 27С
до 17С. Визначити,
яку частину газу витратили.
22. З
балона зі стиснутим киснем витратили
частину газу таким чином, що його тиск
зменшився від 10 МПа до 7 МПА.
Температура змінилася від 27С
до 17С. Визначити,
яку частину газу витратили.
Дано:
Р1 = 9 Мпа = 9106 Па Згідно з рівнянням Менделєєва-Клапейрона:
Р2
= 5,8 Мпа = 5,8106
Па ![]() ,
,
![]() .
Звідси знаходимо:
.
Звідси знаходимо:
Т1
= 27С = 300 К
![]() ,
,
![]()
Т2
= 17С = 290 К ![]() =
=![]() .
.
m/m1
- ? ![]()
Обчислюємо відповідь:
![]()
![]() .
.
№23. Визначити висоту, де атмосферний тиск зменшиться вдвічі у порівнянні з тиском на поверхні Землі. Уважати, що температура повітря дорівнює 17С і не змінюється з висотою.
Д ано:
Записуємо коротку умову задачі,
враховуючі таб-
ано:
Записуємо коротку умову задачі,
враховуючі таб-
РА / Р = 2 личні дані М і R. Згідно з барометричною
Т =
17С = 290 К
формулою:
![]() ,
звідки
,
звідки
М
= 2910-3 кг/моль ![]() .
Логарифмуючи, отримаємо:
.
Логарифмуючи, отримаємо:
g
10 м/с2 ![]() .
Обчислюємо:
.
Обчислюємо:
R
= 8,31
Дж/мольК 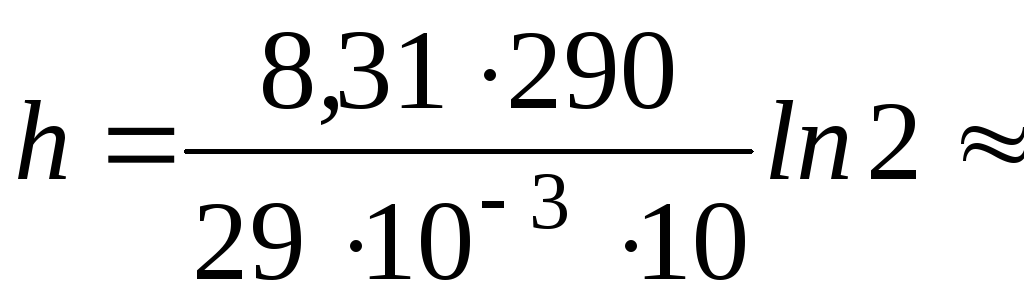 5,8103 (м).
5,8103 (м).
h – ?
Основи термодинаміки
№24. Визначити питому теплоємність при постійному об’ємі суміші газів, яка складається з 5 л кисню і 3 л гелію. Гази знаходяться в однакових умовах.
Д ано:
ано:
V1 = 5 л = 510-3 м3 Питома теплоємність визначається за формулою:
V2
= 3 л = 310-3
м3
![]() , де
, де
![]() =
=
P1 =P2;
Т1 =Т2
![]() –
теплота, яку отримала суміш,
М1 = 3210-3
кг/моль m = m1
+ m2 – маса
суміші газів, і1(О2)
= 5, і2 (Не) = 3 –
–
теплота, яку отримала суміш,
М1 = 3210-3
кг/моль m = m1
+ m2 – маса
суміші газів, і1(О2)
= 5, і2 (Не) = 3 –
М2 = 410-3 кг/моль число ступенів вільності молекул.
сV – ? Масу і кількість кожного газу визначимо з рівнянь Мен-
дєлєєва–Клапейрона для кожного газу:
![]() і
і
![]() ,
,
звідки
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Підставляючи у відповідні формули, отримуємо:
![]() ,
,
![]()
![]()
![]() ,
звідки:
,
звідки:
![]() =
= =
=![]() .
.
Обчислюємо:
![]() 99
Дж/кгК.
99
Дж/кгК.
№25. Кисень знаходиться в об’ємі 1 м3 під тиском 0,2 МПа. Газ був нагрітий спочатку при постійному тиску до об’єму 3 м3, а потім при постійному об’ємі до тиску 0,5 МПа. Визначити зміну внутрішньої енергії газу, виконану газом роботу і теплоту, одержану газом.
Д ано:
ано:
V1 = 1 м3; V2 = 3 м3 Зміна внутрішньої енергії ідеального газу:
P1
= 0,2 Мпа = 2105 Па
![]() ,
,
V3 = V2; P2 = P1 де Т =Т3 – Т1 різниця температур в кінцевому і
P3 = 0,5 Мпа = 5105 Па початковому стані, і(О2) =5 – число ступенів вільності
U13, A13, Q13 - ? молекули 2-атомного газу.
Початкову і кінцеву температури знайдемо з рівнянь Менделєєва-Клапейрона:
![]() і
і
![]() ,
звідки
,
звідки
![]() ,
,
![]()
або
![]() =
=
![]() .
.
Робота газу при постійному тиску: А12
= P1
(V2
– V1),
при постійному об’ємі:
А23 = 0.
Тобто А13
= А12 +А23
=
![]() .
.
Згідно з першим законом термодинаміки:
Q13 = U13
+ A13 =
![]()
![]() .
.
Підставляючи дані задачі, обчислюємо:
U13 =
![]() = 3,25106 (Дж).
= 3,25106 (Дж).
A13 = 2105(3 - 1) = 0,4106 (Дж). Q13 = 3,25106+ 0,4106 = 3,65106 (Дж).
№26. У циліндрі під поршнем знаходиться водяна пара масою 50 г за температури 27С. Спочатку пара розширилася адіабатно, збільшивши об’єм у n1 = 5 разів, а потім пара була стиснута ізотермічно, причому об’єм пари зменшився у n2 = 5 разів. Визначити температуру в кінці адіабатного процесу і роботу, виконану парою в цих процесах.
Д ано:
ано:![]()
m = 50 г = 5010-3 кг Температура та об’єм газу в адіабатному процесі (12)
M = 1810-3 кг/моль пов’язані між собою співвідношенням:
Т1
= 27С
= 300 К
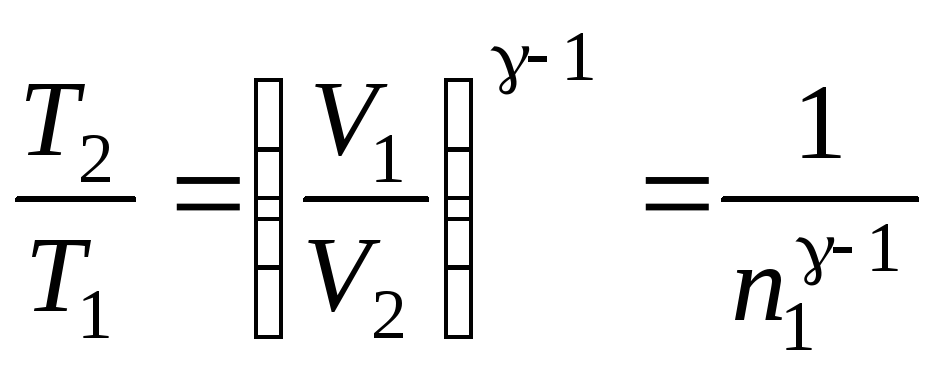 ,
звідки:
,
звідки:![]() .
Тут
.
Тут
![]() –
–
Т3 =Т2 показник адіабати, і(Н2О) = 6 – число ступенів вільності V2/V1 = n1 = 5 молекули 3-атомного газу.
V2/V3 = n2 = 5 Оскільки для адіабатного процесу Q12 = 0, перший закон T2, A12, A23 – ? термодинаміки має вигляд: A12 +U12 = 0.
Тобто робота газу
![]()
![]() .
.
Робота газу
в ізотермічному процесі (23)
може бути знайдена за формулою:
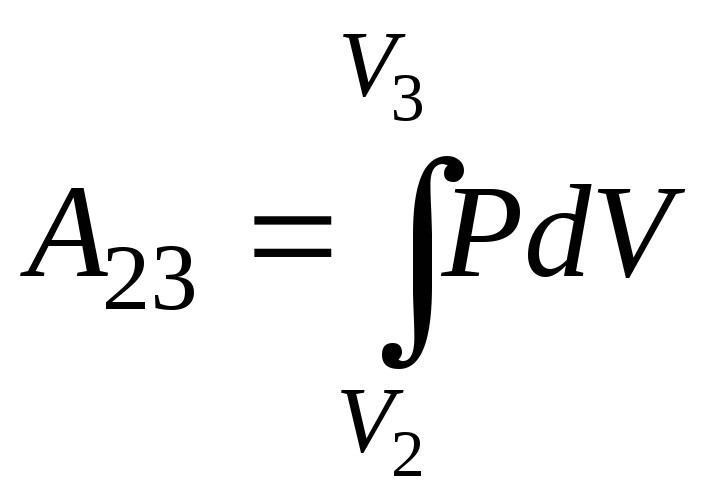 .
.
З рівняння Менделєєва–Клапейрона
визначаємо тиск
![]() і підставляємо у формулу для знаходження
роботи:
і підставляємо у формулу для знаходження
роботи:
А23=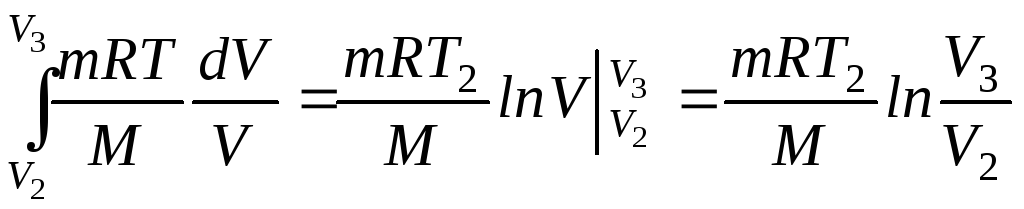 ,
тобто:
,
тобто:
![]()
Виконаємо
обчислення, урахувавши, що
![]() ,
,
![]() 176 К,
176 К,
![]() 8587 (Дж), робота розширення газу
додатна.
8587 (Дж), робота розширення газу
додатна.
![]() –6539 (Дж), робота стискання газу
від’ємна.
–6539 (Дж), робота стискання газу
від’ємна.
№27. Ідеальний газ виконує цикл Карно. Температура нагрівача Т1 в n = 5 разів вища за температуру охолоджувача Т2. Яку кількість теплоти отримав газ від нагрівача, якщо виконана ним корисна робота становить А = 20 кДж?
Дано: Формула ККД теплового двигуна:
=![]() ,
,
А = 20103 Дж
ККД циклу Карно:
=
= 20103 Дж
ККД циклу Карно:
=![]() ,
,
n = T1 /T2 = 5 де Т1 – температура нагрівача, Т2 – температура охолоджувача.
Q1
- ? Прирівнюючи, одержуємо:
![]() ,
звідки:
,
звідки:
![]() .
.
Підставляючи числові значення, обчислюємо
![]() 6,25103 (Дж).
6,25103 (Дж).
№28. Ідеальна теплова машина піднімає вантаж масою 400 кг. Робочий газ отримує від нагрівача за температури 217C кількість теплоти 80 кДж. На яку максимальну висоту піднімає вантаж ця теплова машина, якщо температура охолоджувача дорівнює 17C?
Д ано:
На піднімання вантажу витрачається
корисна робота,
ано:
На піднімання вантажу витрачається
корисна робота,
m = 400 кг яка йде на збільшення потенціальної енергії вантажу:
Q1 = 80103 Дж А = Wn = mgh.
T1 = 217C = 500 K Корисну роботу можна визначити з формули ККД тепло-
T2 =
17C = 300 K вої
машини: =![]() ,
де Q1 - кількість теплоти,
яка переда-
,
де Q1 - кількість теплоти,
яка переда-
h - ? ється робочому газу від нагрівача.
ККД ідеальної теплової машини визначається
за формулою:
![]() ,
,
де Т1 – температура нагрівача, Т2 – температура охолоджувача.
Звідси одержуємо:
A =
Q1
=![]() .
.
Тепер знаходимо висоту підйому вантажу:
![]() .
.
Підставляючи числові значення величин з умови задачі, обчислюємо:
![]() =
8 (м).
=
8 (м).
