
Элементы химической термодинамики. Химическая кинетика. Химическое равновесие
1. Термохимия. Законы термохимии
В основе термохимических расчетов закон Гесса (1840 г.):
тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (ΔHх.р.) равен сумме теплот образования ΔHобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов:
ΔHх.р = ΣΔHпродобр - ΣΔHисхобр .
П р и м е р 1
Исходя из теплоты образования газообразного диоксида углерода (ΔH0 = -393,5 кДж/моль) и термохимического уравнения реакции:
С(графит) + 2N2O(г) = CO2(г) + 2N2(г); ΔH0 = -557,5 кДж (1)
вычислите теплоту образования N2O(г).
Решение
Обозначив искомую величину через х, запишем термохимическое уравнение реакции
образования N2O из простых веществ:
N2(г) + 1/2О2(г) = N2O(г); ΔH01 = х кДж. (2)
Запишем также термохимическое уравнение реакции образования CO2(г) из простых веществ:
С(графит) + O2(г) = CO2(г); ΔH02 = -393,5 кДж. (3)
Из уравнений реакций (2) и (3) можно получить уравнение реакции (1). Для этого умножим уравнение (2) на два и вычтем найденное уравнение из уравнения (3). Имеем:
С(графит) + 2N2O(г) = CO2(г) + 2N2(г); ΔH0 = (-393,5 - 2х) кДж. (4)
Сравнивая уравнения (1) и (4), находим: -393,5 -2х = -557,5.
Отсюда х = 82,0 кДж/моль.
П р и м е р 2
Пользуясь данными табл. 1, вычислите ΔH0 реакции:
2Mg(к) + СО2(г) = 2МgО(к) + С(графит).
Решение
Стандартные энтальпии образования СО2(г) и МgО(к) равны соответственно -393,5 и -601,8 кДж/моль (стандартные энтальпии образования простых веществ равны нулю). ΔH0 реакции находим по уравнению (1.2.)
ΔH0 = 2ΔH0MgO - ΔH0CO2 = 2(-601,8) + 393,5 = -810,1 кДж.
П р и м е р 3
Рассчитайте теплоту сгорания метана и количество теплоты, которое выделится
при сгорании 100 л этого вещества.
Решение
Под теплотой сгорания вещества подразумевают тепловой эффект реакции окисления
одного моля этого соединения. В случае органического соединения продуктами окисления обычно бывают СО2(г) и Н2О(г).
Реакцию сгорания метана можно представить уравнением:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г) (1)
Используя следствие закона Гесса и стандартные энтальпии образования веществ (табл. 1), определяем изменение энтальпии при протекании реакций:
![]()
или ΔΗ0 = -393,5 + 2(-241,8) - (-74,9) = - 402,2 кДж.
ΔΗ0 = - Q, следовательно, при сгорании одного моля СН4 выделяется 402,2 кДж теплоты. ν(СН4) = 100 л/22,4л = 4,46 моль.
Количество теплоты при сгорании 4,46 моль составит 4,46•402,2 = = 1795,5 кДж.
Таблица 1 Значения ΔН0, S0, ΔG0
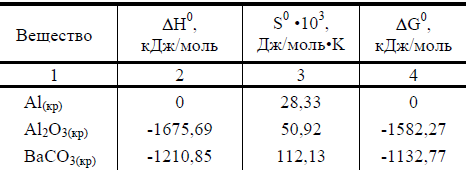


![]()
П р и м е р 4
В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном при той же температуре?
Решение
Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии его кристаллов при одинаковой температуре.
П р и м е р 5
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствущих веществ (табл. 1) вычислите ΔG0 реакции, протекающей по уравнению:
NH3(г) + НСl(г) = NH4Cl(кр).
Может ли эта реакция при стандартных условиях протекать самопроизвольно?
Решение Энергия Гиббса (ΔG0) является функцией состояния и вычисляется из соотношения (1.4). Величины ΔH0 и ΔS0 находим из соотношений (1.2):

Так как ΔG < 0, то реакция протекает самопроизвольно при стандартных условиях.
П р и м е р 6
Реакция восстановления Fe2O3 водородом протекает по уравнению:
Fe2O3(кр) + 3H2(г) = 2Fe(кр) + 3H2O(г); ΔH = +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔS = 0,1387 кДж/(моль•K)? При какой температуре начнется восстановление Fe2O3?
Решение
Вычисляем ΔG реакции:
ΔG = ΔH - TΔS = 96,61 - 298•0,1387 = +55,28 кДж.
Так как ΔG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия).
Найдем температуру, при которой ΔG = 0:
ΔH = TΔS; T = ΔH/ ΔS = 96,61/0,1387 = 696,5 К.
Следовательно, при температуре 695,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
П р и м е р 7
Вычислите ΔH0х.р, ΔS0х.р, ΔG0T реакции, протекающей по уравнению:
Fe2O3(кр) + 3С(графит) = 2Fe(кр) + 3CO(г).
Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К?
Решение
ΔHх.р. и ΔSх.р находим из соотношений (1.2) и (1.3):
ΔHх.р. = [3(-110,53) + 2•0] - [-822,16+3•0] = -331,56 + 822,10 = +490,57 кДж;
ΔSх.р = (2•27,15 + 3•197,55) - (87,45 + 3•5,74) = 542,28 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения (1.4):
ΔG500 = 490,57 - 500•542,28/1000 = 219,43 кДж;
ΔG1000 = 490,57 - 1000•542,28/1000 = -51,71 кДж.
Так как ΔG500 > 0, а ΔG1000 < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 500 К.
З а д а ч и
При решении задач данного раздела использовать таблицу 1.
1 Теплоты растворения сульфата меди (CuSO4) и медного купороса (CuSO4•5H2O), равны -66,11кДж и 11,72 кДж соответственно. Вычислите теплоту гидратации сульфата меди.
2 Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения одного моля этана (C2H6(г)), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании этана объемом 1 л (н.у.)?
3 Реакция горения бензола выражается термохимическим уравнением:
C6H6(ж) + 7/2O2(г) = 6CO2(г)+ 3H2O(г).
Вычислите тепловой эффект этой реакции.
4 Газообразный этиловый спирт можно получить при взаимодействии этилена и водяных паров. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект.
5 Напишите термохимическое уравнение реакции взаимодействия оксида углерода(II) и
водорода, в результате которой образуются газообразные метан и вода. Сколько теплоты выделится при этой реакции, если был получен метан объемом 67,2 л (н.у.)?
6 Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и HCl. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект. Сколько теплоты выделится, если в реакции был израсходован аммиак объемом 10 л (н.у.)?
7 При сгорании газообразного аммиака образуются пары воды и оксид азота(II). Сколько
теплоты выделится при этой реакции, если был получен оксид азота(II) объемом 44,8 л (н.у.)?
8 Реакция горения метилового спирта выражается термохимическим уравнением:
CH3OH(ж) + 3/2O2(г) = CO2(г) + 2H2O(ж)..
Вычислите тепловой эффект этой реакции.
9 При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и газообразный сероуглерод (CS2). Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект.
10 На основании значений ΔG0, различных кислородных соединений щелочных металлов, приведенных в табл. 2, определите образование каких соединений наиболее характерно для различных щелочных металлов.
Таблица 2
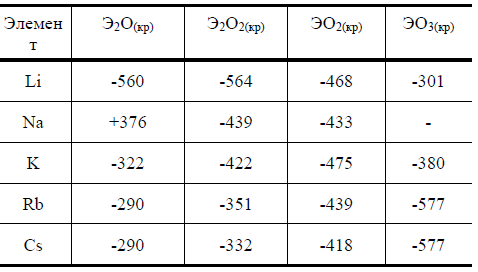
Чем можно объяснить наблюдаемые закономерности ?
11 При взаимодействии 1 моля водорода и 1 моля селена поглотилось 77,4 кДж тепла. Вычислите энтальпию образования селеноводорода.
12 При взаимодействии 2 молей мышьяка и 3 молей водорода поглотилось 370 кДж тепла. Вычислите энтальпию образования арсина.
13 При взаимодействии 1 моля водорода и 1 моля хлора выделилось 184 кДж тепла. Вычислите энтальпию образования хлороводорода.
14 При образовании 1 моля воды из простых веществ выделилось 242 кДж тепла. Чему равна энтальпия образования воды?
15 При взаимодействии 1 моля азота и 3 молей водорода выделилось 93 кДж тепла. Чему равна энтальпия образования аммиака?
16 Вычислите, какое количество теплоты выделится при восстановлении оксида железа(III) металлическим алюминием, если было получено железо массой 335,1 г.
17 При сжигании графита образовался диоксид углерода массой 8,86 г и выделилось 79,2 кДж тепла. Вычислите теплоту образования диоксида углерода.
18 При разложении карбоната магния на оксид магния и диоксид углерода поглощается 100,7 кДж тепла. Вычислите теплоту образования карбоната магния.
19 При сгорании жидкого этилового спирта массой 11,5 г выделилось 308,71 кДж тепла.
Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2H5OH(ж).
20 При восстановлении оксида железа(III) массой 80,0 г алюминием (реакция алюмотермии) выделяется 426,3 кДж тепла. При сгорании металлического алюминия массой 5,4 г выделяется 167,3 кДж тепла. На основании этих данных вычислите теплоту образования оксида железа(III).
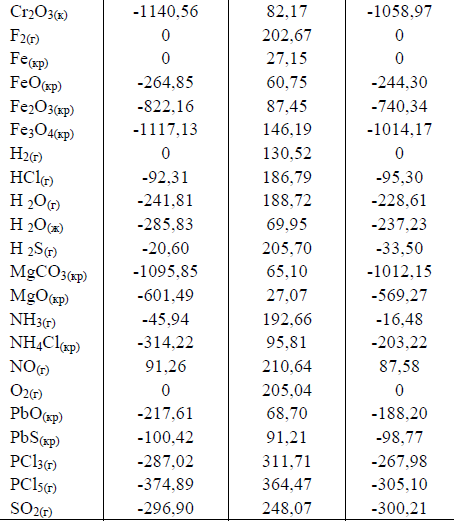
21 Вычислите ΔG0 реакций образования AgГ(т) и CaГ2(т) из ионов в растворе, использовав термодинамические данные, приведенные в табл. 3.
Таблица 3

Как изменяется растворимость AgГ и CaГ2 в ряду F-→Cl-→Br-→I-? Сопоставьте характер
изменения в этом ряду значений ΔG0 обр. и ПР. Величины ПР для галогенидов серебра в этом ряду имеют следующие значения (кроме фторида серебра) 1,8•10-10; 5,3•10-13; 8,37•10-17 соответственно. Почему для фторида серебра отсутствуют данные по ПР?
22 Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2(г) = 2N2(г) + 6Н2О(ж); ΔH0 = -1530,28 кДж.
Вычислите теплоту образования аммиака.
23. Восстановление диоксида свинца водородом протекает по уравнению:
PbO2 + H2 = PbO + H2O (г) – 182,8 кДж.
Определите стандартную теплоту образования PbO2.
24. Определите тепловой эффект реакции
NaH (к) + H2O (ж) = NaOH (р) + H2 (г)
по стандартным теплотам образования веществ, участвующих в реакции, если
ΔH0NaH(к) = –56,94 кДж/моль, ΔH0NaOH(р) = –469,47 кДж/моль.
25. Определить стандартную энтальпию (ΔH0298) образования PH3, исходя из уравнения 2PH3 (г) + 4O2 (г) = P2O5 (к) + 3H2O (ж);
ΔH0= –3852,4 кДж.
26. Исходя из теплового эффекта реакции
3CaO (к) + P2O5 (к) = Ca3(PO4)2 , ΔH0 = 751,8 кДж
определить ΔH0298 образования ортофосфата кальция.
27. При взаимодействии железа массой 6,3 г с серой выделилось 11,31 кДж тепла. Вычислите теплоту образования сульфида железа(II).
28. При сгорании ацетилена объемом 1 дм3 (н.у.) выделяется 56,053 кДж тепла. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования газообразного ацетилена.
29. Вычислите теплоту образования NO(г), исходя из следующих термохимических уравнений:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж); ΔH0 = -1168,80 кДж;
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔH0 = -1530,28 кДж.
30. Вычислите теплоту образования газообразного метана, исходя из следующих
термохимических уравнений:
H2(г) + 1/2O2(г) = H2O(ж); ΔH0 = -285,84 кДж;
С(графит) + O2(г) = CO2(г); ΔH0 = -393,51 кДж;
CH4(г) + 2O2(г) = 2H2O(ж) + CO2(г); ΔH0 = -890,31 кДж.
31. Рассчитайте ΔG0 реакций:
а) CO(г) + 1/2O2(г) = CO2(г);
б) 1/2N2(г) + 3/2H2(г) = NH3(г);
в)C6H6(ж) + NH3(г) = H2(г) + C6H5NH2(ж).
32. При какой температуре наступит равновесие системы:
4HCl(г) + O2(г) = 2H2O(г) + 2Сl2(г); ΔH0 = -114,42 кДж?
33. Восстановление Fe3O4 оксидом углерода идет по уравнению:
Fe3O4(кр) + CO(г) = 3FeO(кр) + СO2(г).
Вычислите ΔG0 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ΔS0 в этой реакции?
34. Возможна ли следующая реакция
2Hg2Cl2 = 2HgCl2 + 2Hg
Ответ подтвердите, рассчитав ΔG0298 этой системы.
35. Определите возможность протекания реакции
2С(графит) + H2 (г) → C2H2 (г),
подсчитав ΔS0298 этого процесса.
36. Определите ΔS0298 системы
H2 (г) + S (к) = H2S (г).
37. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ΔG0298 реакции, протекающей по уравнению NH3 (г) + HСl (г) = NH4Cl (к).
Может ли эта реакция при стандартных условиях идти самопроизвольно?
38. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ΔG0298 реакции, протекающей по уравнению
4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г).
Возможна ли эта реакция при стандартных условиях?
39. Вычислите ΔH0, ΔS0, ΔG0 реакции, протекающей по уравнению
TiO2 (к) + 2C (к) = Ti (к) + 2CO (г).
Возможна ли эта реакция восстановления TiO2 углеродом при температурах 500 и 2000 К?
40. Вычислите ΔG0 и ΔS0 реакции горения ацетилена:
C2H2(г) + 5/2O2(г) = 2СO2(г) + H2O(ж).
41. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция:
H2(г) + CO2(г) = CO(г) + H2O(ж); ΔH0 = -2,85 кДж?
На основании стандартных значений ΔΗ0 и S0 соответствующих веществ определите ΔG0 этой реакции.
42. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ΔG0 реакций, протекающих по уравнениям:
а) CS2(г) + 3O2(г) = CO2(г) + 2SO2(г);
б) Al2O3(кр) + 2Cr(кр) = Сr2O3(кр) + 2Al(кр);
в) CaO(кр) + CO2(г) = CaCO3(кр);
г) 2PbS(кр) + 3O2(г) = 2PbO(кр) + 2SO2(г).
43. При какой температуре наступит равновесие систем:
а) CO(г) + 2H2(г) = CH3OH(ж); ΔH0 = -128,05 кДж;
б) СH4(г) + СO2(г) = 2CO(г) + 2H2(г); ΔH0 = 247,37 кДж;
в) Fe3O4(кр) + CO(г) = 3FeO(кр) + CO2(г); ΔH0 = 34,55 кДж;
г) PCl5(г) = PCl3(г) + Сl2(г); ΔH0 = 92,59 кДж.
44.Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите ΔS0 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
45. Не производя вычислений, укажите, для каких из перечисленных процессов изменение энтропии положительно:
а) MgO(кр) + H2(г) = Mg(кр) + H2O(ж);
б) C(графит) + CO2(г) = 2CO(г);
в) CH3COOH = CH3COO- + H+;
г) 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г);
д) NH4NO3(кр) = N2O(г) + 2H2O(г).
46. При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
47. Укажите, какие из приведенных реакций протекают самопроизвольно и являются экзотермическими:
а) 2H2O2 (ж) = 2H2O (ж) + O2 (г);
б) 3H2 (г) + N2 (г) = 2NH3 (г);
в) N2O4 (г) ↔ 2NO2 (г).
48. Укажите, какая из двух реакций будет протекать самопроизвольно:
а) 2Fe (к) + Al2O3 (к) = 2Al (к) + Fe2O3 (к);
б) 2Al (к) + Fe2O3 (к) = 2Fe (к) + Al2O3 (к).
Необходимые для расчета величины ΔG0298 значения ΔH0298 и S0298 взять из табл. 1 приложения.
49. Вычислив ΔG0298 системы
PbO2 + Pb = 2PbO
на основании ΔH0298 и S0298 реагирующих веществ, определите, возможна ли эта реакция.
50. Исходя из теплоты образования газообразного диоксида углерода (ΔH = –393,5 кДж/ моль) и термохимического уравнения
С(графит) + 2N2О (г) = CO2 (г) + 2N2 (г); ΔH0 = –557,5 кДж (1)
вычислить теплоту образования N2O (г).
51. Пользуясь данными табл.1 приложения, вычислить ΔH0 реакции:
2Mg (к) + СО2 (г) = 2MgO (к) + С(графит).
52. При растворении 16 г CaC2 в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования Ca(OH)2.
53. Определите ΔH0298 Fe2O3, если при реакции
2Fe + Al2O3 = Fe2O3 +2Al
на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты.
54. Тепловой эффект реакции
SO2 (г) + 2H2S (г) = 3S (ромб) + 2H2O (ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
55. Вычислите тепловой эффект реакции
Al2O3 (к) + 3SO3 (г) = Al2(SO4)3 (к),
если известны стандартные теплоты образования реагирующих веществ.
56. Определите количество теплоты, при гашении 100 кг извести водой при 250С, если известны стандартные теплоты образования веществ, участвующих в химической реакции: ΔН0298, Cа O (тв)= - 635,1 кДж/ моль; ΔН0298,Н2О(ж)= -285,84 кДж/моль; ΔН0298,
Ca(OH)2(тв) = - 986,2 кДж/моль.
57. Вычислите ΔН0298, ΔS0298, ΔG0298 для процесса
MgCO3(кр) = MgO (кр) + СО2(г)
Ответ: 101,46 кДж/моль; 174, 9 Дж/мольК ; 43,33 кДж/моль. Процесс невозможен при стандартных условиях.
