
3. Алкени і циклоалкени
Алкенами називаються ненасичені вуглеводні, молекули яких містять один подвійний зв”язок. Ато-ми карбону, зв”язані подвійним зв”язком, знаходяться у стані sp2-гібридизації, подвійний зв”язок є комбінацією - і - зв”язків. Загальна формула гомологічного ряду алкенів СnН2n. Неграничні (не-насичені ) вуглеводні ряду етилену, що містять один подвійний зв”язок, називаються олефінами Структурна ізомерія алкенів обумовлена не тільки будовою карбонового скелету, як це притама-нно алканам, але і положенням подвійного зв”язку в головному карбонвому ланцюгу. Першим гомологом, для якого має місце ізомерія з врахуван-ням цих двох ознак, є алкен C4Н8. Просторова ізомерія алкенів обумовлена наявністю в молекулі подвійного зв”язку і різним розташуванням замісників відносно площини -зв”язку. Багато алкенів існують у вигляді цис- і транс-ізомерів. Фізичні властивості. За фізичними властивостями алкени мало чим відрізняються від алканів з таким же числом атомів в молекулі. Нижчі гомологи С2—С4 при звичайних умовах – гази, С5—С17 — рідини, вищі гомологи – тверді речовини. Алкени нерозчинні у воді, добре розчинні в органіч-них розчинниках.
Способи отримання. Алкени є цінною сировиною для промислового органічного синтезу. В природі вони практично не зустрічаються, тому розроблено багато методів отримання алкенів різної будови.
1. Крекінг алканів. Крекінг – процеси хімічних перетворень органічних сполук, що тривають при високих температурах. Крекінг алканів є найважливіший промисловий спосіб отримання алкенів з висококип”ячих фракцій нафти. Під дією сильного нагрівання (до 700 оС) в молекулах алканів відбувається гомолітичне розщеплення -зв”язку С—С, і при цьому утворюється суміш низько-молекулярних алканів і алкенів:
![]()
2. Реакції елімінування. Ця група реакцій знаходиться в основі більшості способів отримання алкенів. Елімінування – це відщеплення двох атомів або груп атомів від сусідніх атомів карбону з утворенням між ними -зв”язку. Атоми карбону при цьому переходять із sр3- в sp2-гібридний стан. Вихідними речовинами можуть бути представники різних класів органічних сполук.
а) Дегідрогалогенування відбувається при дії спиртових розчинів лугів на моногалогеніди:
![]()
У випадках, коли сусідні атоми карбону не однакові, відщеплення атомів гідрогену відбува-ється переважно від найменше гідрогенізованого атома карбону. Ця закономірність – правило Зайцева.
б) Дегідратація спиртів відбувається при їх нагріванні з сірчаною кислотою або при пропусканні пари спирту над каталізатором.
![]() в)
Дегалогенування
має
місце при нагріванні
дігалогенідів,
які мають
атоми
галогену
у сусідніх
атомів
карбону,
з
активними
металами:
в)
Дегалогенування
має
місце при нагріванні
дігалогенідів,
які мають
атоми
галогену
у сусідніх
атомів
карбону,
з
активними
металами:
![]() г)
Дегідрування
алканів
проводять
при 500 °С в присутності
каталізатору:
г)
Дегідрування
алканів
проводять
при 500 °С в присутності
каталізатору:
![]()
Хімічні властивості алкенів визначаються наявністю в їх молекулах подвійного зв”язку. Елект-ронна хмара -зв”язку зазнає атаки електрофільними агентами. Тому багато реакцій алкенів пли-нуть по механізму електрофільного приєднання, що позначається символом AE (від англ. addition electrophilic). Реакції електрофільного приєднання – це іонні процеси, які протікають в декілька стадій. Характерною особливістю електронної хмари -зв”язку є його рухливість. Під впливом замісників електронна щільність -зв”язку може зміщуватися до одного з атомів карбону. Тоді -зв”язок стає полярним а на атомах карбону, що зв”язані подвійним зв”язком, виникають часткові заряди. Підвищення полярності кінець-кінцем може призвести до гетеролітичного розриву -зв”язку.

1. Гідрогалогенування. При взаємодії алкенів з галогенгідрогенами (НСl, НВr) утворюються галогеналкани, причому якщо вихідний алкен несиметричний, реакція плине за правилом Марковникова.
Правило Марковнікова: при приєднанні полярних молекул типу НХ до несиметричних алкенів гідроген приєднується до більш гідрогенізованого атому карбону при подвійному зв”язку:
![]()
2. Гідратація. При взаємодії алкенів з водою в присутності мінеральних кислот (сірчаної, фосфор-ної) утворюються спирти. Мінеральні кислоти виконують роль каталізаторів і є джерелом протонів. Приєднання води відбувається за правилом Марковнікова:
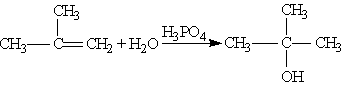 3.
Галогенування.
При додавання
до алкену брому (у вигляді бромної води)
буре забарвлення брому швидко зникає.
Ця
реакція є якісною на подвійний зв”язок:
3.
Галогенування.
При додавання
до алкену брому (у вигляді бромної води)
буре забарвлення брому швидко зникає.
Ця
реакція є якісною на подвійний зв”язок:
![]()
4. Окиснення. При окисненні алкенів перманганатом калію КMnO4 в нейтральному або слабоос-новному середовищі відбувається розрив -зв”язку і приєднання гідроксильної групи до кожного атому карбону, тобто реакція гідроксилювання. В результаті реакції забарвлений розчин КMnO4 швидко знебарвлюється і випадає коричневий осад оксиду марганцю (IV). Ця реакція також є якісною на подвійний зв”язок. При окисненні перманганатом калію в кислому середовищі або хро-мовою сумішшю відбувається повний розрив подвійного зв”язку із утворенням продуктів окиснен-ня. Ця реакція – окислювальне розщеплення подвійного зв”язку. Так, з молекули бутена-2 в резуль-таті окислювального розщеплення утворюється дві молекули оцтової кислоти:
![]()
5. Відновлення (гідрування). Ця реакція йде в присутності каталізатору – мілко подрібненого нікелю, платини або паладію – при кімнатній температурі:
![]()
При гідрогенізації олефіни перетворюються в насичені вуглеводні.
6. Реакції полімерізації. Особливим типом реакцій приєднання до алкенів є їх полімерізація, яка може каталізуватися як електрофілами, так і радикалами або сполуками перехідних металів. Реакція полімерізації – це послідовне приєднання молекул ненасичених сполук одна до одної з утворенням високомолекулярного продукту – полімера. Молекули алкена, які вступають в реакцію полімерізації – мономери. Число елементарних ланок, які повторюються в макромолекулі, назива-ється ступінню полімерізації (n). В залежності від ступеню полімерізації з одних і тих же моно-мерів можна отримувати речовини з різними властивостями. Так, поліетилен з короткими ланцю-гами (n = 20) є рідиною, що має мастильні властивості. Поліетилен з довжиною ланцюгу в 1500-2000 ланок представляє собою твердий, але гнучкий пластичний матеріал, із якого можна отриму-вати плівки, виготовляти пляшки і іншу посуду, еластичні труби та ін. Нарешті, поліетиен з довжи-ною ланцюгу 5-6 тис. ланок є твердою речовиною, із якої можна виготовляти литі вироби, жорсткі труби, міцні нитки.
Якщо в реакції полімерізації приймає участь невелика кількість молекул, то утворюються низь-комолекулярні речовини, наприклад дімери, тримери і т.ін. Умови перебігу реакцій полімерізації доволі різоманітні. В деяких випадках потрібні каталізатори і високий тиск. Але головним факто-ром є будова молекули мономеру. В реакцію полімерізації вступають ненасичені сполуки за раху-нок розриву кратних зв”язків.
 Полімерізація
– це ланцюгова реакція
і для того, щоб вона розпочалася, необхідно
активувати молекули мономеру за допомогою
так званих ініціаторів. Таким ініціаторами
реакції можуть бути вільні радикали
або іони (катіони, аніони). В
залежності від природи ініціатору
розрізняють радикальний, катіонний або
аніонний механізми полімерізації.
Найбільш розповсюджені полімери
вуглеводневої природи – поліетилен і
поліпропілен.
Полімерізація
– це ланцюгова реакція
і для того, щоб вона розпочалася, необхідно
активувати молекули мономеру за допомогою
так званих ініціаторів. Таким ініціаторами
реакції можуть бути вільні радикали
або іони (катіони, аніони). В
залежності від природи ініціатору
розрізняють радикальний, катіонний або
аніонний механізми полімерізації.
Найбільш розповсюджені полімери
вуглеводневої природи – поліетилен і
поліпропілен.
Поліетилен отримують полімерізацією етилену.
![]()
Поліпропілен отримують стереоспецифічною полімерізацією пропілену (пропену). Стереоспеци-фічна полімерізація – це процес отримання полімеру зі строго упорядкованою просторовою будо-вою. До полімерізації здатні багато інших сполук – похідні етилену, що мають загальну формулу СН2==СН—X, де Х — різні атоми або групи атомів.
Застосування. Етилен застосовується для отримання етилового спирту, поліетилену. Він приско-рює дозрівання плодів (томатів, цитрусових і др.) при введенні невеликої кількості його у повітря теплиць. Етилен і його гомологи використовуються як хімічна сировина для синтезу багатьох органічних речовин.
Дієнові вуглеводні (алкадієни). Алкадієнами називаються ненасичені вуглеводні, які містять два подвійних зв”язки. Загальна формула алкадієнів - СnН2n-2. Якщо подвійні зв”язки розділені в лан-цюгу двома або більшою кількістю -зв”язків (пентадієн-1,4), то такі подвійні зв”язки називаються ізольованими. Хімічні властивості алкадієнів з ізольованими подвійними зв”язками такі ж як і у алкенів з тою різницею, що в реакції можуть вступати не один, а два подвійних зв”язки незалежно один від одного. Якщо подвійні зв”язки в ланцюгу розділені тільки одним -зв”язком, то їх нази-вають спряженими. В такому разі в молекулі подвійні і одинарні зв”язки чередуються, як, напри-клад, в бутадієні-1,3 СН2==СН—СН==СН2, який є найпростішим спряженим алкадієном. Сполуки з таким розміщенням подвійних зв”язків відрізняються за властивостями як від алкенів, так і від інших типів алкадієнів. Особливості хімічної поведінки таких сполук пояснюються наявністю спряження. Спряження – це утворення єдиної електронної хмари в результаті взаємодії негібри-дизованих р-орбіталей в молекулі з подвійними і одинарними зв”язками, що чередуються. У спря-женій системі -електрони вже не належать конкретним зв”язкам, вони делокалізовані (розподілені по всій спряженій системі, по всім зв”язкам і атомам). Ланцюг спряження може включати велику кількість подвійних зв”язків. Чим він довше, тим більше делокалізація -електронів і тим більш стійка молекула.
Способи отримання. Важливе промислове значення має бутадиен-1,3, або дивинил, тому що він є сировиною для виробництва синтетичного каучуку. Бутадієн-1,3 отримують із бутанової фракції крекінг-процесу нафти. При температурі 600 оС відбувається ступіньчасте дегідрування бутану над каталізатором (Сr2О3, Al2О3) з утворенням бутадієну-1,3:
 Каталітичний
спосіб отримання бутадієну-1,3 з етанолу
був відкритий у 1932 р. С.В.Лебедєвим. За
цим способом бутадієн-1,3 отримується в
результаті одночасного дегідрування
і дегідратації
етанолу з каталізаторами на основі ZnO
і Аl2О3:
Каталітичний
спосіб отримання бутадієну-1,3 з етанолу
був відкритий у 1932 р. С.В.Лебедєвим. За
цим способом бутадієн-1,3 отримується в
результаті одночасного дегідрування
і дегідратації
етанолу з каталізаторами на основі ZnO
і Аl2О3:
![]()
Другий важливий представник алкдієнів - 2-метилбутадієн-1,3, або ізопрен,який є легкокиплячою рідиною. Ізопрен вперше був отриманий з натурального каучуку сухою перегонкою (нагріванням без доступу повітря). В нинішній час в промисловості ізопрен отримують головним чином із лег-ких фракцій вуглеводнів, що утворюються при крекінг-переробці нафти, наприклад при дегідру-ванні 2-метилбутану на оксидних каталізаторах:
![]()
Застосування деяких полімерів
Полівінілхлорид — продукт полімерізації хлористого вінілу (вінілхлорида) СН2=СНCl. Структурна формула:

Цей полімер має цінні властивості: він негорючий, стійкий до дії хімічних реагентів, легко забарв-люється. Із пластмас на його основі виготовляють клеєнки, плащі, портфелі, штучну шкіру для взуття і ін. Широко застосовується для ізоляції проводів і кабелів.
Тефлон — продукт полімерізації тетрафторетилену:
![]() Це
найінертніша органічна речовина (на
неї діють лише розплавлені калій і
натрій). Відрізняється високою морозо-
і теплостійкістю.
Полістирол
- тверда прозора пружна речовина.
Отримується полімерізацією стиролу.
Структурна формула:
Це
найінертніша органічна речовина (на
неї діють лише розплавлені калій і
натрій). Відрізняється високою морозо-
і теплостійкістю.
Полістирол
- тверда прозора пружна речовина.
Отримується полімерізацією стиролу.
Структурна формула:

Полістирол широко використовується в якості діелектрика в електро- і радіотехніці. Йде на виго-товлення кислототривких труб, тари, а також побутових виробів. Із нього готують легкі пористі пластмаси – пінопласти.
Алкіни. Алкінами називають ненасичені вуглеводні, молекули яких містять один потрійний зв”язок. Загальна формула алкінів СnН2n-2. Структурна ізомерія алкінів, як і алкенів, обумовлена будовою карбонового ланцюгу і положенням в ньому потрійного зв”язку. За фізичними власти-востями алкіни нагадують алкани і алкени. Нижчі алкіни C2—C4 є газами, С5—C16 — рідини, вищі алкіни – тверді речовини. Температури кипіння алкінів дещо вищі, ніж у відповідних алкенів.
Способи отримання.
1. Загальним способом отримання алканів є реакція дегідрогалогенуванняя – відщеплення двох молекул галогенгідрогену від дігалогензаміщених алканів, які містять два атоми галогену біля сусідніх атомів карбону (наприклад, 1,2-дібромпропан), або у одного атому карбону (2,2-дібром-пропан). Реакція відбувається під дією спиртового розчину гідроксиду калію:
 2.
Найважливіший з алкінів – ацетилен
отримують в промисловості шляхом
високотемпературного крекінгу метану:
2.
Найважливіший з алкінів – ацетилен
отримують в промисловості шляхом
високотемпературного крекінгу метану:
![]() В
лабораторії
ацетилен можна
отримати
гідролізом
карбіду
кальцію:
В
лабораторії
ацетилен можна
отримати
гідролізом
карбіду
кальцію:
![]()
Хімічні властивості. Потрійний зв”язок утворюється між двома атомами карбону в sp-гібридному стані. Два -зв”язки розташовані під кутом 180о, а два -зв”язки розміщені у взаємно перпенди-кулярних областях. Наявність -зв”язків обумовлює здатність алкінів вступати в реакції електро-фільного приєднання. Але ці реакції для алкінів плинуть повільніше ніж для алкенів. Це поясню-ється тим, що -електронна щільність потрійного зв”язку розташована більш комплексно, ніж в алкенах, і тому менш доступна для взаємодії з різними реагентами.
1. Галогенування. Галогени приєднуються до алкінів в дві стадії. Наприклад. Приєднання брому до ацетилену призводить до утворення діброметену, який, в свою чергу, реагує з надлишком брому з утворенням тетраброметану:
![]() 2.
Гідрогалогенування.
Галогенгідрогени
приєднуються до потрійного зв”язку
трудніше ніж до подвійного. Для активації
галогенгідрогену використовують
АlСl3
— сильну кислоту Льюіса. Із ацетилену
при цьому можна отримати вінілхлорид
(хлоретен), який використовується для
отримання важного полімеру –
полівінілхлориду:
2.
Гідрогалогенування.
Галогенгідрогени
приєднуються до потрійного зв”язку
трудніше ніж до подвійного. Для активації
галогенгідрогену використовують
АlСl3
— сильну кислоту Льюіса. Із ацетилену
при цьому можна отримати вінілхлорид
(хлоретен), який використовується для
отримання важного полімеру –
полівінілхлориду:
![]() 3.
Гідратація.
Приєднання
води до алкінів каталізується солями
ртуті (П) (реакція
Кучерова)
3.
Гідратація.
Приєднання
води до алкінів каталізується солями
ртуті (П) (реакція
Кучерова)
![]()
На першій стадії реакції утворюється ненасичений спирт, в якому гідроксогрупа розташована безпосередньо у атому карбону при подвійному зв”язку. Такі спирти прийнято називати вініловими або єнолами. Відмінною рисою більшості єнолів є їх нестійкість. В момент утворення вони ізомерізуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок переносу протону від гідроксильної групи до сусіднього атому карбону при подвійному зв”язку. При цьому -зв”язок між атомами карбону розривається і утворюється -зв”язок між атомом карбону і атомом кисню. Причиною ізомерізації є більш міцний подвійний зв”язок С == О у порівнянні з подвійним зв”язком С == С. В результаті реакції гідратації тільки ацетілен перетворюється в альдегід, гідратація гомологів ацетілену відбувається за правилом Марковнікова і єноли, що утворюються, ізомерізуються в кетони. Так, пропин перетворюється в ацетон:
![]()
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий потрійний зв”язок, є їх здат-ність відщеплювати протон під дією сильних основ, тобто виявляти слабкі кислотні властивості. Можливість відщеплення протону обумовлена сильною полярізацією -зв”язку С Н. Причиною поляризації є висока електронегативність атому карбону в sp-гібридному стані. Тому алкіни, на відміну від алкенів і алканів, здатні утворювати солі, які називають ацетиленідами.
![]() Ацетиленіди
срібла і міді (І) легко утворюються і
випадають в осад при пропусканні
ацетилену через аміачний розчин оксиду
срібла або хлориду міді (І). Ця реакція
служить для виявлення алкинів з потрійним
зв”язком на кінці ланцюгу:
Ацетиленіди
срібла і міді (І) легко утворюються і
випадають в осад при пропусканні
ацетилену через аміачний розчин оксиду
срібла або хлориду міді (І). Ця реакція
служить для виявлення алкинів з потрійним
зв”язком на кінці ланцюгу:
![]()
Ацетиленіди срібла і міді як солі дуже слабких кислот легко розкладаються при дії хлорогід-рогенної кислоти з виділенням вихідного алкіну:
![]() Таким
чином, використовуючи реакції утворення
і розкладання ацетиленідів, можна
виділити алкіни із сумішей з іншими
вуглеводнями.
Таким
чином, використовуючи реакції утворення
і розкладання ацетиленідів, можна
виділити алкіни із сумішей з іншими
вуглеводнями.
5. Полімерізація. В присутності каталізаторів алкіни можуть реагувати один з одним, причому в залежності від умов утворюються різні продукти. Так під дією водного розчину CuCl2 і NH4Cl ацетілен димерізується, що дає вінілацетилен:
![]() Він
має високу реакційну здатність; приєднуючи
хлоргідроген, він утворює хлоропрен,
який використовують для отримання
штучного каучуку:
Він
має високу реакційну здатність; приєднуючи
хлоргідроген, він утворює хлоропрен,
який використовують для отримання
штучного каучуку:
![]() При
пропусканні ацетилену над активованим
вугіллям при 600 оС
відбувається тримерізація ацетилену
з утворенням бензолу:
При
пропусканні ацетилену над активованим
вугіллям при 600 оС
відбувається тримерізація ацетилену
з утворенням бензолу:
![]() 6.
Реакції
окиснення і
відновлення.
Алкіни
окиснюються різними окисниками, в т.ч.
перманганатом калію. При цьому розчин
перманганату калію обезбарвлюється,
що служить вказівкою на наявність
потрійного зв”язку. При окисненні
зазвичай відбувається розщеплння
потрійного зв”язку і утворю-ються
карбонові кислоти:
6.
Реакції
окиснення і
відновлення.
Алкіни
окиснюються різними окисниками, в т.ч.
перманганатом калію. При цьому розчин
перманганату калію обезбарвлюється,
що служить вказівкою на наявність
потрійного зв”язку. При окисненні
зазвичай відбувається розщеплння
потрійного зв”язку і утворю-ються
карбонові кислоти:
![]() В
присутності металевих каталізаторів
алкіни відновлюються шляхом послідовного
приєднання молекул гідрогену,
перетворюючись спочатку в алкени, а
потім в алкани:
В
присутності металевих каталізаторів
алкіни відновлюються шляхом послідовного
приєднання молекул гідрогену,
перетворюючись спочатку в алкени, а
потім в алкани:
![]()
Застосування. Ацетилен використовується в якості вихідної сировини для багатьох промислових хімічних синтезів. З нього отримують оцтову кислоту, штучний каучук, полівінілхлоридні смоли. Тетрахлоретан СНСl2—CHCl2 — продукт приєднання хлору до етилену — служить добрим розчинником жирів і багатьох органічних речовин і, що дуже важливо, є безпечним в пожарному відношенні. Ацетилен використовують для автогенного зварювання металів.
5. Ароматичні вуглеводні (арени)
Ароматичними вуглеводнями (аренами) називаються речовини, в молекулах яких міститься одне або декілька бензольних кілець – циклічних груп атомів карбону з особливим характером зв”язків. Поняття „бензольне кільце” потребує розшифровки. Перша структура бензолу була запропонована у 1865 р. німецьким вченим А.Кекуле:

Ця формула правильно відображає рівнозначність шести атомів карбону, але не пояснює ряд особливих властивостей бензолу. Наприклад, не дивлячись на ненасиченість, бензол не виявляє схильності до реакцій приєднання: він не знебарвлює бромну воду і розчин перманганату калію, тобто не дає типових для ненасичених сполук якісних реакцій. Особливості будови і властивостей бензолу вдалося повністю пояснити тільки завдяки розвитку сучасної квантово - механічної теорії хімічних зв”язків. Згідно з сучасними уявленнями, всі шість атомів карбону в молекулі бензолу знаходяться в sp2-гібридному стані. Кожний атом карбону утворює -зв”язки з двома іншими атомами карбону і одним атомом гідрогену, які лежать в одній площині. Валентні кути між трьома -зв”язками дорівнюють 120о. Таким чином, всі шість атомів карбону лежать в одній площині, утворюючи правильний шестикутник ( -скелет молекули бензолу). Кожний атом карбону має одну негібридизовану р-орбіталь. Шість таких орбіталей розміщуються перпендикулярно плоскому -скелету і паралельно одна одній (див. рис.а). Всі шість електронів взаємодіють між собою, утворюючи -зв”язки, не локалізовані в пари як при утворенні подвійних зв”язків, а об”єднані в єдину -електронну хмару. Таким чином, в молекулі бензолу відбувається кругове спряження. Найбільша -електронна щільність в цій спряженій системі розташовується над і під площиною -скелету (див. рис.б).

В результаті всі зв”язки між атомами карбону в бензолі мають довжину 0,139 нм. Ця величина є проміжною між довжиною одинарного зв”язку в алканах (0,154 нм) і подвійного зв”язку в алкенах (0,133 нм). Рівнозначність зв”язків прийнято зображати кружком всередині циклу (див. рис. в). Кругове спряження дає виграш в енергії 150 кДж/моль. Ця величина складає енергію спряження – кількість енергії, яку потрібно витратити, щоб порушити ароматичну систему бензолу. Така електронна будова пояснює всі особливості бензолу. Так, зрозуміло чому бензол важко вступає в реакції приєднання, - це привело б порушення спряження. Такі реакції можливі лише в дуже жорстких умовах.
Умовно арени можна розділити на два ряди. До першого відносять похідні бензолу (наприклад, толуол чи діфеніл), до другого – конденсовані (поліядерні) арени (простіший з них – нафталін):

Гомологічний ряд бензолу відповідає загальній формулі С6Н2n-6. Структурна ізомерія в гомологічному ряду бензолу обумовлена взаємним розташуванням замісників в ядрі. Моно-заміщені похідні бензолу не мають ізомерів положення, бо всі атоми в бензольному ядрі рівнозначні. Дізаміщені похідні існують у вигляді трьох ізомерів,

які відрізняються взаємним розташуванням замісників. Положення замісників вказують цифрами або приставками: орто- (о-), мета- (м-), пара- (п-). Радикали ароматичних вуглеводнів називають арильними радикалами. Радикал С6Н5 — називається феніл.
Фізичні властивості. Перші члени гомологічного ряду бензолу (наприклад, толуол, етилбензол і др.) – безбарвні рідини із специфічним запахом. Вони легше води і нерозчинні в ній. Добре розчиняються в органічних розчинниках. Бензол та його гомологи самі є добрими розчинниками для багатьох органічних речовин. Всі арени горять кіптявим полум”ям завдяки високому вмісту карбону в їх молекулах.
Способи отримання.
1. Отримання із аліфатичних вуглеводнів. При пропусканні алканів з нерозгалуженим ланцюгом, що має не менше шости атомів карбону в молекулі, над нагрітою платиною або оксидом хрому відбувається дегідроциклізація – утворення арену з виділенням гідрогену:
![]()
2. Дегідрування циклоалканів. Реакція відбувається при пропускання пари циклогексану і його гомологів над нагрітою платиною:

3. Отримання бензолу тримерізацією ацетилену.
4. Отримання гомологів бензолу за реакцією Фріделя—Крафтса.
5. Сплавлення солей ароматичних кислот з лугами:
![]()
Хімічні властивості. Маючи рухому шістку -електронів, ароматичне ядро є зручним об”єктом для атаки електрофільними реагентами. Цьому сприяє також просторове розташування -електронної хмари з двох сторін плаского -скелету молекули (див. рис. б). Для аренів найбільш характерні реакції, що протікають по механізму електрофільного заміщення, який позначається символом SE (від англ. substitution electrophilic).

Механізм електрофільного заміщення можна представити таким чином. Електрофільний реагент XY (Х є електрофілом) атакує електронну хмару і за рахунок слабкої електростатичної взаємодії утворюється нестійкий -комплекс. Ароматична система при цьому ще не порушується. Ця стадія перебігає швидко. На другій, більш повільній стадії, формується ковалентний зв”язок між електро-філом Х і одним із атомів карбону кільця за рахунок двох -електронів кільця. Цей атом карбону переходить із sр2- в sр3-гібридний стан. Ароматичність системи при цьому порушується. Чотири -електрона, що залишились, розподіляються між п”ятьма іншими атомами карбону, і молекула бензолу утворює карбокатіон, або -комплекс. Порушення ароматичності енергетично невигідне, тому структура -комплексу менш стійка, ніж ароматична структура. Для відновлння ароматич-ності відбувається відщеплення протону від атому карбону, що зв”язаний з електрофілом (третя стадія). При цьому два електрони повертаються в -систему і цим відновлюється ароматичність:

Реакції електрофільного заміщення широко використовуються для синтезу багатьох похідних бензолу.
Хімічні властивості бензолу.
1. Галогенування. Бензол не взаємодіє з хлором або бромом в звичайних умовах. Реакція може відбуватися лише в присутності каталізаторів – безводних АlСl3, FeСl3, АlВr3. В результаті реакції утворюються галогензаміщені арени:
![]()
Роль каталізатору
складається в поляризації нейтральної
молекули галогену з утворенням з неї
елктрофільної частинки:
![]()
2. Нітрування. Бензол дуже повільно реагує з концентрованою азотною кислотою навіть при сильному нагріванні. Однак, при дії так званої нітруючої суміші (суміш концентрованих азотної і сірчаної кислот) реакція нітрування проходить лосить легко:
![]()
3. Сулъфування. Реакція легко проходить під дією “димлячої” сірчаної кислоти (олеума):
![]()
4. Алкілування по Фріделю—Крафтсу. В результаті реакції відбувається уведення в бензольне ядро алкільної групи з отриманням гомологів бензолу. Реакція протікає при дії на бензол галогеналканів RСl в присутності каталізаторів – галогенідів алюмінію. Роль каталізатору зводиться до поляризації молекули RСl з утворенням електрофільної частинки:
![]()
В залежності від будови радикалу в галогеналкані можна отримати різні гомологи бензолу:
![]()
5. Алкілування алкенами. Ці реакції широко використовуються в промисловості для отримання етилбензолу і ізопропілбензолу (кумолу). Алкілування проводять в присутності каталізатору АlСl3. Механізм реакції схожий з механізмом попередньої реакції:
![]()
Всі розглянуті вище реакції протікають за механізмом електрофільного заміщення SE. Реакції приєднання до аренів приводять до зруйнування ароматичної системи і потребують великих енергетичних витрат, тому відбуваються тільки в жорстких умовах.
6. Гідрування. Реакція приєднання гідрогену до аренів йде при нагріванні і високому тиску в при-сутності металевих каталізаторів (Ni, Pt, Pd). Бензол перетворюється в циклогексан, а гомологи бензолу – в похідні циклогексану:
![]()
7. Радикальне галогенування. Взаємодія пари бензолу з хлором відбувається за радикальним механізмом тільки під дією жорсткого ультрафіолетового випромінення. При цьому бензол приєднує три молекули хлору і утворює твердий продукт – гексахлорциклогексан (гексахлоран) С6Н6Сl6:

8. Окиснення повітряним киснем. По стійкості до дії окисників бензол нагадує алкани. Тільки при сильному нагріванні (400 °С) пари бензолу з киснем повітря в присутності каталізатору V2О5 отримується суміш малеїнової кислоти та її ангідриду:

Хімічні властивості гомологів бензолу. Гомологи бензолу мають цілий ряд особливих хімічних властивостей, зв”язаних із взаємним впливом алкільного радикалу на бензольне кільце, і навпаки.
Реакції в боковому ланцюгу. За хімічними властивостями алкільні радикали подібні алканам. Атоми гідрогену в них заміщуються на галоген згідно з вільно-радикальним механізмом. Тому у відсутності каталізатору при нагріванні або УФ-випромінюванні йде радикальна реакція заміщення в боковому ланцюгу. Вплив бензольного кільця на алкільні замісники призводить до того, що заміщується завжди атом гідрогену біля атому карбону, що безпосередньо зв”язаний з бензольним кільцем ( -атому карбону).
![]()
Заміщення в бензольному кільці можливе тільки по механізму SE в присутності каталізатору АlСl3:
![]()
При дії на гомологи бензолу перманганату калію і інших сильних окисників бокові ланцюги окиснюються. Яким би складним не був ланцюг замісника, він порушується, за винятком -атому карбону, який окиснюється у карбоксильну групу. Гомологи бензолу з одним боковим ланцюгом дають бензойну кислоту:

Гомологи, що містять два бокових ланцюги, дають двохосновні кислоти:

Правила орієнтації (заміщення) в бензольному кільці.
Важливим фактором, що визначає хімічні властивості молекули, є розподіл в ній електронної щільності. Характер розподілу залежить від взаємного впливу атомів. В молекулах, що мають тільки -зв”язки, взаємний вплив атомів здійснюється через індуктивний ефект. В молекулах, які є спряженими системами, виявляється дія мезомерного ефекту (вплив замісників, що передається по спряженій системі -зв”язків).
В молекулі бензолу -електронна хмара рівномірно розподіляється по всіх атомах карбону завдяки спряженню. Якщо ж в бензольне кільце ввести який-небудь замісник, цей рівномірний розподіл порушується і відбувається перерозподіл електронної щільності в кільці. Місце входу другого замісника в бензольне кільце визначається природою замісника, що вже існує. Замісники підрозділяються на дві групи в залежності від ефекту, який вони проявля-ють (мезомерного чи індуктивного): електронодорні і електроноакцепторні.
Електронодорні замісники проявляють +М- і +I – ефект і підвищують електронну щільність в спряженій системі. До них відносяться гідроксильна група —ОН і аміногруп-па —NН2. Неподіле-на пара електронів в цих групах вступає в загальне спряження з -електронною системою бензоль-ного кільця і підвищує довжину спряженої системи. В результаті електронна щільність зосеред-жується в орто- і пара-положеннях:
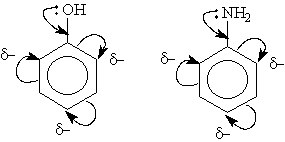
Алкільні групи
не можуть приймати участь в загальному
спряжінні, тому вони проявляють +I-ефект,
під дією якого відбувається аналогічний
перерозподіл
-електронної
щільності. Електроноакцепторні
замісники проявляють -М-ефект
і знижують електронну щільність в
спряженій системі.
До них відносяться нітрогрупа
—NO2,
сульфогрупа —SO3Н,
альдегідна
—СНО і
карбоксильна —СООН групи.
Ці замісники утворюють з бензольним
кільцем загальну спряжену систему, але
загальна електронна хмара зміщується
у бік цих груп. Таким чином, загальна
електронна
щільність в кільці зменшується, причому
менш за все вона зменшується в
мета-положеннях.

Повністю галогенізовані алкільні радикали (наприклад, —ССl3) проявляють -I-ефект і також сприяють зниженню електронної щільності кільця. Закономірності переважного напрямку заміщення в безольному кільці називають правилами орієнтації. Замісники, що володіють +I-ефектом або +М-ефектом, сприяють електрофільному заміщенню в орто- і пара-положеннях бензольного кільця і називаються замісниками (орієнтантами) першого роду:
![]()
Замісники, що володіють -I-ефектом або -М-ефектом, направляють електрофільне заміщення в мета-положення бензольного кільця і називаються замісниками (орієнтантами) другого роду:
![]()
Так, толуол, що містить замісник першого роду, нітрується і бромується в пара- і орто-положення:

Нітробензол, який містить замісник другого роду, нітрується і бромується в мета-положення:

Окрім орієнтуючої дії замісники впливають і на реакційну здатність бензольного кільця: орієнтанти 1-го роду (крім галогенів) полегшують вступ другого замісника; орієнтанти 2-го роду (і галогени)затрудняють його.
Застосування. Бензол і його гомологи застосовуються як хімічна сировина для виробництва ліків, пластмас, барвників, отрутохімікатів і багатьох інших органічних речовин. Широко використовуються як розчинники. Бензол в якості добавки поліпшує якість моторного палива.
