
- •Херсонский национальный технический университет Кафедра экологии и бжд
- •1. Цель работы
- •2. Экспериментальная часть
- •2.1. Методика проведения работы
- •3. Обработка результатов исследований
- •3.1. Определение константы скорости реакции
- •3.2. Определение энергии активации
- •3.3. Определение порядка реакции
- •3.4. Определение температурного коэффициента реакции
- •3.5. Определение зависимости константы скорости от температуры
- •4. Выводы
- •5. Инструкция по технике безопасности
- •6. Вопросы для самопроверки
- •7. Материальное обеспечение
- •Список литературы
3. Обработка результатов исследований
3.1. Определение константы скорости реакции
Константа скорости гомогенной реакции в твердой фазе может быть определена с достаточной точностью по эмпирическому уравнению Яндера:
![]() (1)
(1)
где
![]() -
степень превращения исходного сырья в
готовый продукт %;
-
степень превращения исходного сырья в
готовый продукт %;
![]() -
константа скорости реакции;
-
константа скорости реакции;
![]() - время реакции, мин.
- время реакции, мин.
Для
реакции
![]() степень превращения определятся по
молекулярным массам реагирующих веществ
и продуктов реакции:
степень превращения определятся по
молекулярным массам реагирующих веществ
и продуктов реакции:
![]()
![]()
![]()
![]()
Расчет
ведётся по одному из компонентов, а
именно по
![]() .
.
Для
реакции в печь загружается G
г. смеси
![]() .
Чтобы полностью прореагировало более
дефицитное сырье
.
Чтобы полностью прореагировало более
дефицитное сырье
![]() ,
в смесь вводится избыток
,
в смесь вводится избыток
![]() в соотношении
в соотношении
![]() :
:
![]() = 3:1. Следовательно, в смеси будет оксида
молибдена
= 3:1. Следовательно, в смеси будет оксида
молибдена
![]() г.
Таким образом, из 144 г.
г.
Таким образом, из 144 г.
![]() должно выделиться 44г.
должно выделиться 44г.
![]() ,
а из навески
,
а из навески
![]() г.
г.
![]()
Х
г.
![]() ,
откуда
,
откуда
![]()
Фактически
за время опыта по результатам взвешивания
выделилось
![]() г.
г.
![]() .
Тогда степень превращения составит:
.
Тогда степень превращения составит:
![]() ,
,
где G – масса реакционной смеси, г;
![]() -
изменение массы реагирующих веществ
за полное время реакции, г;
-
изменение массы реагирующих веществ
за полное время реакции, г;
х
– количество
![]() ,
которое должно выделиться теоретически
из навески, г.
,
которое должно выделиться теоретически
из навески, г.
Подставив полученные результаты в уравнение (1), определим константу скорости реакции
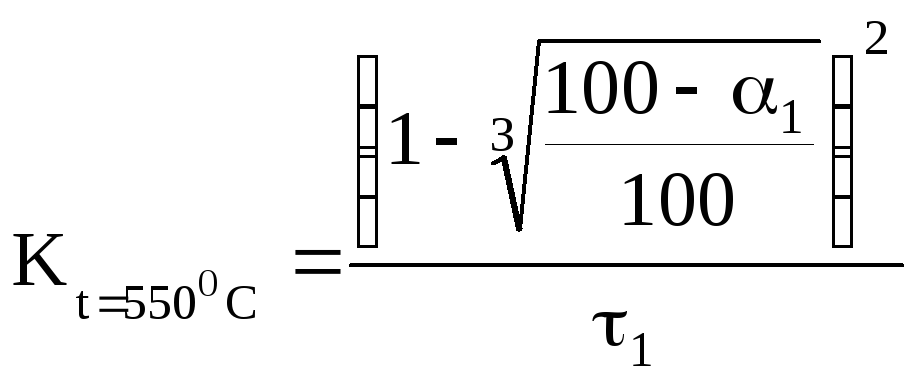 (2)
(2)
Аналогичные
расчеты проводим при температуре 600![]() С
и определяем константу скорости реакции
при 600
С
и определяем константу скорости реакции
при 600![]() С:
С:
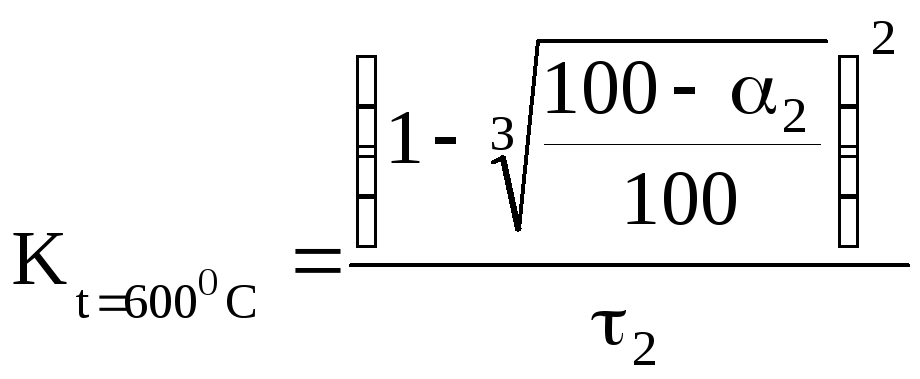 (3)
(3)
3.2. Определение энергии активации
Энергия активации реакции взаимодействия карбоната кальция и оксида молибдена определяется по уравнению Аррениуса:
![]() (4)
(4)
Прологарифмировав
уравнение Аррениуса при различных
температурах (550 и 600![]() С),
получим:
С),
получим:
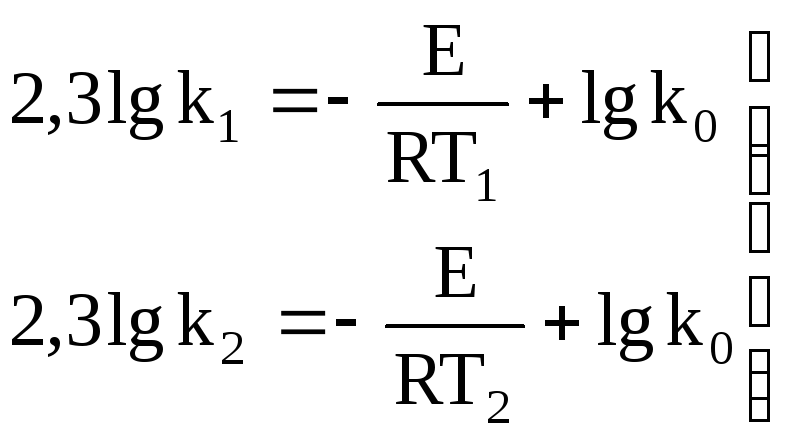 (5)
(5)
Решая совместно систему двух уравнений относительно Е, получаем:
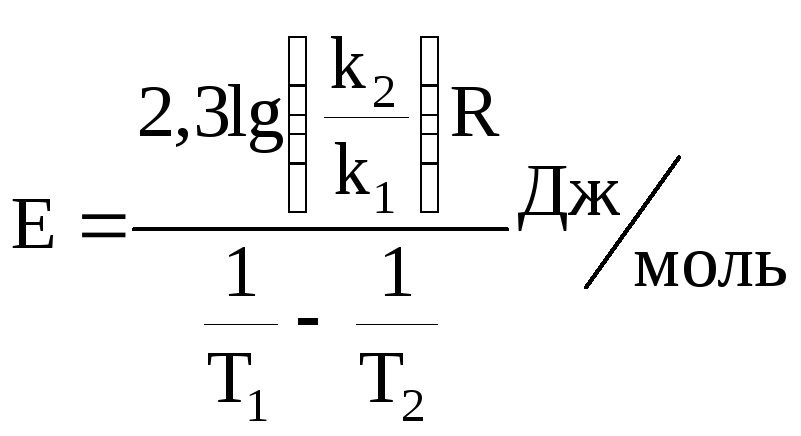 ,
(6)
,
(6)
где
![]() и
и
![]() - константы скорости реакции при 550 и
600
- константы скорости реакции при 550 и
600![]() С;
С;
![]() и
и
![]() - температура, град К; R
– газовая постоянная
- температура, град К; R
– газовая постоянная
![]()
Энергию
активации E
можно
определить и графическим способом,
построив график в координатах
![]()
Нанеся
на график (рис. 3) значения
![]() при
температурах 550 и 600
при
температурах 550 и 600![]() С
и соединив эти точки, получим прямую,
характеризующую зависимость
С
и соединив эти точки, получим прямую,
характеризующую зависимость
![]() от
от
![]() .
.
Тангенс угла наклона прямой характеризует энергию активации реакции.
![]() (7)
(7)
откуда
![]() , (8)
, (8)
где
![]() (9)
(9)
Подставив
значения R
и
![]() ,
определим Е
и сравним с энергией активации, полученной
аналитическим путем.
,
определим Е
и сравним с энергией активации, полученной
аналитическим путем.
3.3. Определение порядка реакции
Одним из методов определения порядка реакции может быть метод интегрирования, суть которого состоит в интегрировании дифференциального уравнения скорости реакции.
Если
при решении дифференциального уравнения
значения константы скорости реакции К
остаются постоянными при различном
времени реакции
![]() ,
то данное дифференциальное уравнение
принимается за расчетное.
,
то данное дифференциальное уравнение
принимается за расчетное.
Запишем выражение дифференциальных уравнений и констант скорости реакции различного порядка (табл. 2).
Таблица 2
Выражение констант скорости реакции различного порядка
|
Порядок реакции |
Дифференциальное уравнение |
Значение константы скорости реакции |
Размерность констант скорости |
|
0 |
|
|
|
|
I |
|
|
|
|
II |
|
|
|
|
III |
|
|
|
Определим
константы скорости реакции по уравнениям
различного порядка
![]() ,
у которых
,
у которых
![]() - начальная масса навески, мг; А
– масса навески по времени
- начальная масса навески, мг; А
– масса навески по времени
![]() ,
мг;
,
мг;
![]() - время реакции, мин. Результаты расчетов
сводим в табл. 3.
- время реакции, мин. Результаты расчетов
сводим в табл. 3.
Таблица 3
Значения константы скорости реакции,
рассчитанные по уравнениям разного порядка
|
Время, Мин |
Значение константы скорости реакции К |
|||
|
0 порядок |
I порядок |
II порядок |
III порядок |
|
|
1 |
2 |
3 |
4 |
5 |
|
5 |
|
|
|
|
|
10 |
|
|
|
|
|
15 |
|
|
|
|
|
20 |
|
|
|
|
За истинный принимается тот порядок, при котором значения константы скорости реакции при различном времени совпадают наиболее близко.
