
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
Номенклатуре

§ 1.2.3.2. Радикально-функциональная номенклатура
Радикально-функциональная номенклатура используется реже, чем заместительная. В основном она применяется для некоторых классов органических соединений — спиртов, кетонов, простых эфиров и др.
Для соединений с одной характеристической группой название составляют из названий углеводородных радикалов, а наличие характеристической группы в отличие от заместительной номенклатуры отражают не суффиксом, а названием соответствующего класса соединений (табл. 5).
О
II
С2Н5ОН СН2=СН—О— СН, СН3—С—С6Н5 СН3— S— СН3 С2Н5С1
этиловый винилметиловый метилфенил- диметил- этилхлорид
спирт эфир кетон сульфид
Для соединений с разными характеристическими группами в качестве названия класса используют название более старшего класса, а все остальные группы обозначают префиксами. Например, соединение СlСН2—О—СН2С1 будет иметь название 1,1'-дихлородиметиловый эфир, или α, α'-дихлородиметиловый эфир. В радикально-функциональной номенклатуре наряду с цифрами сохранилось обозначение положения заместителей греческими буквами: α, β, γ и т. д.
Таблица 5.
Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
|
Характеристическая группа |
Название Класса |
Характеристическая группа |
Название Класса |
|
—CN |
Цианид |
—О—ОН |
Гидропероксид |
|
>С=О |
Кетон |
—О— |
Эфир или оксид |
|
—ОН |
Спирт |
—S—, >S=О |
Сульфид, сульфоксид |
|
—SН |
Гидросульфид |
—F, —Cl, —Br, —I |
Фторид, хлорид, бромид, иодид |
В симметрично построенных соединениях перед названием соответствующего радикала ставят префикс ди-.
СН2=СН—СН=СН2
дивинил
Изложенные в настоящей главе правила должны служить постоянным руководством в ходе последующего изучения номенклатуры конкретных классов органических соединений и их отдельных представителей.
§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
(Материал для самоподготовки)
Многообразие органических соединений обусловлено в значительной мере явлением изомерии.
Изомерами называются соединения с одинаковым качественными количественным составом, но отличающиеся последовательностью связывания атомов или расположением их в пространстве.
Даже минимальные структурные различия между изомерами биомолекул приводят к заметным различиям в их физических и химических свойствах и очень сильно влияют на их биологическую активность. Возможны следующие типы изомерии: структурная и пространственная (стереоизомерия).
Структурная изомерия. Этот тип изомерии обусловлен различным взаимным расположением атомов в молекулах.
При этом различают изомерию углеродного скелета и изомерию положения.
Изомерия углеродного скелета обусловлена способностью атомов углерода образовывать как прямые (нормальные) углеродные цепи, так и разветвленные цепи с различной степенью разветвления. Например, у пентана имеются три изомера:
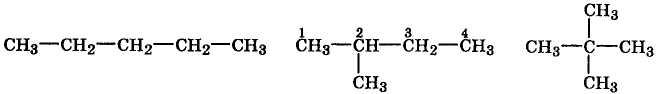
н-пентан 2-метилбутан 2,2-диметилпропан
Изомерия положения обусловлена различным положением заместителей, функциональных групп или кратных связей в молекулах органических соединений одинакового состава. Например:
![]()
![]()
8-хлорпентан
![]()
пентен-1 пентен-2
— взаимное расположение заместителей в соединениях ароматического ряда:
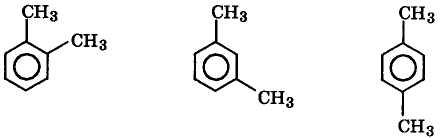
1,2-диметилбензол 1,8-диметилбензол 1,4-диметилбензол
(opтo-ксилол) (мета-ксилол) (пара-ксилол)
Для рассмотренных видов структурной изомерии взаимное превращение изомеров друг в друга при обычных условиях отсутствует.
Классовая изомерия также является примером структурной изомерии и определяется различной очередностью расположения атомов в молекулах веществ, относящихся к различным классам. Примером изомерии данного вида могут молекулы этилового спирта и диметилового эфира: молекулярная формула которых – C2H6O, а структурные формулы веществ соответственно можно представить следующим образом: CH3-CH2-OH и CH3-O-CH3
Особым случаем структурной изомерии является таутомерия.
Таутомерия — явление равновесной динамической изомерии, при которой происходит быстрое обратимое самопроизвольное превращение структурных изомеров, сопровождаемое миграцией подвижной группы между двумя или несколькими центрами в молекуле.
Таутомерия свойственна соединениям, в молекулах которых имеются разные реакционноспособные группировки. Например, в молекулах природных аминокислот имеются две группы с противоположными свойствами: аминогруппа - основные свойства - и карбоксильная группа — кислотные свойства. Между этими группами осуществляется перенос протона, и поэтому такой вид изомерии называется прототропной таутомерией. Для обозначения таутомерного равновесия в учебнике использованы пунктирные стрелки.
H2N—CHR—СООН
<=> H3![]() —CHR—СОО-
—CHR—СОО-
Для всех природных аминокислот в кристаллическом состоянии и в водных растворах наиболее устойчив таутомер, имеющий структуру биполярного иона. Его содержание превышает 99,9%. Поэтому во многих учебных пособиях все природные α-аминокислоты всегда изображены в виде таутомера с биполярно-ионной структурой.
Прототропная таутомерия бывает разных видов: кето-енольная, лактим-лактамная и др. Кроме прототропной таутомерии в природных соединениях наблюдается кольчато-цепная таутомерия, которая особенно характерна для углеводов. Данные виды изомерии будут более подробно рассмотрены в соответствующих главах.
