31.Волновая функция
Волновая функция в квантовой механике, величина, полностью описывающая состояние микрообъекта (например, электрона, протона, атома, молекулы) и вообще любой квантовой системы (например, кристалла).
Описание состояния микрообъекта с помощью В. ф. имеет статистический, т. е. вероятностный характер: квадрат абсолютного значения (модуля) В. ф. указывает значение вероятностей тех величин, от которых зависит В. ф. Например, если задана зависимость В. ф. частицы от координат х, у,z и времени t, то квадрат модуля этой В. ф. определяет вероятность обнаружить частицу в момент t в точке с координатами х, у, z. Поскольку вероятность состояния определяется квадратом В. ф., её называют также амплитудой вероятности.
В. ф. одновременно отражает и наличие волновых свойств у микрообъектов. Так, для свободной частицы с заданным импульсом р и энергией E,которой сопоставляется волна де Бройля с частотой v = E/h и длиной волны λ = h/p (где h — постоянная Планка), В. ф. должна быть периодична в пространстве и времени с соответствующей величиной λ и периодом Т = 1/v.
Для В. ф. справедлив суперпозиций принцип: если система может находиться в различных состояниях с В. ф. ψ1, ψ2.., то возможно и состояние с В. ф., равной сумме (и вообще любой линейной комбинации) этих В. ф. Сложение В. ф. (амплитуд вероятностей), а не вероятностей (квадратов В. ф.) принципиально отличает квантовую теорию от любой классической статистической теории (в которой справедлива теорема сложения вероятностей).
33.
Уравнение Шредингера для атома водорода.
Так как потенциальная функция электрона
в атоме водорода имеет вид ![]() ,
где e —
заряд электрона (и протона), r —
радиус вектор, уравнение
Шредингера запишется следующим
образом:
,
где e —
заряд электрона (и протона), r —
радиус вектор, уравнение
Шредингера запишется следующим
образом:
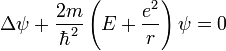
Здесь ψ — волновая
функция электрона в системе отсчёта
протона, m —
масса электрона, где ![]() ,
, ![]() — постоянная
Планка, E —
полная энергия электрона,
— постоянная
Планка, E —
полная энергия электрона, ![]() — оператор
Лапласа. Так как потенциальная функция
зависит от r,
а не от координат по отдельности, удобно
будет записать лапласиан в сферической
системе координат (r,θ,ϕ).
В ней он выглядит следующим образом:
— оператор
Лапласа. Так как потенциальная функция
зависит от r,
а не от координат по отдельности, удобно
будет записать лапласиан в сферической
системе координат (r,θ,ϕ).
В ней он выглядит следующим образом:
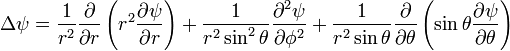
34. Квантовые числа и их физический смысл
Как следует из решения уравнения Шредингера для атома водорода, квантовое состояние электрона в этом атоме (можно сказать и квантовое состояние атома) полностью определяется заданием трех квантовых чисел. "Задайте значения квантовых чисел, и я полностью опишу свойства атома" - так может современный физик перефразировать известное изречение Архимеда.
Каждое из квантовых чисел принимает только целочисленные значения и определяет, то есть предсказывает результаты измерения основных физических величин в заданном квантовом состоянии атома.
1. Главное
квантовое число ![]() . Это
квантовое число принимает значения
. Это
квантовое число принимает значения
![]()
и определяет полную энергию электрона в любом квантовом состоянии
|
|
(5.37) |
Можно
отметить, что эти значения энергии
являются собственными значениями
гамильтониана (5.17a).
Поэтому в связанном состоянии электрон
в атоме водорода имеет дискретный
энергетический спектр, лежащий в области
отрицательных значений и имеющий точку
сгущения ![]() .
.
2. Орбитальное
(азимутальное) квантовое число ![]() . В
квантовых состояниях с заданным значением
главного квантового числа
. В
квантовых состояниях с заданным значением
главного квантового числа ![]() азимутальное
квантовое число может иметь следующие
значения:
азимутальное
квантовое число может иметь следующие
значения:
![]() .
.
Из
выводов предыдущего параграфа следует,
что стационарные волновые функции ![]() ,
описывающие различные квантовые
состояния атома, являются собственными
функциями не только оператора полной
энергии
,
описывающие различные квантовые
состояния атома, являются собственными
функциями не только оператора полной
энергии ![]() ,
но и оператора квадрата момента
импульса
,
но и оператора квадрата момента
импульса ![]() ,
причем
,
причем
![]() .
.
Следовательно, в любом квантовом состоянии атом обладает определенным значением квадрата момента импульса, причем модуль орбитального момента импульса движущегося в атоме электрона однозначно определяется орбитальным квантовым числом:
|
|
(5.38) |
Проанализируем
эту формулу
квантования момента импульса.
Сравнивая ее с условием (5.3) квантования
момента импульса движущегося электрона
в теории Бора, можно заметить, что эти
условия не совпадают. И дело не только
в отличии числовых значений, рассчитанных
по этим формулам. Принципиальное отличие
этих соотношений состоит в том, что в
квантовой механике возможны состояния
атома с нулевым моментом импульса. Во
всех ![]() -состояниях
и, частности, в основном
-состояниях
и, частности, в основном ![]() -состоянии,
когда
-состоянии,
когда ![]() ,
по формуле (5.38) получаем
,
по формуле (5.38) получаем ![]() .
.
При классическом описании движения электрона в атоме по определенной траектории (орбите) в любом состоянии атом должен обладать ненулевым моментом импульса.
Опыт подтверждает существование квантовых состояний атома с нулевыми орбитальными моментами. Следовательно, опыт подтверждает, что только отказ от классического траекторного способа описания движения электрона в атоме позволяет правильно рассчитать и предсказать свойства атома. Вероятностный способ описания движения частиц в квантовой механике является единственно правильным способом описания свойств атомных систем - таков вывод современной физики.
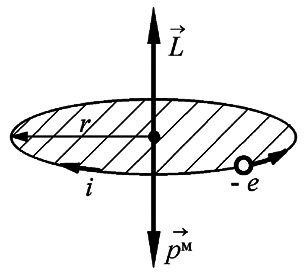
Так
как движущийся вокруг ядра электрон
является заряженной частицей, то такое
движение обуславливает протекание
некоторого замкнутого тока в атоме,
который можно охарактеризовать орбитальным
магнитным моментом![]() .
.
В
теории Бора, когда с позиции классической
теории рассматривается круговое движение
электрона по орбите радиуса ![]() со
скоростью
со
скоростью ![]() ,
величина орбитального механического
момента равна
,
величина орбитального механического
момента равна ![]() .
Если время полного оборота электрона
.
Если время полного оборота электрона ![]() ,
то такому движению соответствует
замкнутый ток
,
то такому движению соответствует
замкнутый ток
![]() ,
,
который можно охарактеризовать величиной магнитного момента
![]() .
.
Связь механического и магнитного моментов при этом определяется гиромагнитным отношением
|
|
(5.39) |
Так
как заряд электрона отрицателен, то для
орбитального движения направление
вектора магнитного момента ![]() противоположно
направлению вектора механического
момента импульса
противоположно
направлению вектора механического
момента импульса ![]() (рис.
5.8).
(рис.
5.8).
Для
расчета орбитального магнитного момента
в квантовой теории следует определить
пространственную плотность электрического
тока ![]() через
плотность потока вероятностей
через
плотность потока вероятностей ![]() по
формуле:
по
формуле: ![]() .
Плотность потока вероятности при этом
можно найти по формуле (3.23),
зная волновую функцию электрона в
заданном квантовом состоянии атома.
Точный квантовомеханический расчет
гиромагнитного отношения также приводит
к формуле (5.39).
.
Плотность потока вероятности при этом
можно найти по формуле (3.23),
зная волновую функцию электрона в
заданном квантовом состоянии атома.
Точный квантовомеханический расчет
гиромагнитного отношения также приводит
к формуле (5.39).
|
|
|
Рис. 5.8. |
Итак,
в любом квантовом состоянии атом водорода
обладает не только механическим
моментом ![]() ,
величина которого определяется
формулой (5.38),
но и магнитным моментом.
,
величина которого определяется
формулой (5.38),
но и магнитным моментом.
|
|
(5.40) |
Здесь универсальная постоянная
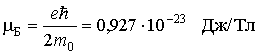
служит единицей измерения магнитных моментов атомов и называется магнетоном Бора.
Если
атом переходит из одного квантового
состояния в другое с испусканием
(поглощением) фотона излучения, то
возможны лишь такие переходы, для которых
орбитальное квантовое число ![]() изменяется
на единицу. Это правило, согласно которому
для оптических переходов
изменяется
на единицу. Это правило, согласно которому
для оптических переходов ![]() ,
называется правилом
отбора.
Наличие такого правила отбора обусловлено
тем, что электромагнитное излучение
(фотон) уносит или вносит не только квант
энергии, но и вполне определенный момент
импульса, изменяющий орбитальное
квантовое число для электрона всегда
на единицу.
,
называется правилом
отбора.
Наличие такого правила отбора обусловлено
тем, что электромагнитное излучение
(фотон) уносит или вносит не только квант
энергии, но и вполне определенный момент
импульса, изменяющий орбитальное
квантовое число для электрона всегда
на единицу.
3. Магнитное
квантовое число ![]() . В
квантовом состоянии с заданным значением
орбитального квантового числа
. В
квантовом состоянии с заданным значением
орбитального квантового числа ![]() ,
магнитное квантовое число может
принимать
,
магнитное квантовое число может
принимать ![]() различных
значений из ряда
различных
значений из ряда
![]() .
.
Физический
смысл магнитного квантового числа
вытекает из того, что волновая функция ![]() ,
описывающая квантовое состояние
электрона в атоме водорода, является
собственной функцией оператора проекции
момента импульса
,
описывающая квантовое состояние
электрона в атоме водорода, является
собственной функцией оператора проекции
момента импульса ![]() ,
причем
,
причем
![]() .
.
Поэтому,
из общих положений квантовой механики
(см. раздел
3.5)
следует, что проекция момента импульса
электрона на выделенное в пространстве
направление ![]() может
иметь только определенные значения,
равные
может
иметь только определенные значения,
равные
|
|
(5.41) |
Направление ![]() в
пространстве обычно выделяется внешним
полем (например, магнитным или
электрическим), в котором находится
атом.
в
пространстве обычно выделяется внешним
полем (например, магнитным или
электрическим), в котором находится
атом.
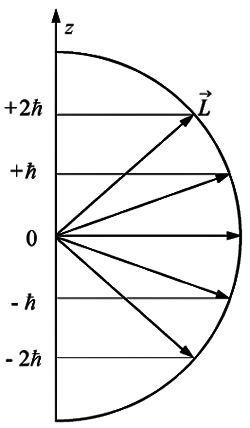
Так
как формула (5.41) квантования
проекции механического момента
соответствует вполне определенным
направлениям ориентации в пространстве
вектора ![]() (рис.
5.9), то эту формулу называют обычно формулой
пространственного квантования.
(рис.
5.9), то эту формулу называют обычно формулой
пространственного квантования.
С
точки зрения классического представления
об электронной орбите, с учетом
перпендикулярности вектора ![]() к
плоскости орбиты, соотношение (5.41) определяет
возможные дискретные расположения
электронных орбит в пространстве по
отношению к направлению внешнего поля.
к
плоскости орбиты, соотношение (5.41) определяет
возможные дискретные расположения
электронных орбит в пространстве по
отношению к направлению внешнего поля.
|
|
|
Рис. 5.9. |
Отмеченная
выше связь механического и магнитного
моментов атома позволяет с
учетом (5.41) записать
также возможные значения проекции
магнитного момента атома на выделенное
направление ![]() :
:
|
|
(5.42) |
зависящие
от значения магнитного квантового
числа ![]() .
.
36. А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относится атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Атомные ядра изучает ядерная физика.
Атомное
ядро состоит из нуклонов —
положительно заряженных протонов и
нейтральных нейтронов,
которые связаны между собой при
помощи сильного
взаимодействия.
Протон и нейтрон обладают собственным
моментом количества движения (спином),
равным ![]() [сн
1] и
связанным с ним магнитным
моментом.
[сн
1] и
связанным с ним магнитным
моментом.
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
Количество
протонов в ядре называется его зарядовым
числом ![]() —
это число равно порядковому номеру элемента,
к которому относится атом в таблице Менделеева.
Количество протонов в ядре определяет
структуру электронной
оболочки нейтрального
атома и, таким образом, химические
свойства соответствующего
элемента. Количество нейтронов в ядре
называется его изотопическим
числом
—
это число равно порядковому номеру элемента,
к которому относится атом в таблице Менделеева.
Количество протонов в ядре определяет
структуру электронной
оболочки нейтрального
атома и, таким образом, химические
свойства соответствующего
элемента. Количество нейтронов в ядре
называется его изотопическим
числом ![]() .
Ядра с одинаковым числом протонов и
разным числом нейтронов называются изотопами.
Ядра с одинаковым числом нейтронов, но
разным числом протонов —
называются изотонами.
Термины изотоп и изотон используются
также применительно к атомам, содержащим
указанные ядра, а также для характеристики
нехимических разновидностей одного
химического элемента. Полное количество
нуклонов в ядре называется его массовым
числом
.
Ядра с одинаковым числом протонов и
разным числом нейтронов называются изотопами.
Ядра с одинаковым числом нейтронов, но
разным числом протонов —
называются изотонами.
Термины изотоп и изотон используются
также применительно к атомам, содержащим
указанные ядра, а также для характеристики
нехимических разновидностей одного
химического элемента. Полное количество
нуклонов в ядре называется его массовым
числом ![]() (очевидно
(очевидно ![]() )
и приблизительно равно средней массе
атома, указанной в таблице Менделеева.
Нуклиды с одинаковым массовым числом,
но разным протон-нейтронным составом
принято называть изобарами.
)
и приблизительно равно средней массе
атома, указанной в таблице Менделеева.
Нуклиды с одинаковым массовым числом,
но разным протон-нейтронным составом
принято называть изобарами.
Как и любая квантовая система, ядра могут находиться в метастабильном возбуждённом состоянии, причём в отдельных случаях время жизни такого состояния исчисляется годами. Такие возбуждённые состояния ядер называются ядерными изомерами.

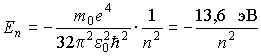 .
.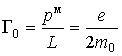 .
.