
- •Содержание
- •Введение
- •Общая характеристика
- •История открытия
- •От актиния до нептуния
- •От плутония до лоуренсия
- •Изотопы
- •Распространение в природе
- •Получение
- •Cвойства
- •Физические свойства
- •Зависимость металлического и ионного радиусов от порядкового номера элемента
- •Химические свойства
- •Соединения актиноидов
- •Оксиды и гидроксиды
- •Соли кислот
- •Координационные соединения
- •Применение
- •Токсичность
- •Заключение
- •Приложение а
- •Приложение б
- •Выделение урана и плутония из ядерного топлива
- •Температуры плавления актиноидов
- •Приложение в
-
Соединения актиноидов
-
Оксиды и гидроксиды
-
Для актиноидов известно несколько видов
оксидов: M2O3, MO2, M2O5 и MO3. Для всех металлов
оксиды M2O3, MO2 и M2O5 — осно́вные, а MO3 —
амфоте́рные. Более выражены основные
свойства оксидов. Они легко соединяются
с водой, образуя основания:
![]()
Данные основания плохо растворяются в воде, а по своей активности близки к гидроксидам редкоземельных металлов. Наиболее сильным из этих оснований является гидроксид актиния. Актиний сравнительно легко взаимодействует с водой, вытесняя водород. Все соединения актиния, кроме его чёрного сульфида (Ac2S3), имеют белую окраску. Оксиды четырёхвалентных актиноидов (табл. 8) кристаллизуются в кубическую сингонию, структура кристалла типа флюорита (фторид кальция)
Таблица 8
|
Диоксиды некоторых актинидов (An — актиноид(-ы)) |
|||||||||
|
Название соединения |
Диоксид тория |
Диоксид протактиния |
Диоксид урана |
Диоксид нептуния |
Диоксид плутония |
Диоксид америция |
Диоксид кюрия |
Диоксид берклия |
Диоксид калифорния |
|
CAS-номер |
1314-20-1 |
12036-03-2 |
1344-57-6 |
12035-79-9 |
12059-95-9 |
12005-67-3 |
12016-67-0 |
12010-84-3 |
12015-10-0 |
|
Химическая формула |
ThO2 |
PaO2 |
UO2 |
NpO2 |
PuO2 |
AmO2 |
CmO2 |
BkO2 |
CfO2 |
|
Молярная масса |
264,04 г·моль−1 |
263,035 г·моль−1 |
270,03 г·моль−1 |
269,047 г·моль−1 |
276,063 г·моль−1 |
275,06 г·моль−1 |
270–284 г·моль−1 |
279,069 г·моль−1 |
283,078 г·моль−1 |
|
Температура плавления |
3220 °C |
|
2878 °C |
2600 °C |
2400 °C |
2050 °C |
2270 °С |
|
|
|
Температура кипения |
4400 °C |
|
|
|
2800 °C |
|
|
|
|
|
Структура |
|
||||||||
|
Координационное число |
An[8], O[4] |
||||||||
Торий, соединяясь с кислородом, образует лишь диоксид. Его можно получить при сжигании металлического тория в кислороде при температуре в 1000 °C, или нагреванием некоторых его солей. Диоксид тория является тугоплавким веществом и очень стоек к нагреванию. Из-за этого свойства диоксид тория иногда используют в производстве огнеупорных материалов. Добавление 0,8—1 % ThO2 к чистому вольфраму стабилизирует его структуру; поэтому волоски электроламп имеют лучшую устойчивость при вибрациях. Чтобы растворить ThO2 в кислотах его сначала нагревают до температуры 500—600 °C. Более сильное нагревание (выше 600 °C) способствует получению очень стойкой к кислотам и другим реагентам структуры ThO2. Небольшая добавка фторид-ионов катализирует растворение торий и его диоксида в кислотах.
У протактиния получено два оксида: PaO2 (чёрный) и Pa2O5 (белый). Первый из них изоморфен с ThO2. Оба оксида протактиния осно́вные. Для пятивалентного протактиния можно получить Pa(OH)5 — слабое плохо растворимое основание.
При разложении некоторых солей урана можно получить оранжевый или жёлтый UO3. Данный оксид является амфотерным; он непосредственно получается при взаимодействии с водой и создает несколько гидроксидов, из которых наиболее стабильным является UO2(OH)2. При реакции оксида урана(VI) с водородом получается диоксид урана, который схож по своим свойствам с ThO2. Этот оксид также является осно́вным. Ему соответствует тетрагидроксид урана (U(OH)4).
Плутоний, нептуний и америций образуют оксиды двух типов: M2O3 и MO2, которые обладают осно́вными свойствами. У кюрия получены белый Cm2O3 и чёрный CmO2, у калифорния — Cf2O3 и CfO2,, который разлагается при 400 °C. Оксиды остальных актиноидов плохо изучены. Триоксид нептуния является менее стойким, чем оксид урана, поэтому он не получен в чистом виде (только Np3O8). В то же время, хорошо изучены оксиды плутония и нептуния с химической формулой MO2 и M2O3. Оксид плутония(IV)(см приложение В, рис. В.1) нашел свое применение в ядерной энергетике в качестве ядерного топлива.
Свойства оксидов и их свойства представлены в таблице 9.
Таблица 9
|
Оксиды актиноидов |
|||||||
|
Соединение |
Цвет |
Сингония и структурный тип |
Параметры ячейки, Å |
Плотность, г/см³ |
Область существования, °C |
||
|
a |
b |
c |
|||||
|
Ac2O3 |
Белый |
Гексагональная, La2O3 |
4,07 |
— |
6,29 |
9,19 |
— |
|
PaO2 |
— |
Кубическая, CaF2 |
5,505 |
— |
— |
— |
— |
|
Pa2O5 |
Белый |
Кубическая, CaF2 Квадратичная Тетрагональная Гексагональная Ромбоэдрическая Орторомбическая |
5,446 10,891 5,429 3,817 5,425 6,92 |
— — — — — 4,02 |
— 10,992 5,503 13,22 — 4,18 |
— |
700 700—1100 1000 1000—1200 1240—1400 — |
|
ThO2 |
Бесцветный |
Кубическая |
5,59 |
— |
— |
9,87 |
— |
|
UO2 |
Чёрно-коричневый |
Кубическая |
5,47 |
— |
— |
10,9 |
— |
|
NpO2 |
Зеленовато-коричневый |
Кубическая, CaF2 |
5,424 |
— |
— |
11,1 |
— |
|
PuO |
Чёрный |
Кубическая, NaCl |
4,96 |
— |
— |
13,9 |
— |
|
PuO2 |
Оливково-зелёный |
Кубическая |
5,39 |
— |
— |
11,44 |
— |
|
Am2O3 |
Красновато-коричневый Рыжевато-коричневый |
Кубическая, Mn2O3 Гексагональная, La2O3 |
11,03 3,817 |
— |
— 5,971 |
10,57 11,7 |
— |
|
AmO2 |
Чёрный |
Кубическая, CaF2 |
5,376 |
— |
— |
— |
— |
|
Cm2O3 |
Белый — — |
Кубическая, Mn2O2 Гексагональная, LaCl3 Моноклинная, Sm2O3 |
11,01 3,80 14,28 |
— — 3,65 |
— 6 8,9 |
11,7 |
— |
|
CmO2 |
Чёрный |
Кубическая, CaF2 |
5,37 |
— |
— |
— |
— |
|
Bk2O3 |
Светло-коричневый |
Кубическая, Mn2O3 |
10,886 |
— |
— |
— |
— |
|
BkO2 |
Рыжевато-коричневый |
Кубическая, CaF2 |
5,33 |
— |
— |
— |
— |
|
Cf2O3 |
Бесцветный Желтоватый — |
Кубическая, Mn2O3 Моноклинная, Sm2O3 Гексагональная, La2O3 |
10,79 14,12 3,72 |
— 3,59 — |
— 8,80 5,96 |
— |
— |
|
CfO2 |
Чёрный |
Кубическая |
5,31 |
— |
— |
— |
— |
|
Es2O3 |
— |
Кубическая, Mn2O3 Моноклинная Гексагональная, La2O3 |
10,07 1,41 3,7 |
— 3,59 — |
— 8,80 6 |
— |
— |

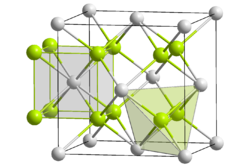 An4+:
__ / O2−:
__
An4+:
__ / O2−:
__