
1. Основные типовые задачи эксперимента в биотехнологии и смежных дисциплинах. Планирование эксперимента, работа с информационными источниками. Критерии воспроизводимости методики. Ретросинтетический подход к планированию синтеза.
Основные методы выделения и анализа веществ. Реактивы и растворители.
Основные задачи:
-
Получить вещество: синтез и выделение
-
Изучить его свойства
-
Изучить взаимодействие вещества с живыми системами
-
Контроль и валидация процессов получения вещества

Планирование эксперимента, работа с информационными источниками:

Литературные источники:
-
Первичные (журналы, патенты)
-
Вторичные (книги (монографии), реферативные журналы (короткие abstracts из статей), справочники)
Из них извлекается методика и схема синтеза.
Интернет:
-
Базы данных по литературе
-
Organic synthesis
-
Справочник Бейльштейнаonline; chemical abstract
Что можно выцепить из справочника online?
-
структуру соединения, химическое название
-
CAS – chemical abstract service
-
Журнал, в котором описано это вещество (том, авторы, год, номер)
-
фх свойства вещества
-
фразы риска свойства вещества по токсичности и опасности
Критерии воспроизводимости методики:
-
Воспроизводимы ли условия реакции (t,p,реакционная среда)
Реакционная среда: растворитель, все примеси, воздух, колба (химическое стекло не всегда инертно)
-
Есть ли необходимое оборудование
-
Доступны ли нужные реактивы и растворители (по экономическим, теоретическим и политическим причинам)
-
Имеются ли условия для безопасной работы с необходимыми реагентами
-
Достаточно ли аналитическое обеспечение
-
Возможно ли провести синтез в необходимом масштабе (если в методике 1 г, а надо получить 5 кг, следовательно, это технически невозможно)
-
Хватит ли у вас опыта для этой работы
Ретросинтетический подход к планированию синтеза (РСП)
РСП проводится для того, чтобы понять, как провести синтез. На лекции рассматривался пример с тиамидом.
В основе ретросинтетического анализа
лежит идея постепенного уменьшения
молекулярной сложности. Проводят
последовательное упрощение структуры
в соответствии с определенными правилами
до тех пор, пока не будет получено
доступное соединение, либо такое
соединение, способ синтеза которого
известен. (разрезание молекулы «на
кусочки» по каждой из групп)

Основные методы выделения и анализа веществ.
Методы выделения:
-
Перегонка – только для устойчивых веществ с Ткип<200 градусов, количество от 10 г и более. Меньшее количество – микроперегонка.
-
Кристаллизация – только для твердых веществ с ограниченной растворимостью в чем-либо, количество от 100 мг и более.
-
Хроматография – для растворимых веществ, количество от 1 мг до 100 мг.
-
Переосаждение – для веществ, образующих соли и комплексы.
-
Экстракция – для растворимых веществ, количество от 10 мг.
Методы анализа:
-
ТСХ (определить количество вещества, наличие нек. функционльных групп, неколичественный метод)
-
Спектроскопия ЯМР – дает полное доказательство структуры вещества, может дать данные о чистоте вещества.(кол метод)
-
Масс-спектроскопия – не дает прямой структуры, но молекулярную формулу узнаем.
-
Элементный анализ – брутто-формула. Чистота вещества. Не определяет изомеры. Определение температуры кипения и плавления – только для известных веществ.
-
ВЭЖХ (в том числе с масс-детектором LCMS (Liquidchromatography–massspectrometry)) – анализ состава смеси и процентное содержание в-в.
-
Оптическая (ИК,УФ)-спектроскопия.
-
Гель-электрофорез.
Сложные аналитические методы:
-
Рентгеноструктурный анализ
-
Двумерная ЯМР-спектроскопия
-
Масс-спектроскопия высокого разрешения
Аналитические задачи
-
1) Контроль протекания процессов – хроматография, оптическая спектроскопия, электрофорез
-
2) Установление структуры молекулы – ЯМР, масс-спектрометрия, РСА
-
3) Доказательство чистоты вещества – хроматография, электрофорез, элементный анализ
Реактивы и растворители.
Общая классификация растворителей:
-
Протонные и апротонные
Протонные. Могут отщепить протон (кислота или основание). Вода, спирты, NH3.
Апротонные. Менее реакционно способны
Ацетон, бензол, гексан, хлороформ, ДМСО, ДМФА.
-
Низко (хлористый метилен 40 градусов) и высококипящие (ДМФА)
-
Полярные и неполярные
-
Самовоспламеняющиеся (сероуглерод, диметиловый спирт), горючие (гексан, бензол), негорючие(хлороформ, дихлорэтан). Если не знаем – считаем, что горит.
-
Гигроскопичные, смешивающиеся с водой, несмешивающиеся с водой (Примесь воды мешает протеканию реакции)
Спирты – смешивающиеся, ацетонитрил, ацетон (их всех можно потушить водой)
Бензол – несмешивающийся с водой (используется для очистки, их нельзя тушить водой)
-
Мало (вода и этиловый спирт) и сильнотоксичные (все остальные).

2.Селективность химической реакции. Основные подходы к построению углеродного скелета молекулы. Синтезы сложных молекул (витамин А и др).
Селективность химической реакции
Для того, чтобы реакция была применима в препаративном смысле (получение), вводятся условия селективности. Главным условием должно быть протекание только одной реакции между реагентом и функциональной группой в данных условиях. Если реакций идет больше, то синтез препаративного значения иметь не может.
Какие еще бывают условия селективности:
-
Региоселективность. При наличии в молекуле одинаковых функциональных групп реакция протекает в основном с одной из них. Пример бромирование пропана.
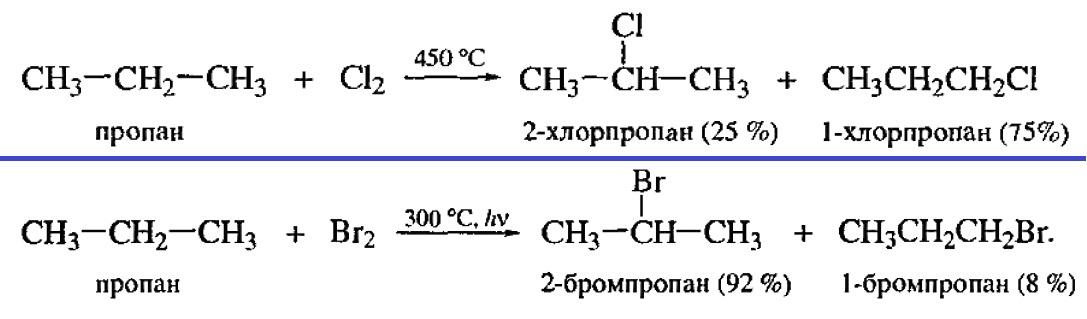
-
Хемоселективность. При наличии в молекуле сходных по свойствам функциональных групп реакция протекает преимущественно с одной из них.
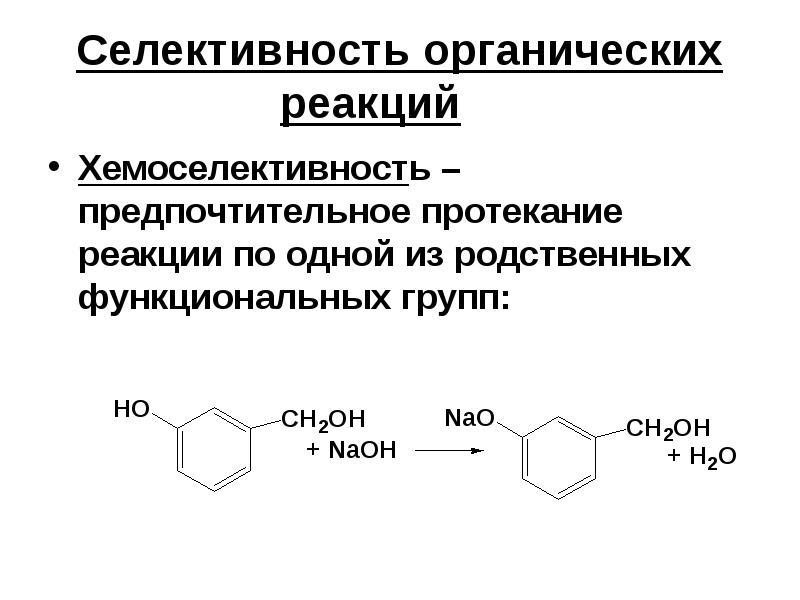
-
Стереоселективность. Из оптически активного исходного получается оптически активный продукт или из рацемата (нестериоспецифичного исходного) получается преимущественно один изомер.

-
Если исходное вещество, отличающееся только стериоизомерией, превращается в стериоизомерно различные продукты – стериоспецифическая реакция.
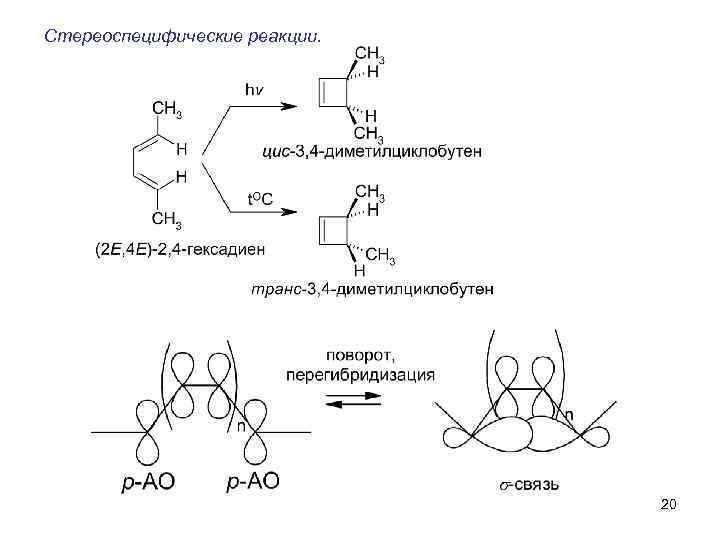
Основные подходы к построению углеродного скелета молекулы
-
Последовательные реакции
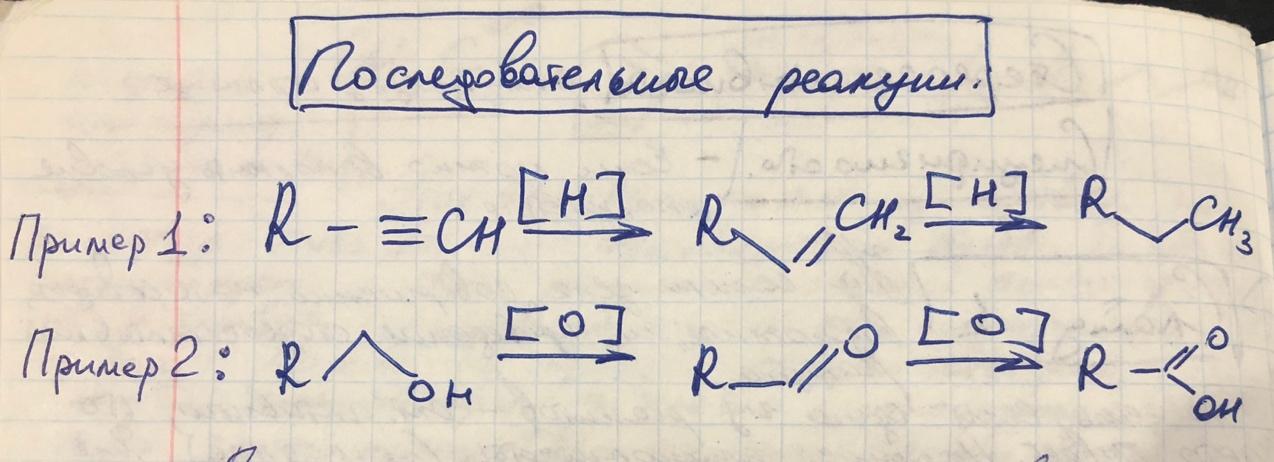
-
Параллельные реакции
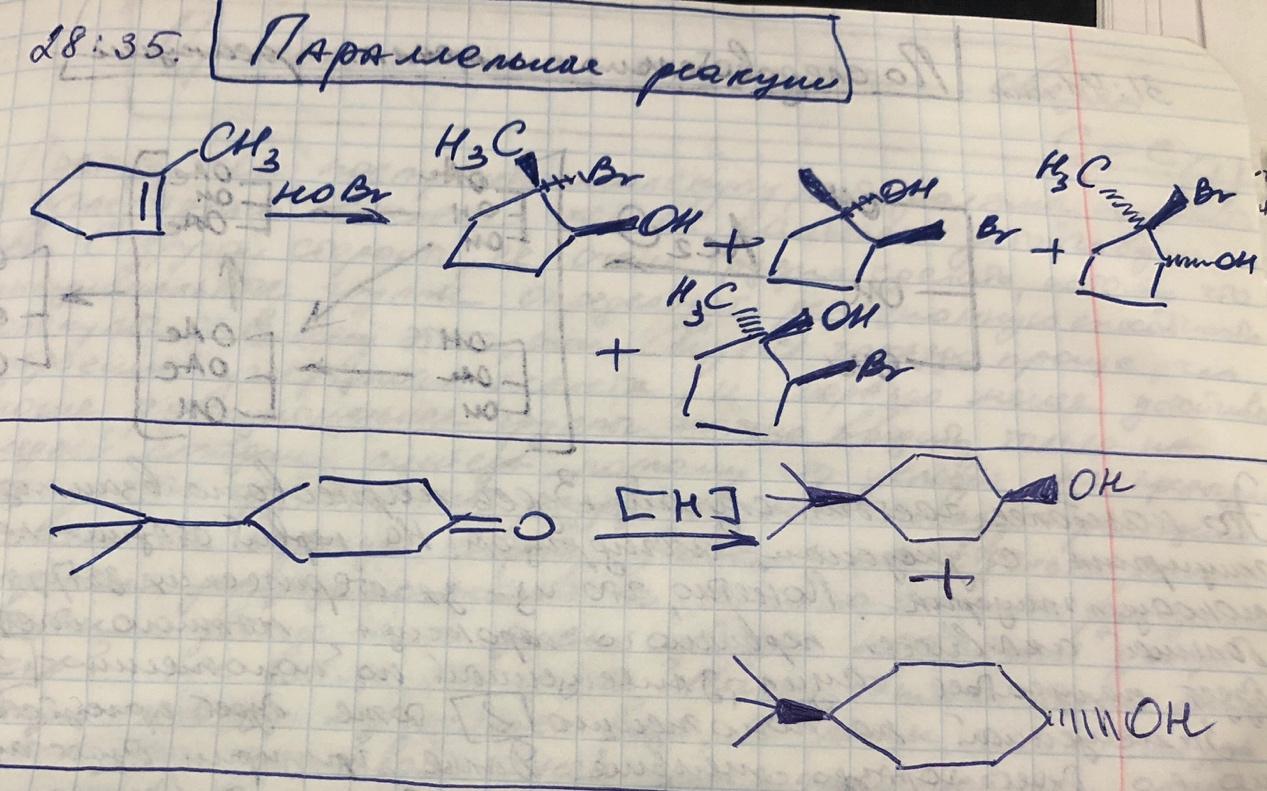
-
Последовательно-параллельные реакции
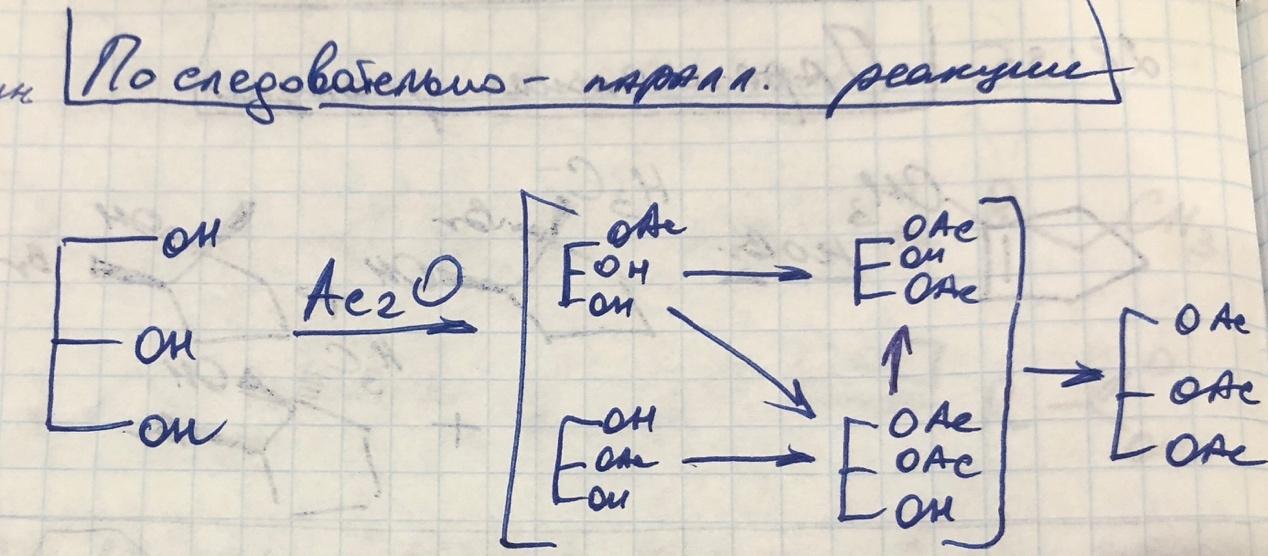
-
Реакция Дильса-Альдера (диеновый синтез)
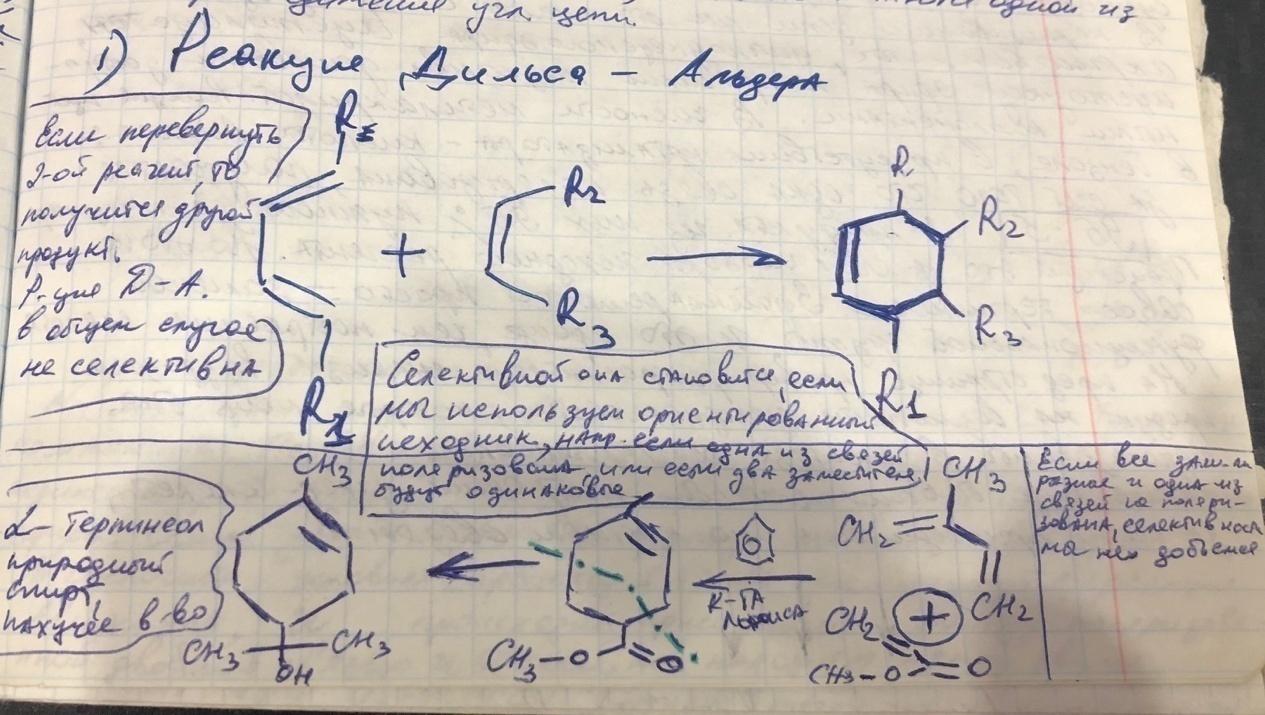
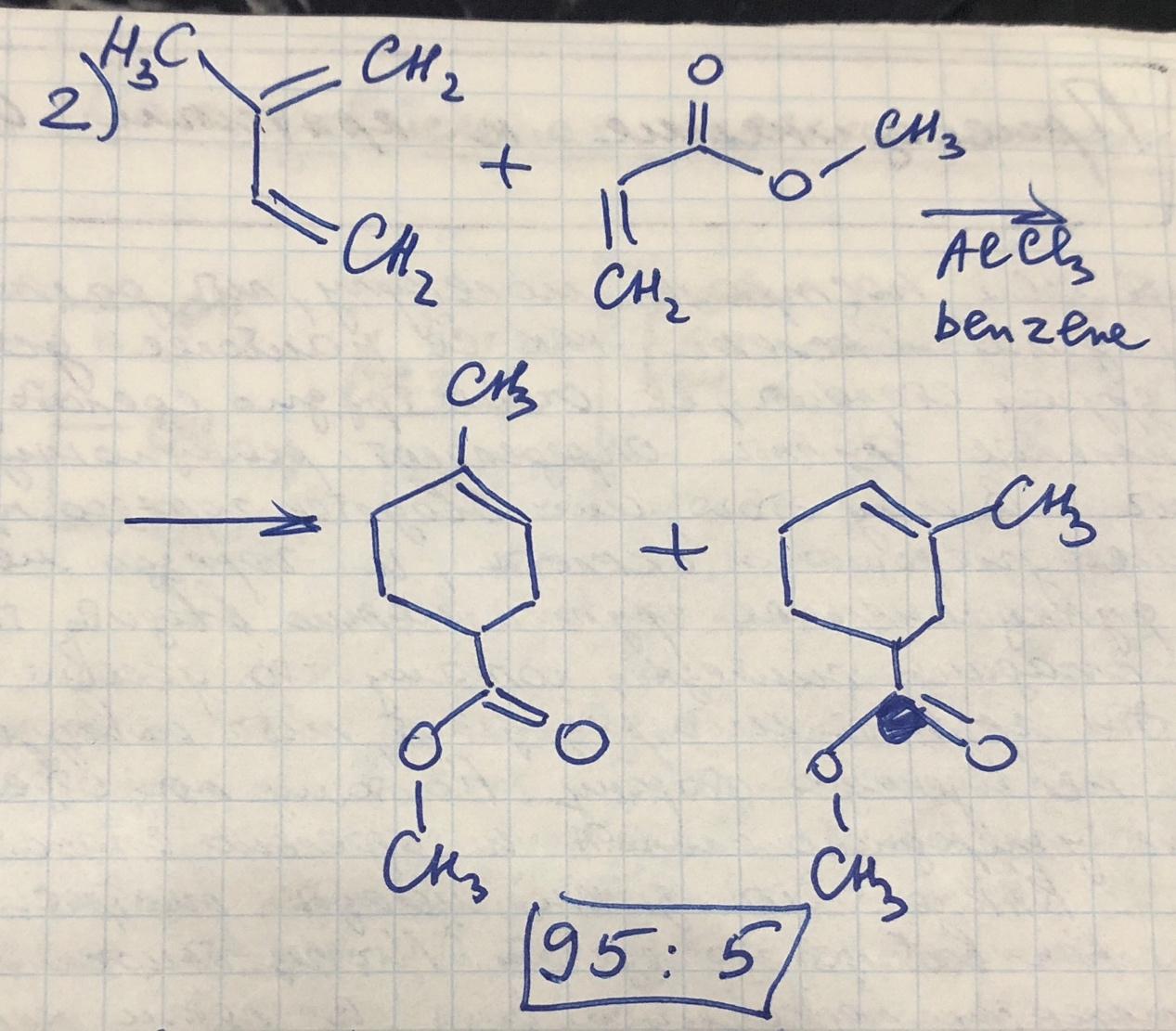
-
Присоединение реактивов Гриньяра к карбонильным соединениям
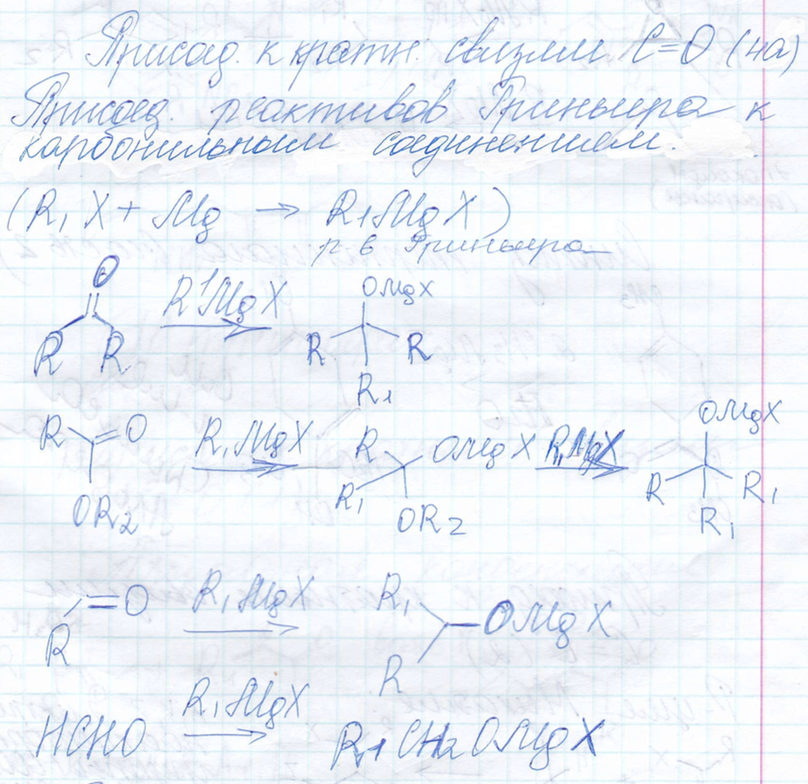
-
Присоединение реактивов Гриньяра к ортоэфирам, эпоксидам и СО2
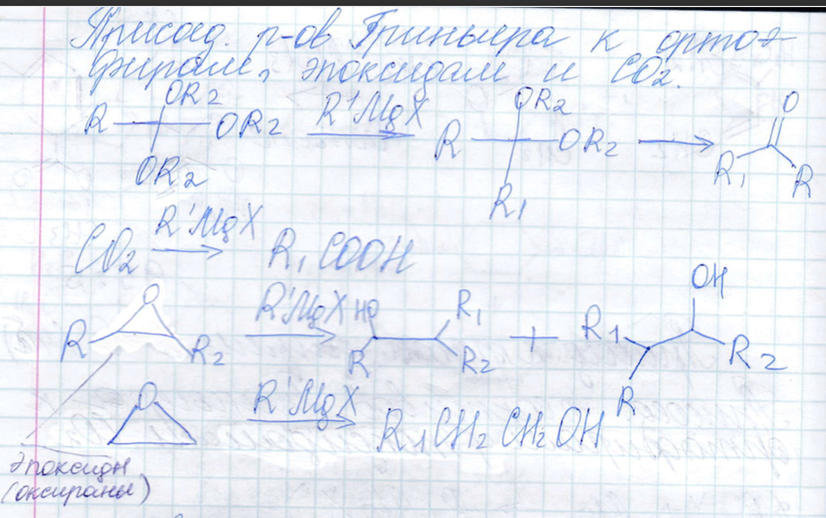
-
Реакция Михаэля
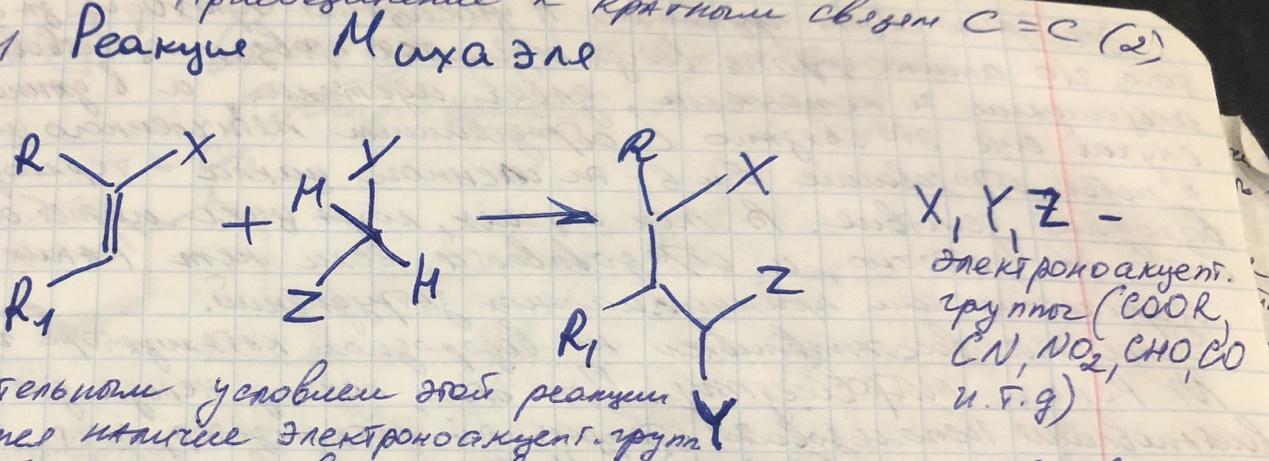
-
Синтез триптофана
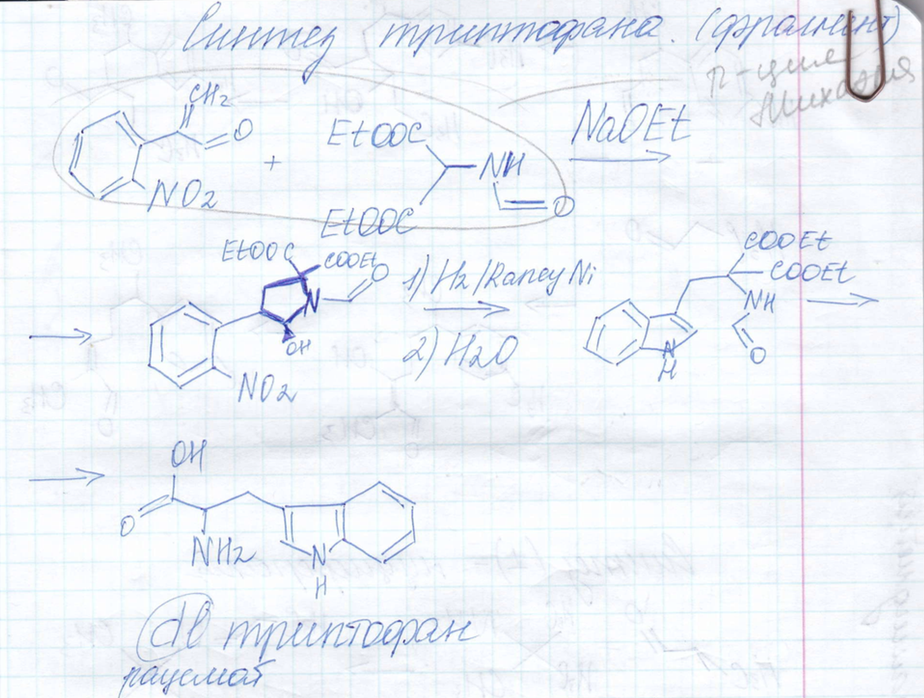
-
Альдольная конденсация
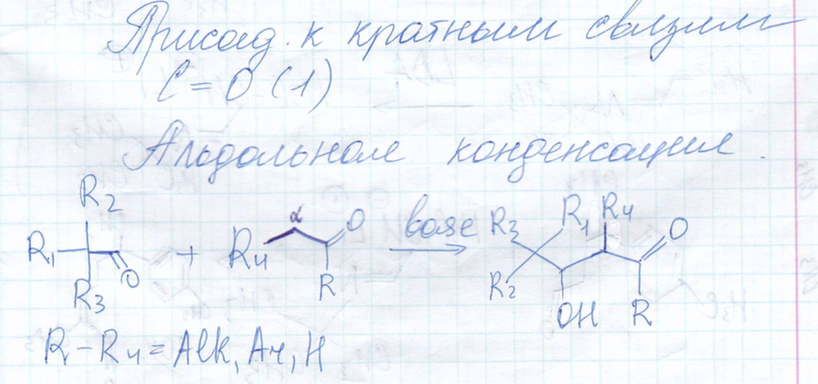
-
Синтез ()-нуцифераля
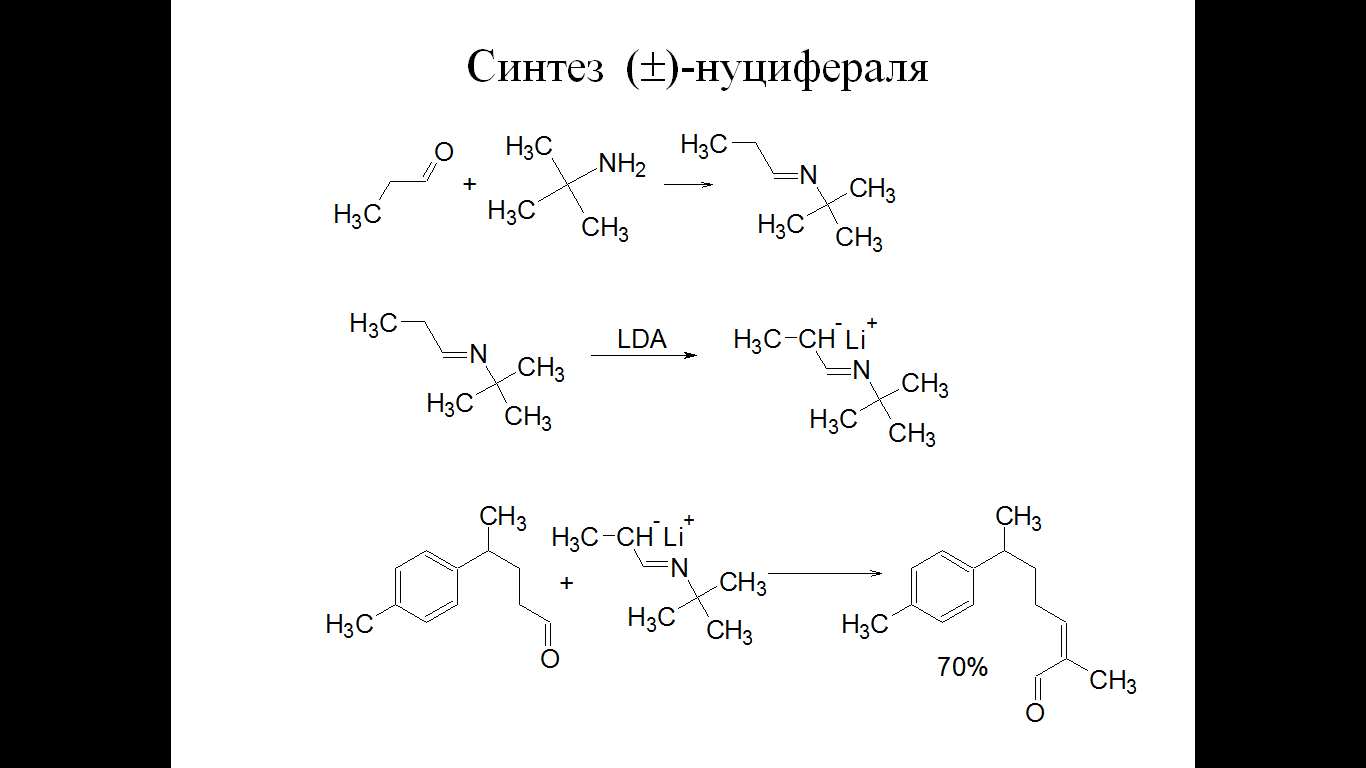
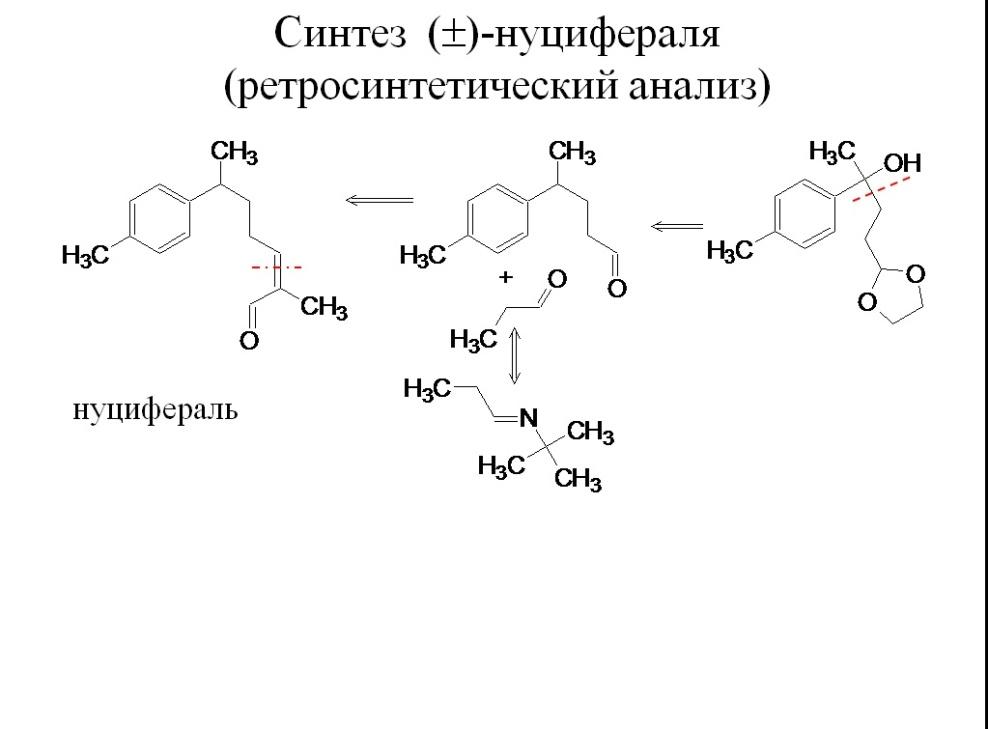
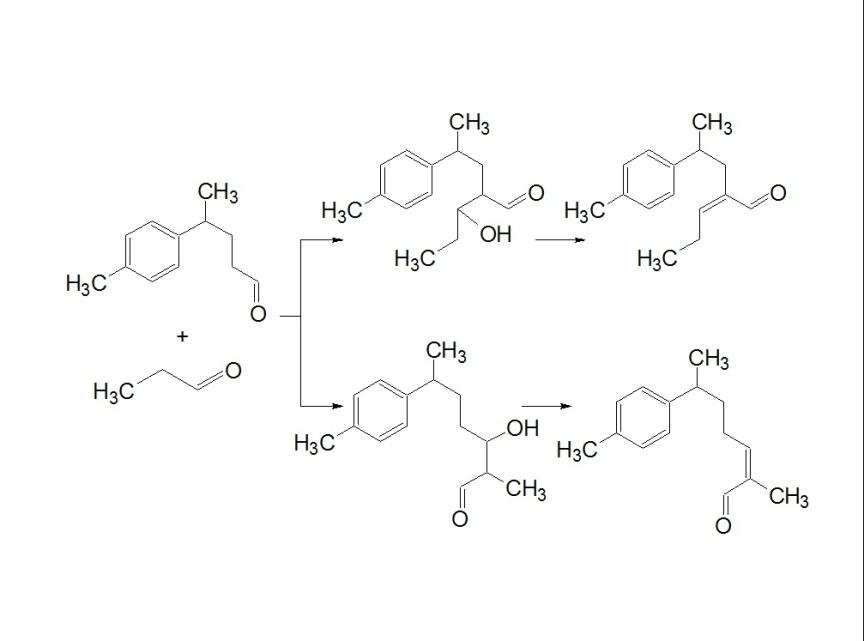


-
Алкилирование и ацилирование СН-кислотных соединений
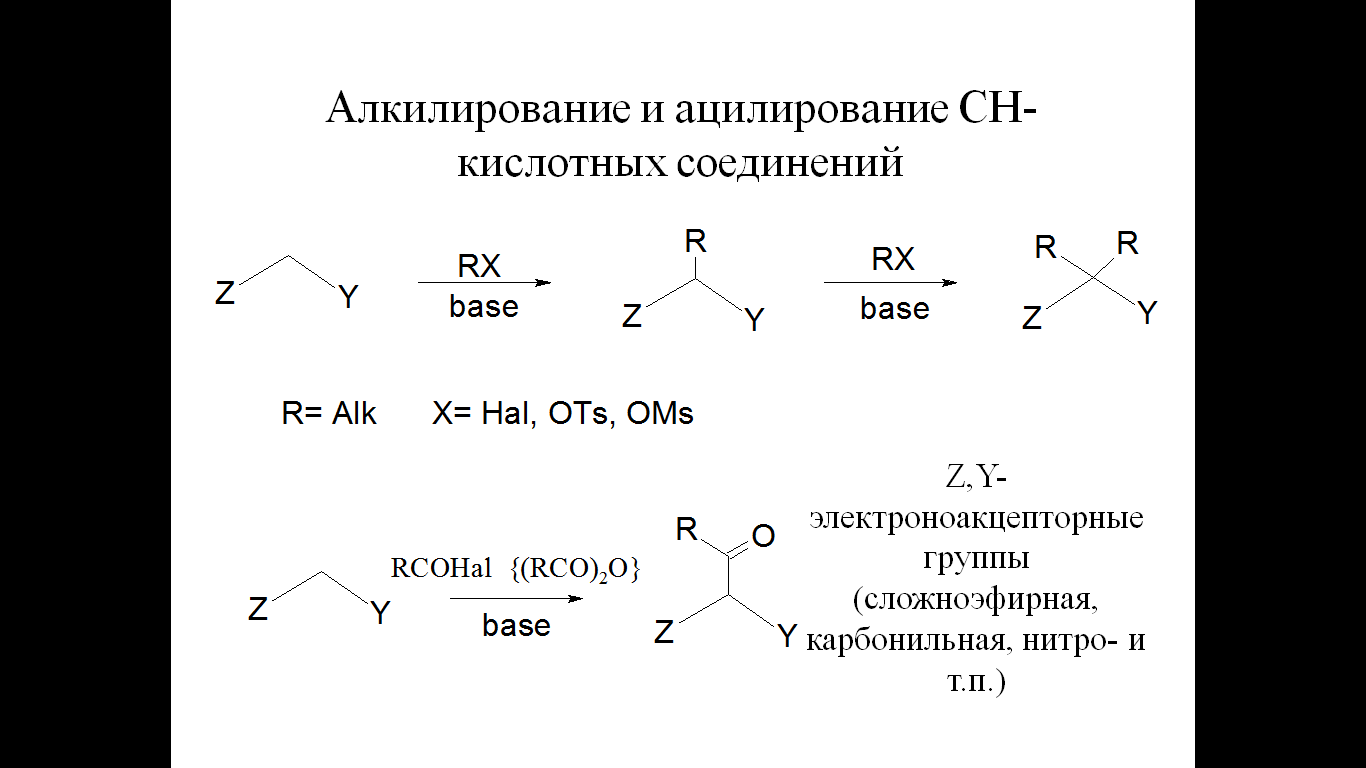
-
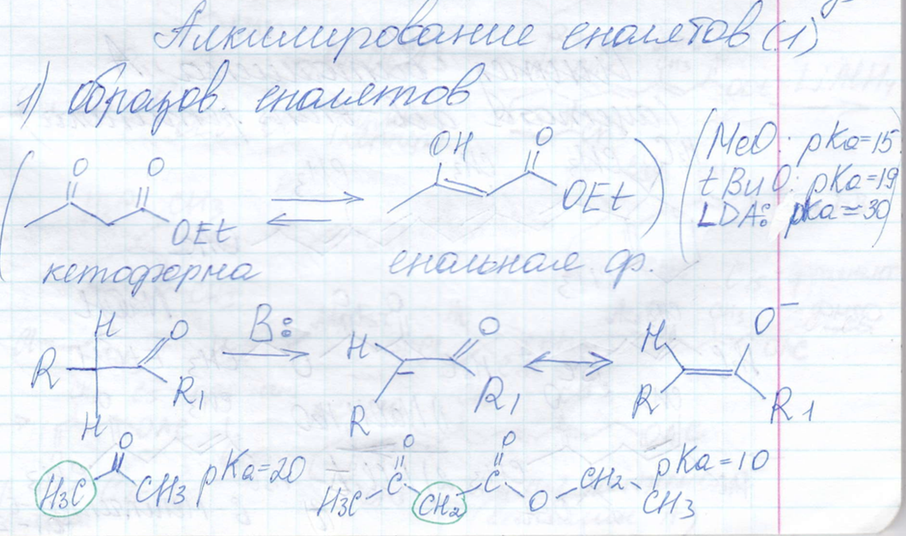
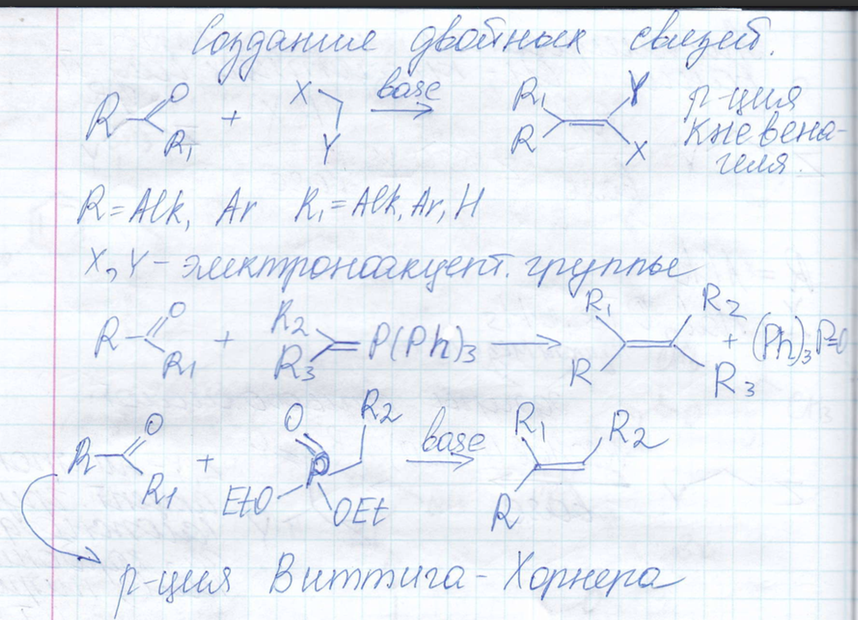
Алкилирование енолятов
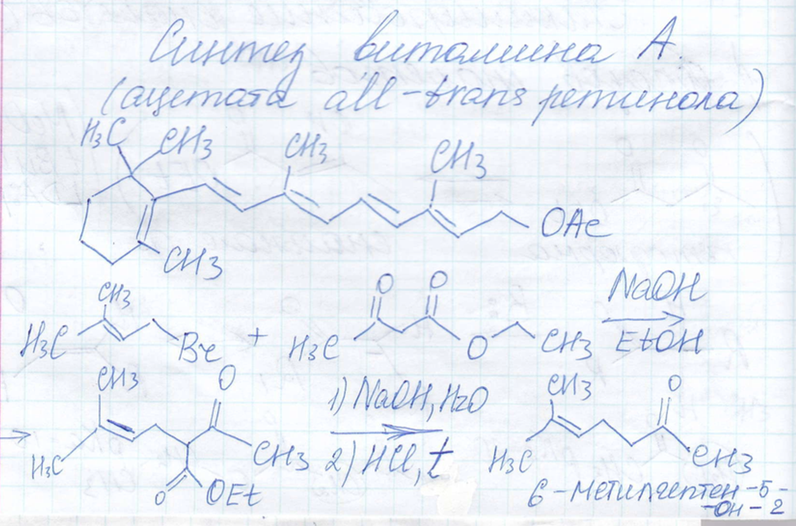
Синтез витамина А
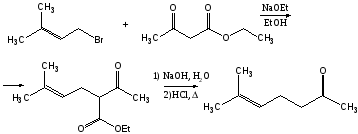
6-Метилгептен-5-он-2
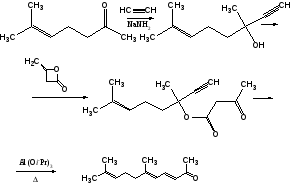
дегидролиналоол
псевдоионон

β-Ионон

Реакция Хорнера
С15-фрагмент
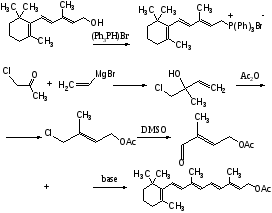
С5-фрагмент
С15+С5
Реакция Виттига
Ацетат ретинола (витамин А)

Пути построения нового углеродного скелета. Они разбиты на две группы.
1, Добавление одного углеродного атома:
![]()
Образуются только первичные спирты.
![]()
Образуются нитрилы и кислоты.
![]()
Образуются кислоты.
2. Соединение двух углеродных цепей:
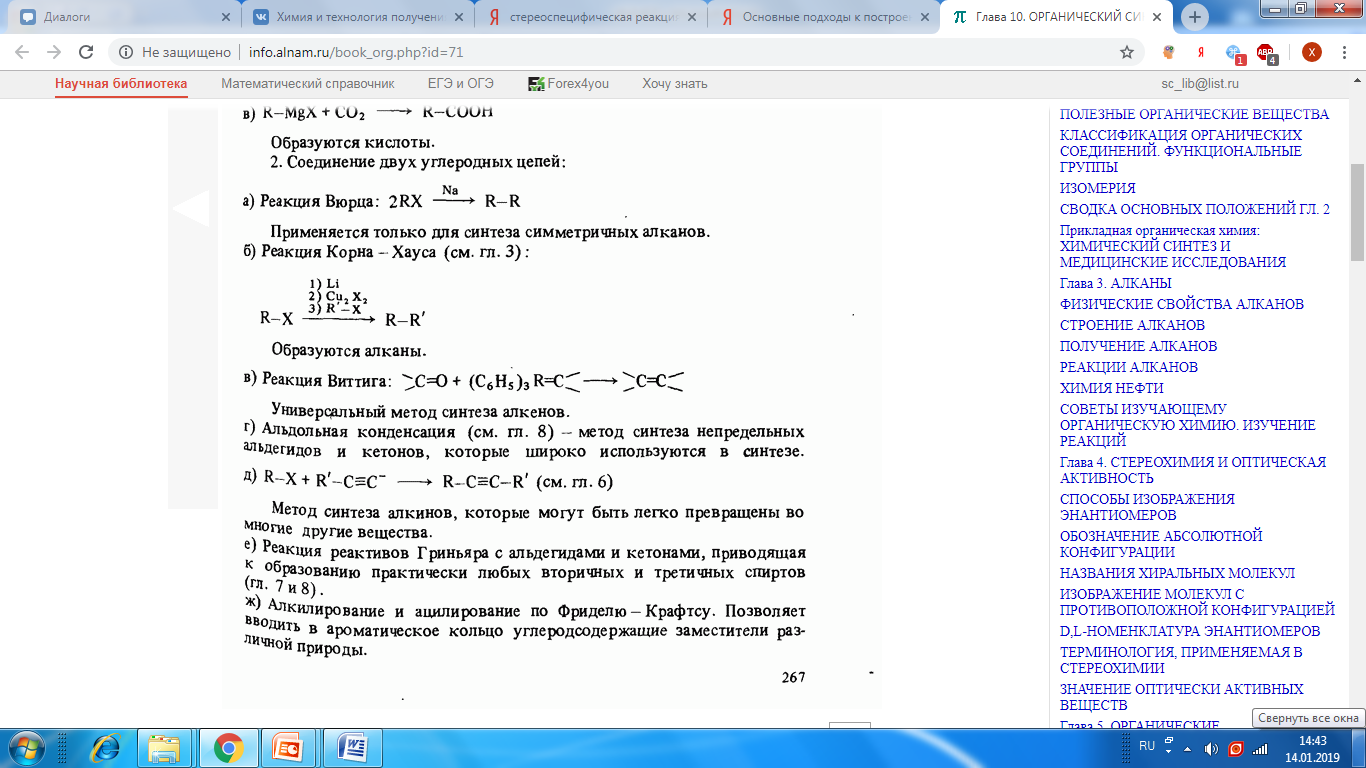
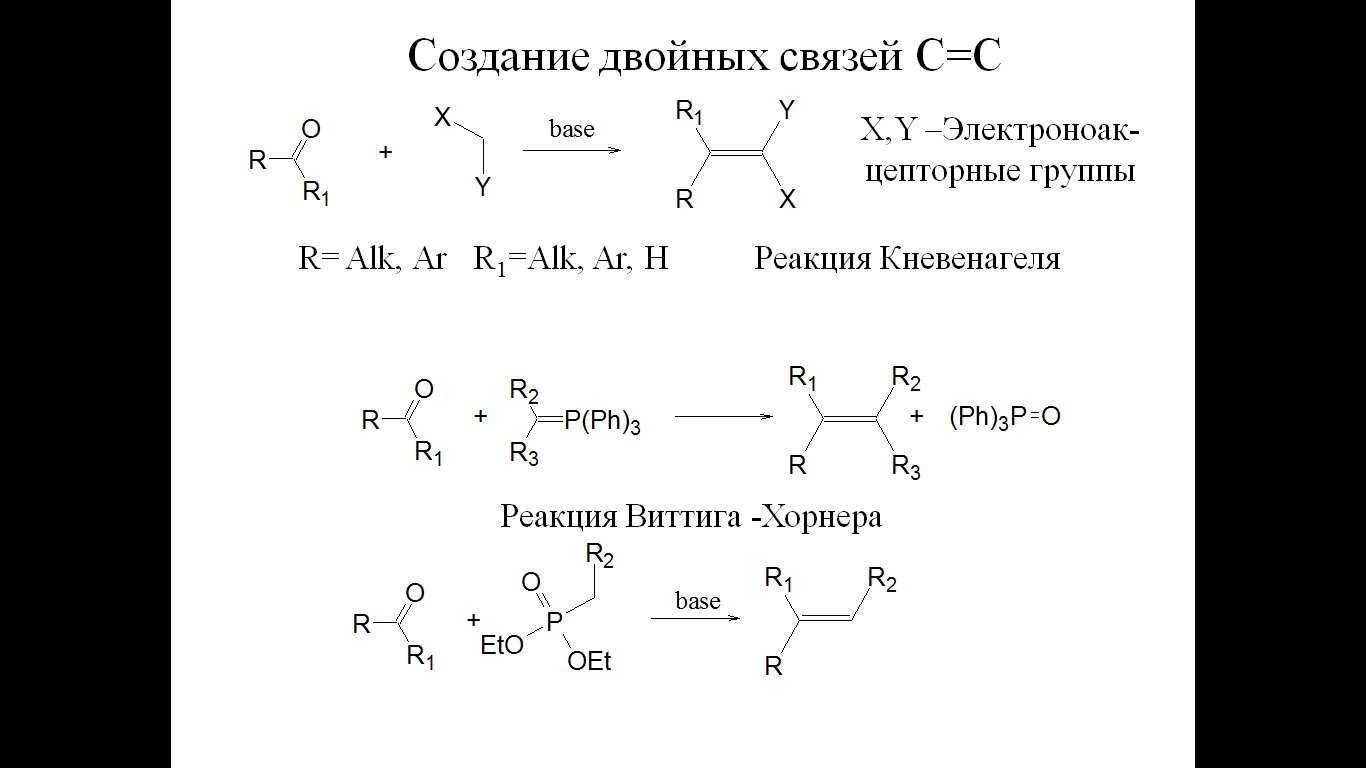 Метод
синтеза алкинов, которые могут быть
легко превращены во многие другие
вещества.
Метод
синтеза алкинов, которые могут быть
легко превращены во многие другие
вещества.
е) Реакция реактивов Гриньяра с альдегидами и кетонами, приводящая к образованию практически любых вторичных и третичных спиртов (гл. 7 и 8).
ж) Алкилирование и ацилирование по Фриделю - Крафтсу. Позволяет вводить в ароматическое кольцо углеродсодержащие заместители разной природы.
3. Методы введения и взаимопревращения функциональных групп. Защитные группы - роль в синтезе, требования к защитным группам.
Защитные группы на амины, спиртовую группу, карбонил и др. функции: методы введения, удаления, сравнительные достоинства и недостатки разных типов ЗГ.
Методы введения и взаимопревращения функциональных групп
Говоря о введении функциональной группы мы говорим о взаимопревращении (из одной в другую). Ниже приведена таблица по взаимопревращению функциональных групп.

Рассмотрим получение некоторых из них.
Галогенпроизводные. Обычно получают с помощью замещения спиртовой группы, протона, реакцией Зандмейера, аллильным бромированием, расщепленем простых эфиров и прямым замещением в гетероциклах. Для введения галгенов испоьзуются различные реагенты:

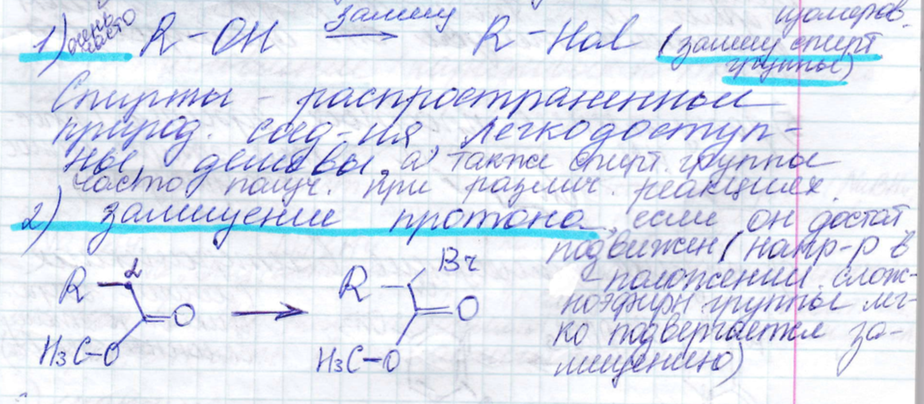

Спирты и фенолы. Получают с помощью восстановления карбоновых кислот, альдегидов, кетонов, сложных эфиров, а также гидролизом.


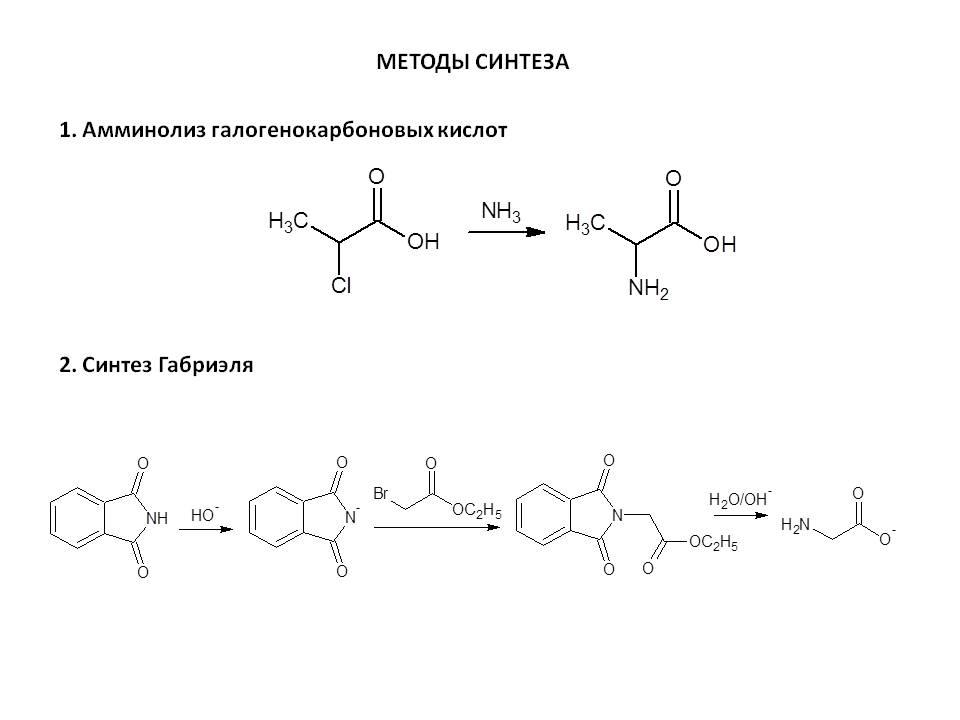
Амины. Аминогруппы содержатся в 80% лекарств, природных биологических активных соединениях, так как взаимодействие ферментов, рецепторов носит электростатический характер, требующий заряд. А так как заряд чаще всего несет аминогруппа, почти все амины физиологически активны и по этой же причины токсичны. Получают амины с помощью восстановления, восстановительного аминирования, перегруппировки и синтезом Габриэля.



Карбонильные соединения. Нитрилы. Сульфоэфиры.


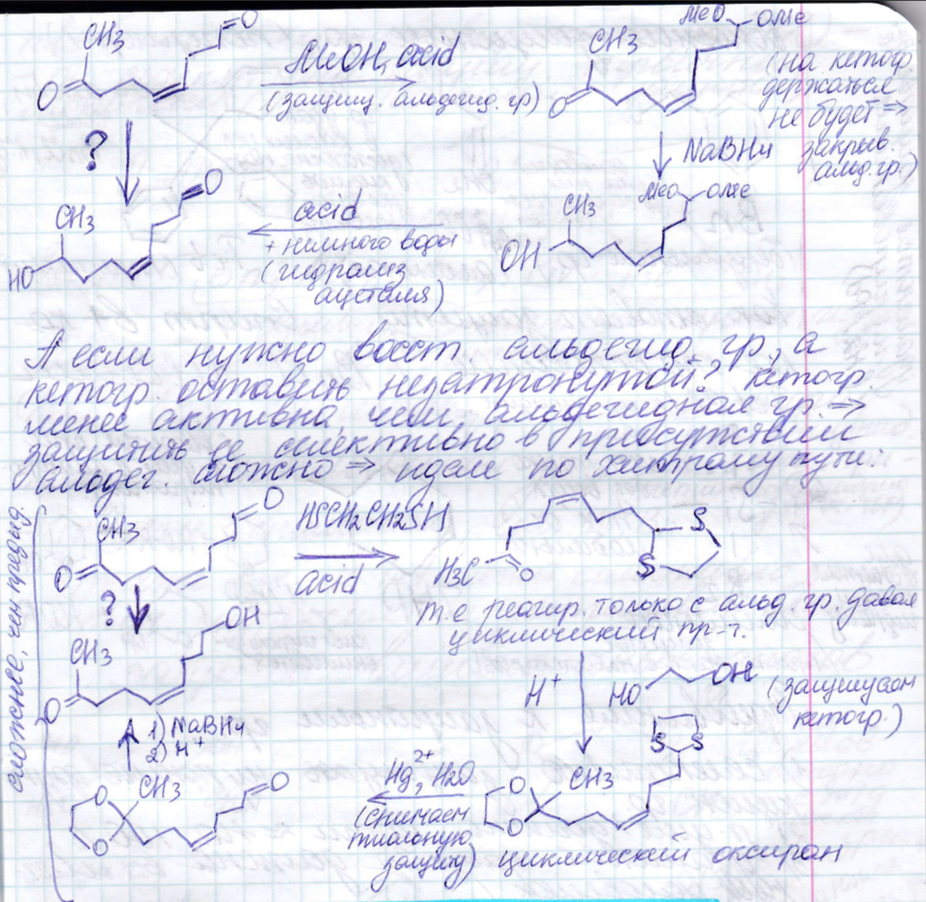
Защитные группы - роль в синтезе, требования к защитным группам
Защита спиртов.
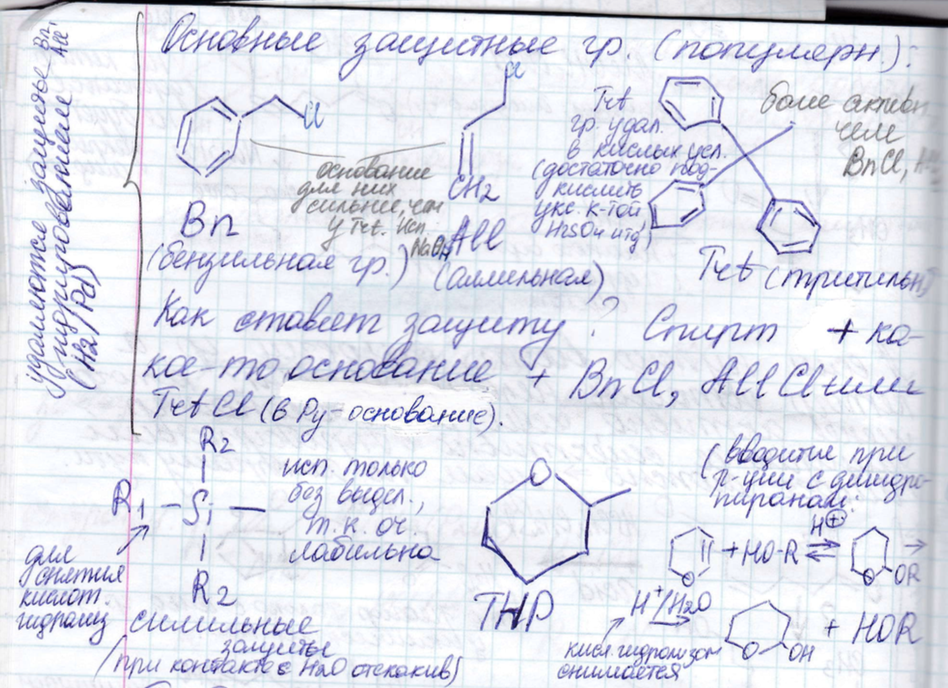
Требования к защитным группам:
-
Селективно защищать нужную функциональную группу
-
Реакция должна идти на 100% - высокая доля получения нужного продукта
-
Удаляться защита должна в мягких условиях
-
Защитная группа должна селективно выводиться/ извлекаться.
5) Цена реагента
6) Модификационная защитная группа не должна быть реакционоспособной к другим реакциям
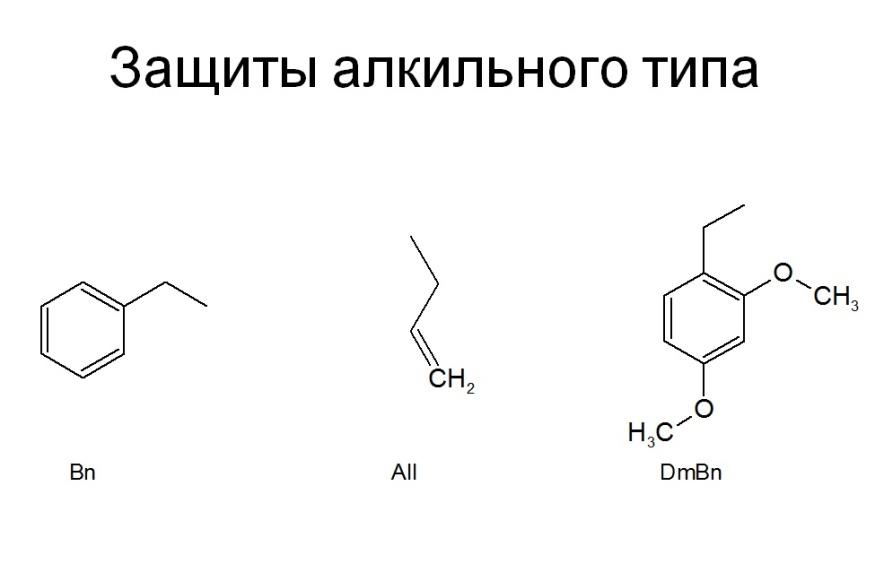
Например Bn->толуол, All->в газ превращается при отщеплении. А при отщеплении Trt->третиловый спирт (его сложно отогнать, оно очень гидрофобное), третильные производные очень хорошо проявляются на ТСХ – желтая окраска пятен, Trt еще имеет достоинство (помимо хорошей видимости на ТСХ) – он селективно защищает первичный гидроксил (тк большая защита).

Защита вицинальных диолов.


Защитные группы на амины, спиртовую группу, карбонил и др. функции: методы введения, удаления, сравнительные достоинства и недостатки разных типов ЗГ.
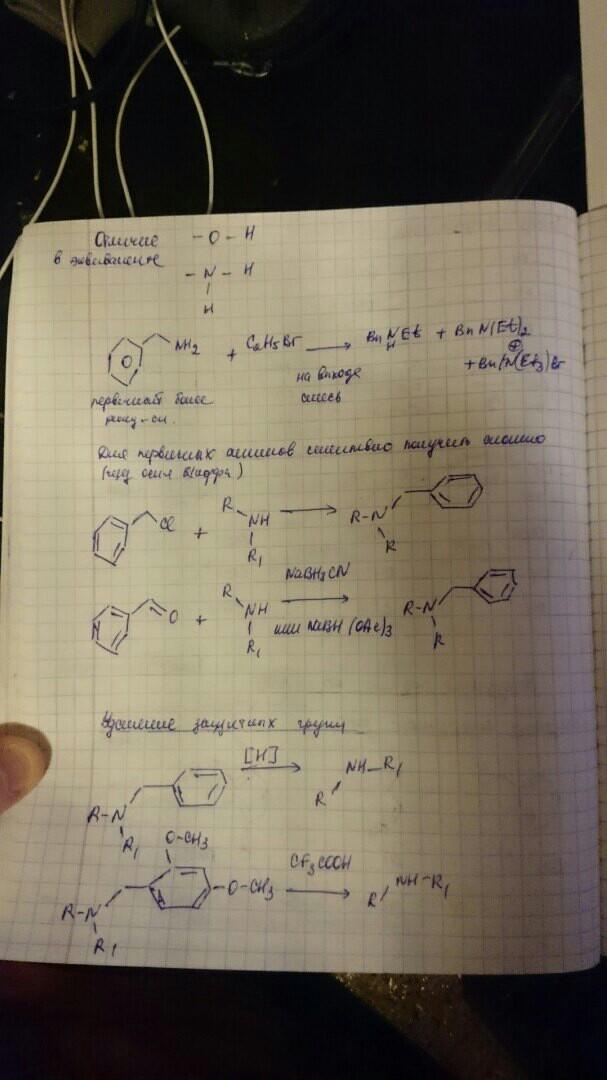
Защита спиртовой группы приведена выше. Защитные группы на амины.
ОН группу мы можем заместить только один раз, а аминогруппу три раза (тк два атома водорода и 2 электрона свободных у азота).
Т.о. если использовать алкильную защиту один раз, то получаем вторичный амин, а вторичный амин – более сильное основание, чем первичный амин и значит вступают в реакцию характерные для аминогрупп быстрее, чем первичный амин. Т.е. защиты алкильного типа могут защищать только вторичные амины. Поэтому защиты алкильного типа мало используются.
Способ введения аминной группы – реакция габриэля
Защиты амидного типа – более эффективная защита, прочный защитный эффект
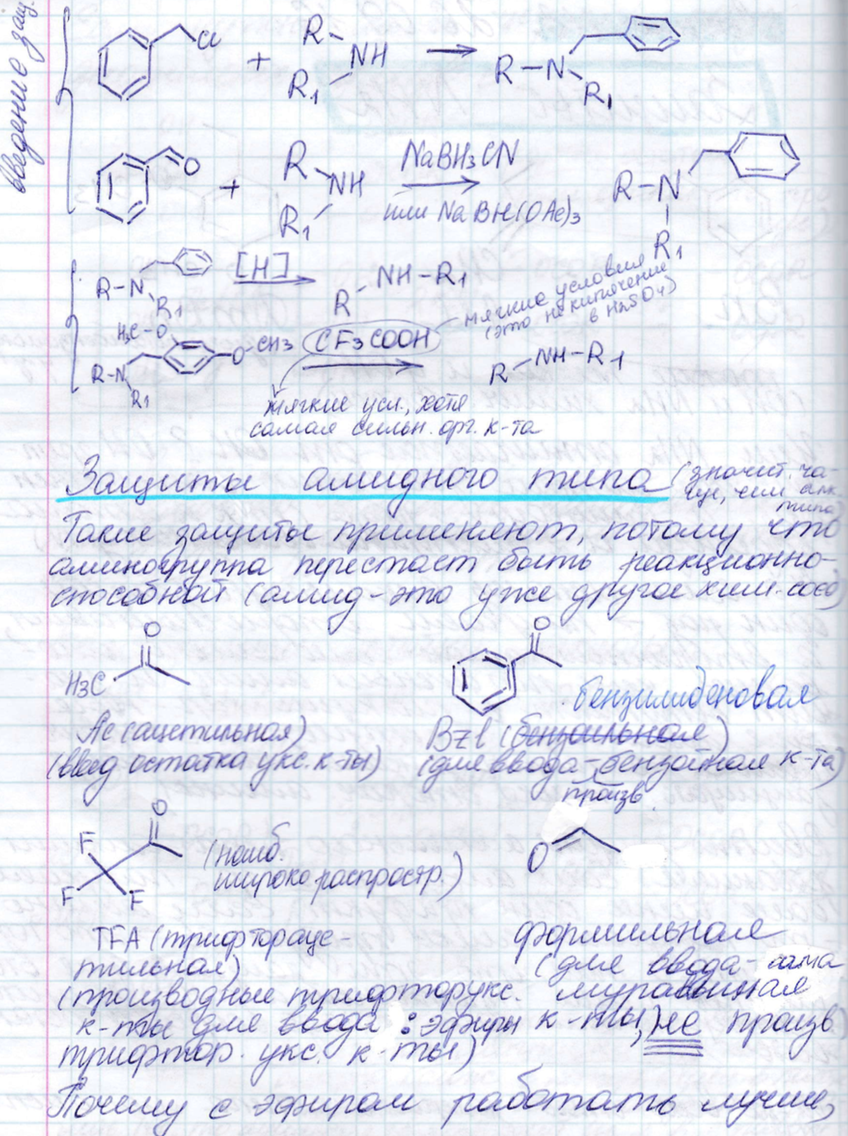


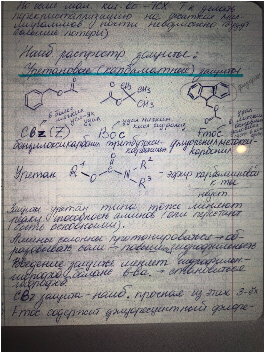

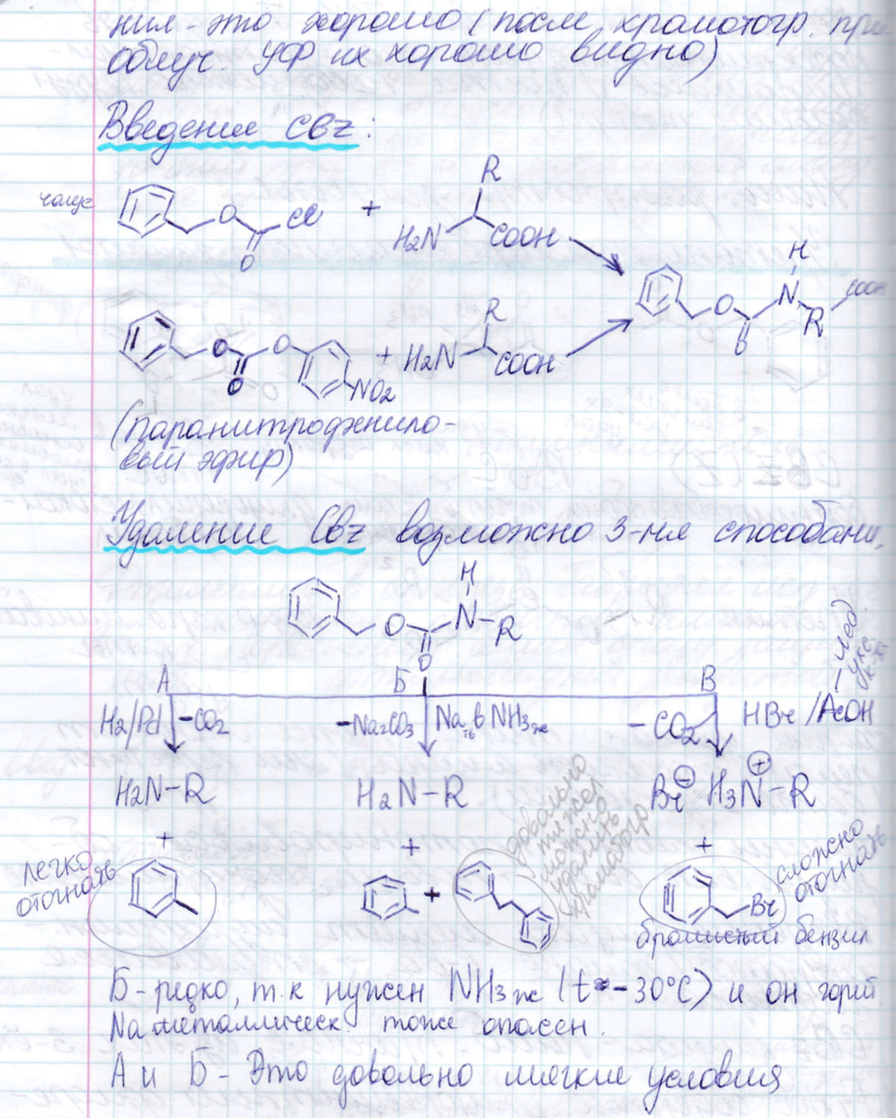
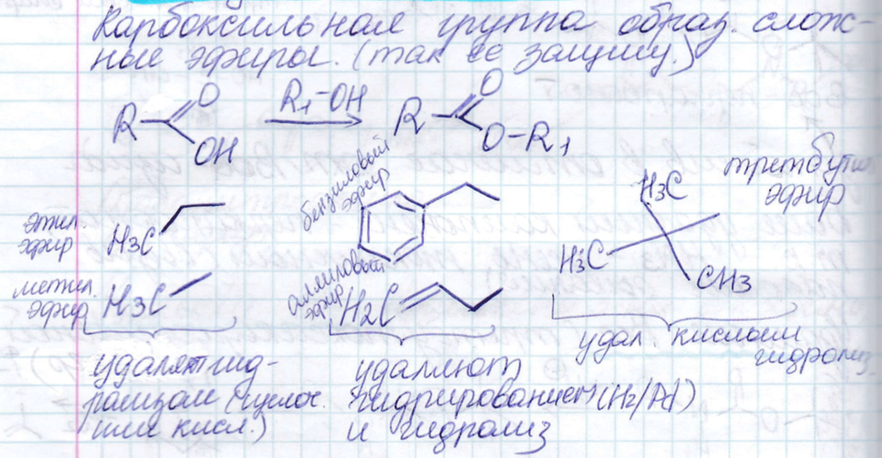
Защита карбоксила.
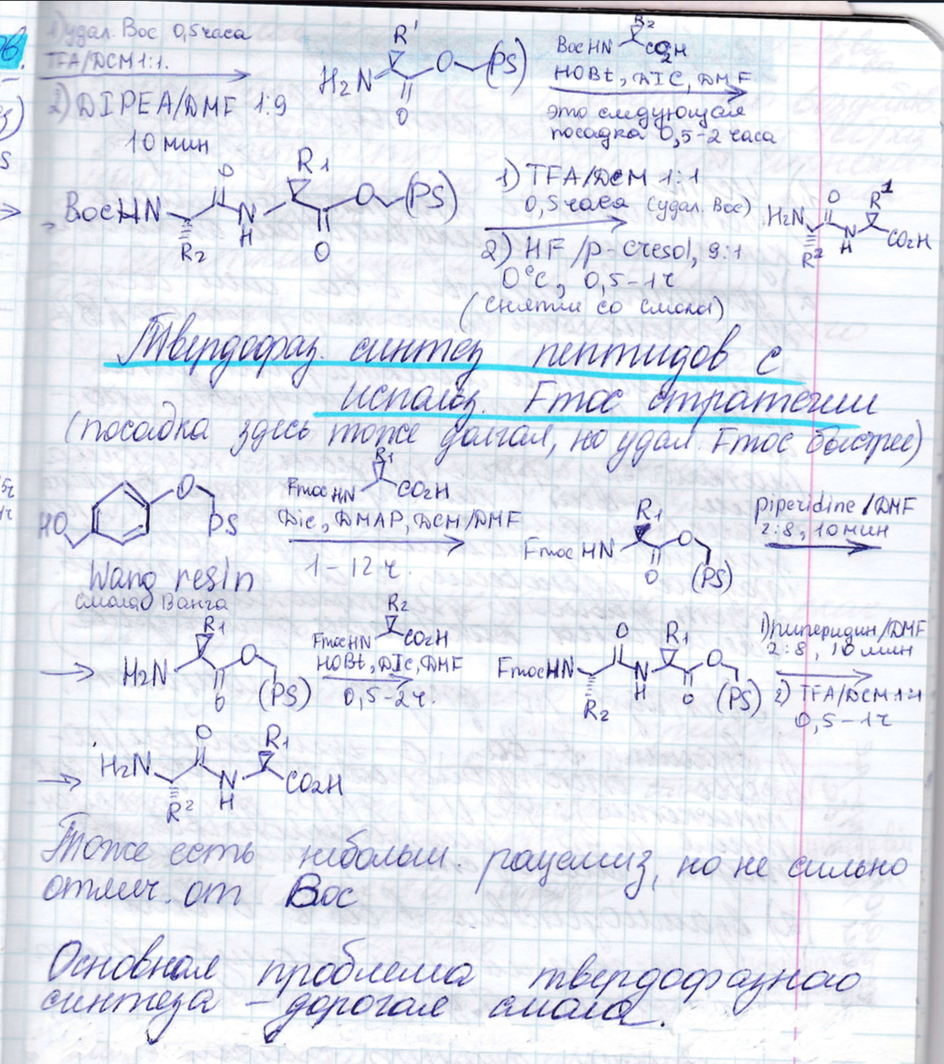
4. Синтез различных типов биополимеров: общие проблемы и подходы. Синтез пептидов: защитные группы, методы активации, рацемизация. Синтез олигонуклеотидов: защитные группы, методы образования фосфодиэфирной связи. Твердофазный синтез - принцип, преимущества, недостатки, области применения.
Проблемы пептидного синтеза:
А) должны синтезировать их из оптически активных исходных единиц
Б) должны обязательно сохранить в процессе синтеза оптическую активность
В процессе биосинтеза белка в любом случае получается оптически активный белок, тк с оптически неактивным реагентами рибосома работать не будет. В процессе химического синтеза пептид – полимер нерегулярной структуры.
Соблюдение последовательности вещества
Соблюдение конфигурации
Избегать условия рацемизации
https://vunivere.ru/work54024/page2 синтез дипептида
Синтез пептидов: защитные группы, методы активации, рацемизация.
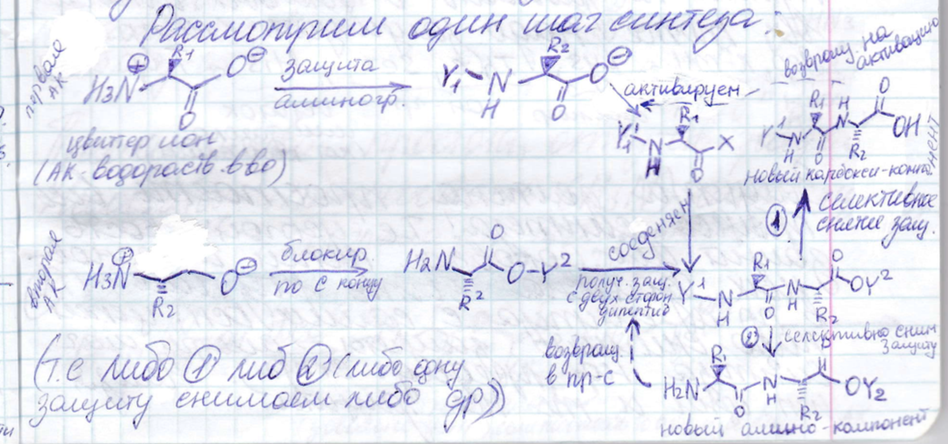
Все
эти процессы должны происходить без
рацемизации. Если поместим АК или пептид
в щелочные условия они довольно быстро
превратятся в рацемат. Возможны разные
стратегии пептидного синтеза. Как
правило это поэтапное наращивание.
Обязательно на каждом этапе высокий
выход. 
Подходы:

 метод
активированных эфиров
метод
активированных эфиров


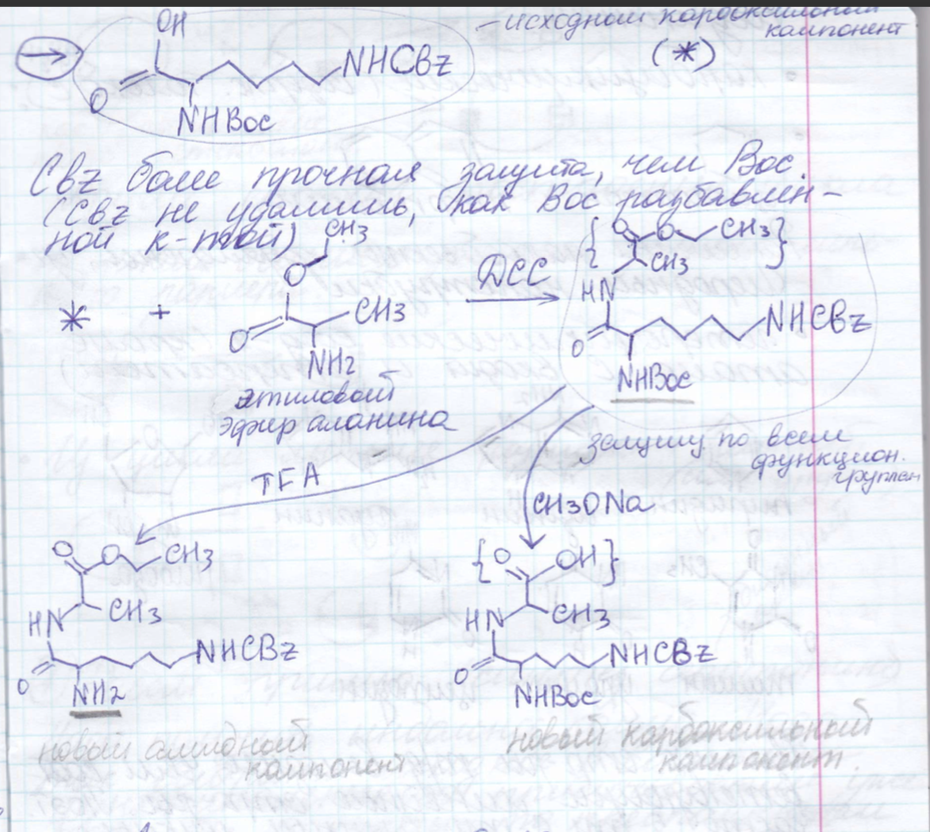
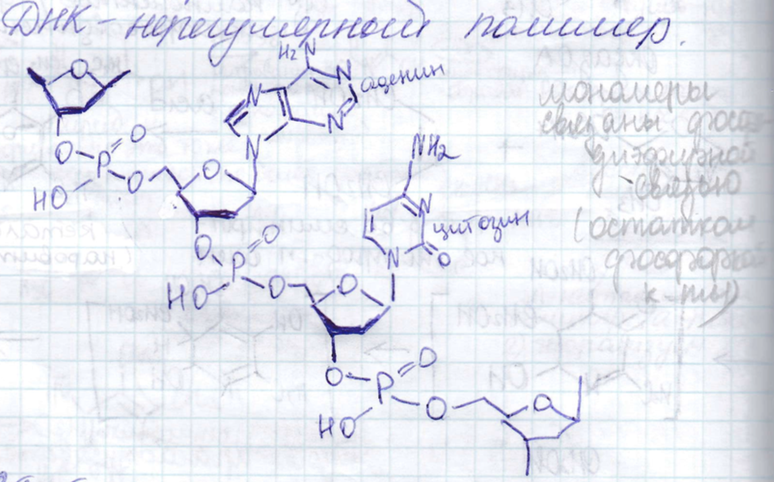
Синтез олигонуклеотидов: защитные группы, методы образования фосфодиэфирной связи. Твердофазный синтез - принцип, преимущества, недостатки, области применения.
ДНК
с точки зрения химии состоит из четырех
оснований, сахарного остатка и фосфатного
остатка. Проблема с синтезом ДНК – ее
длина.
Твердофазный синтез

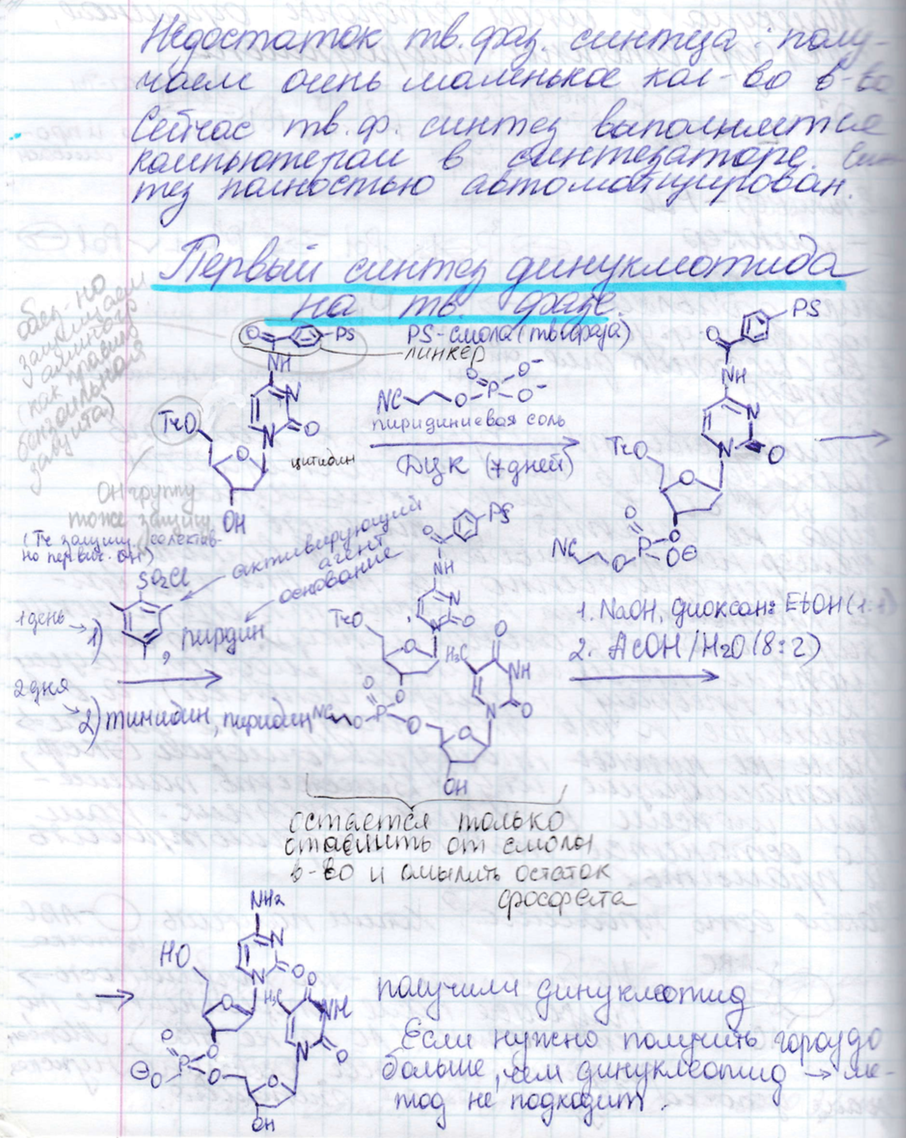
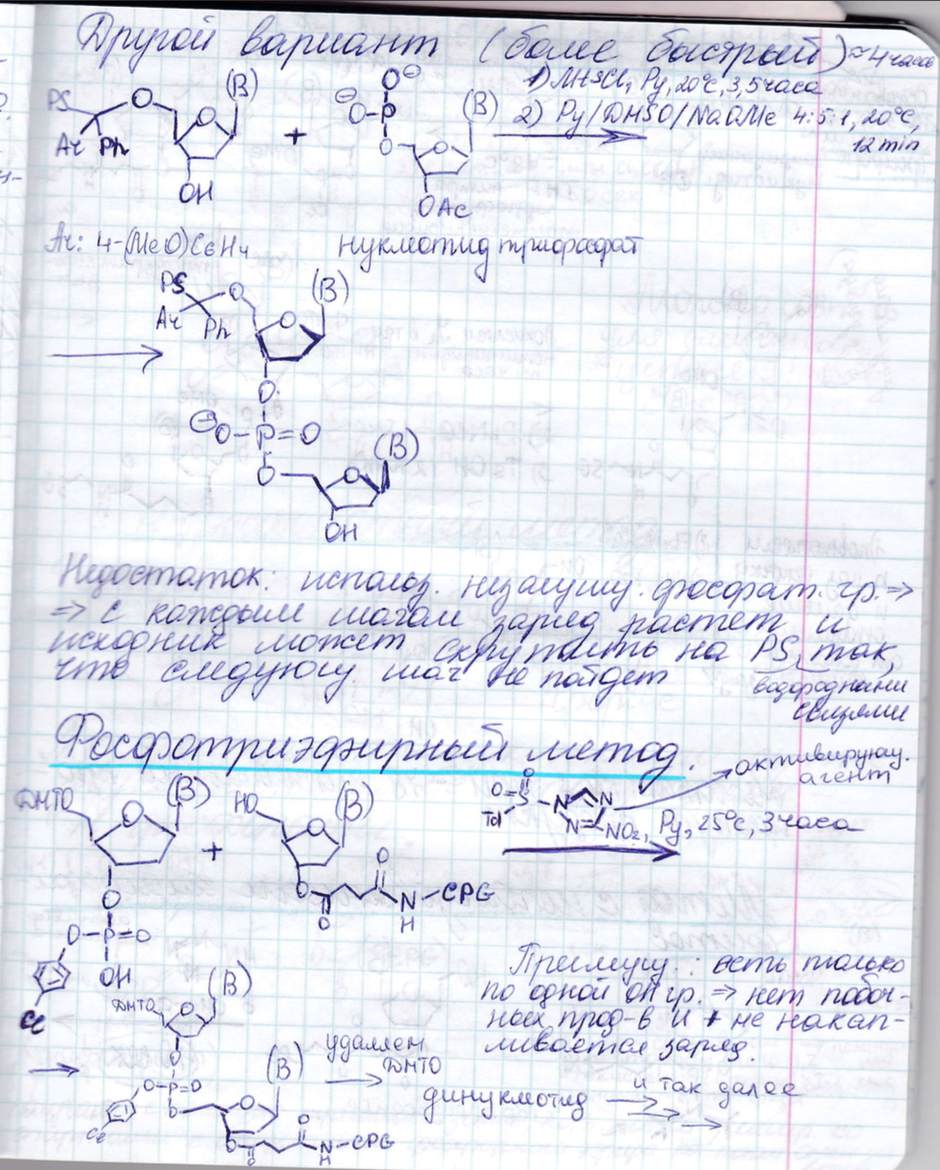
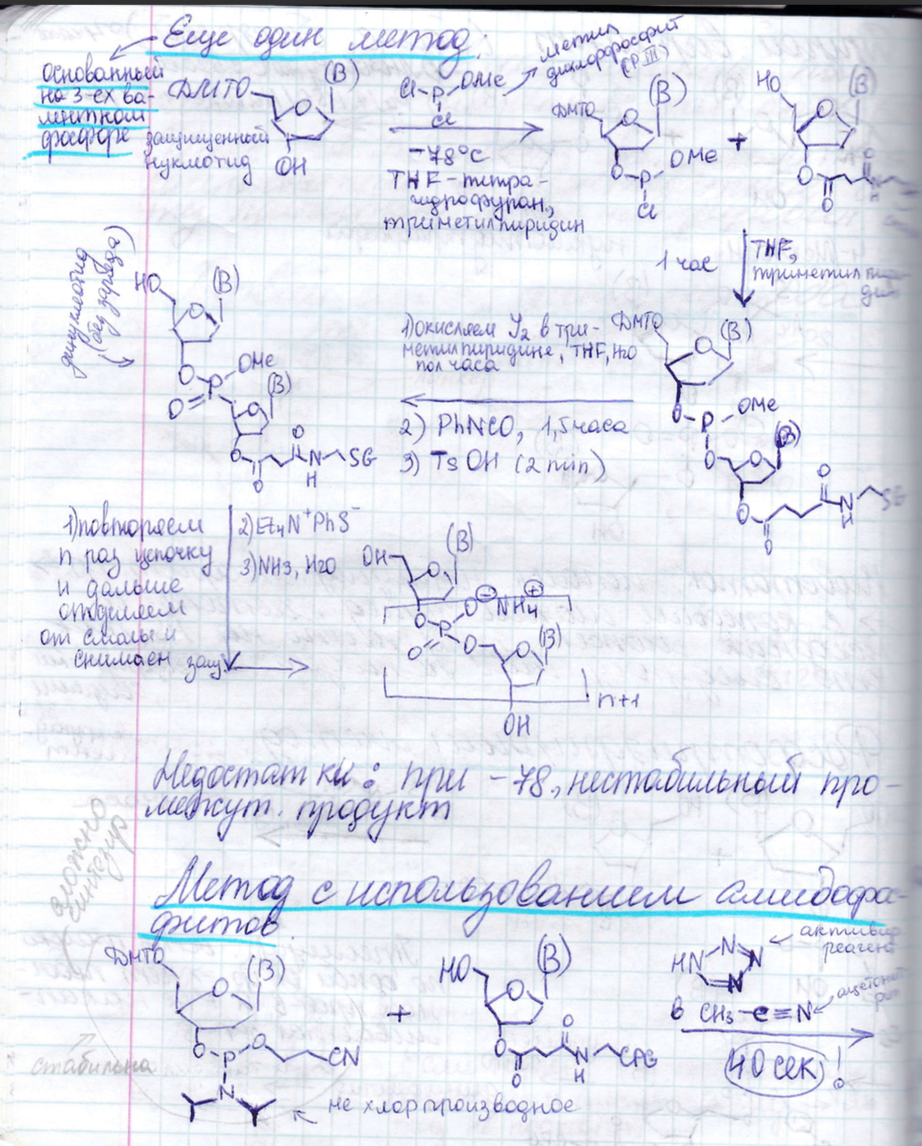
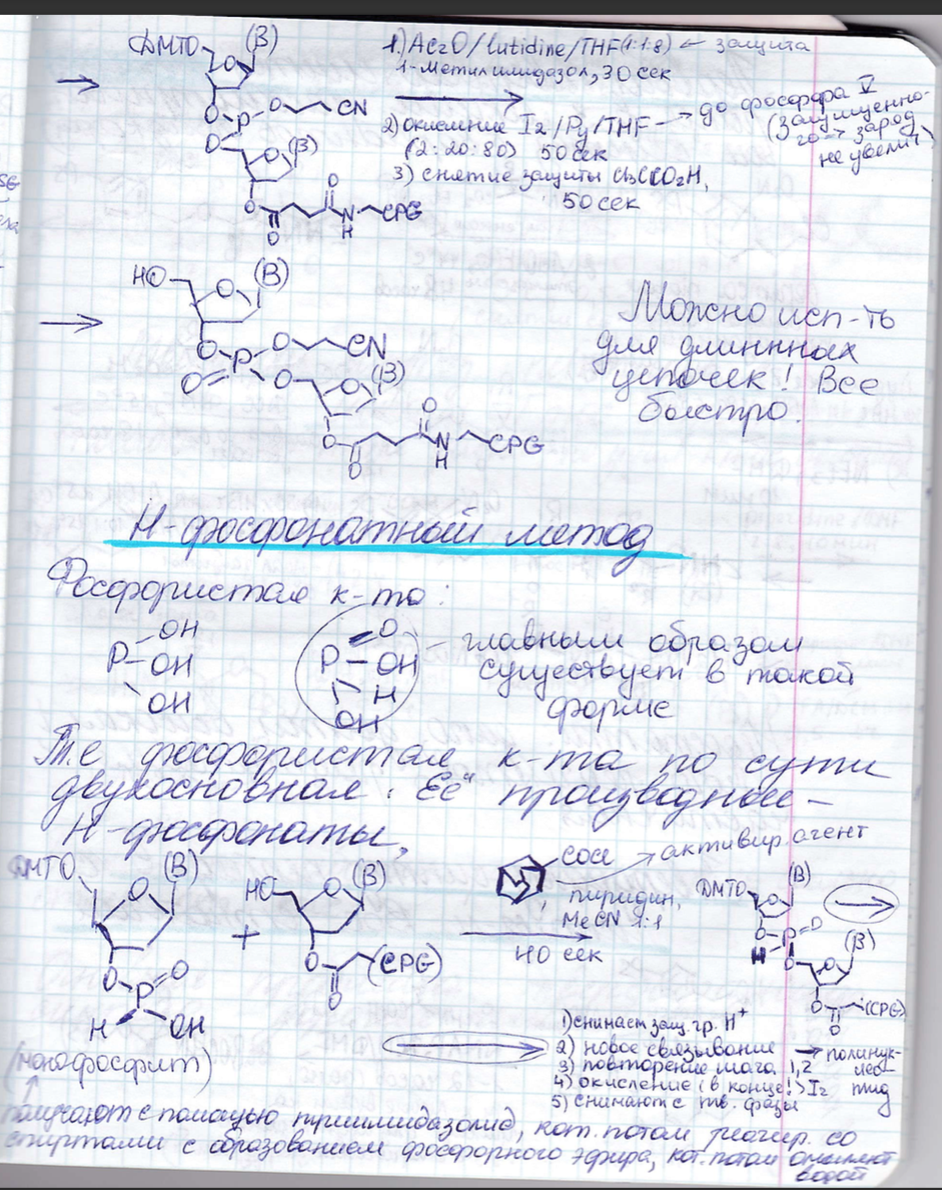

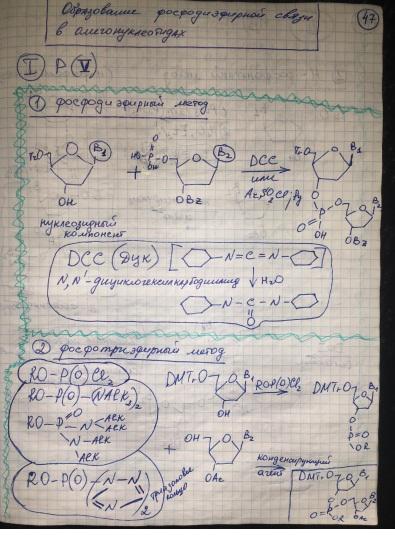
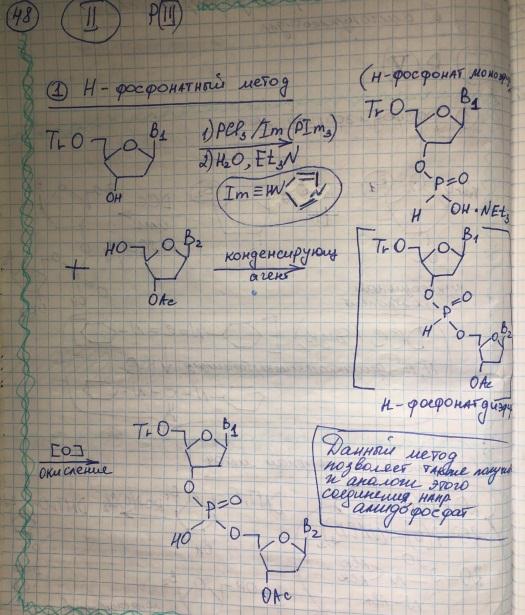
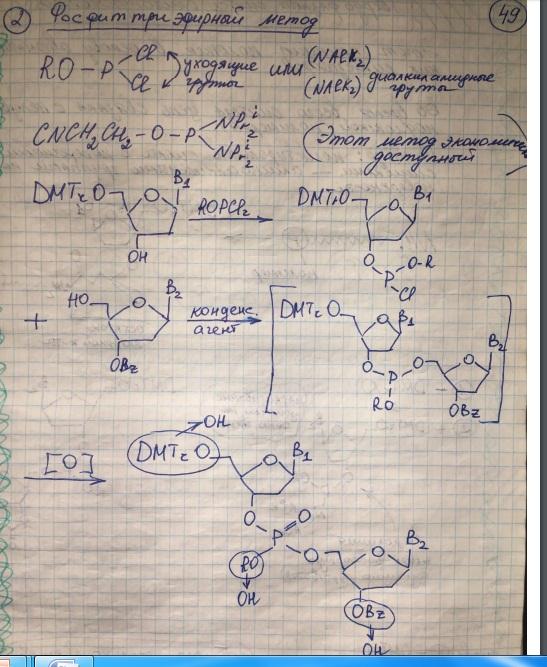
Методы образования фосфодиэфирной связи
5. Типы циклических соединений, теоретические пути циклизации, проблемы селективного синтеза циклов.
Различают два типа циклических соединений:
Карбоциклические (содержат только С)
 и
Гетероциклические
и
Гетероциклические
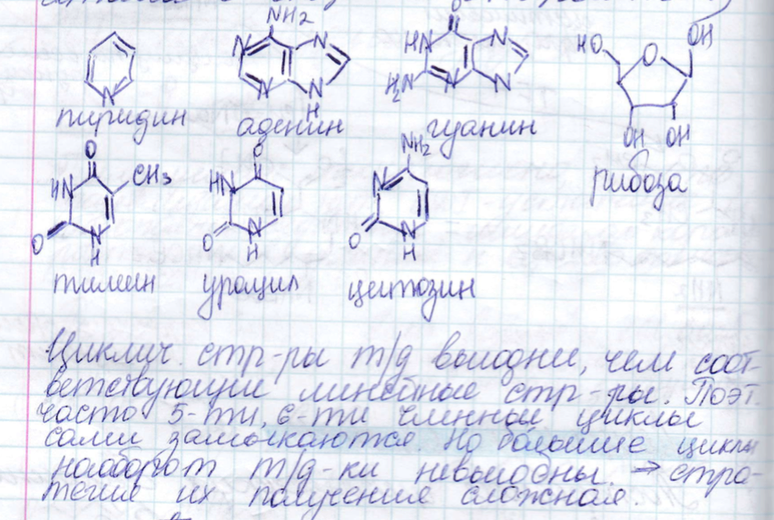
Типы циклизации:


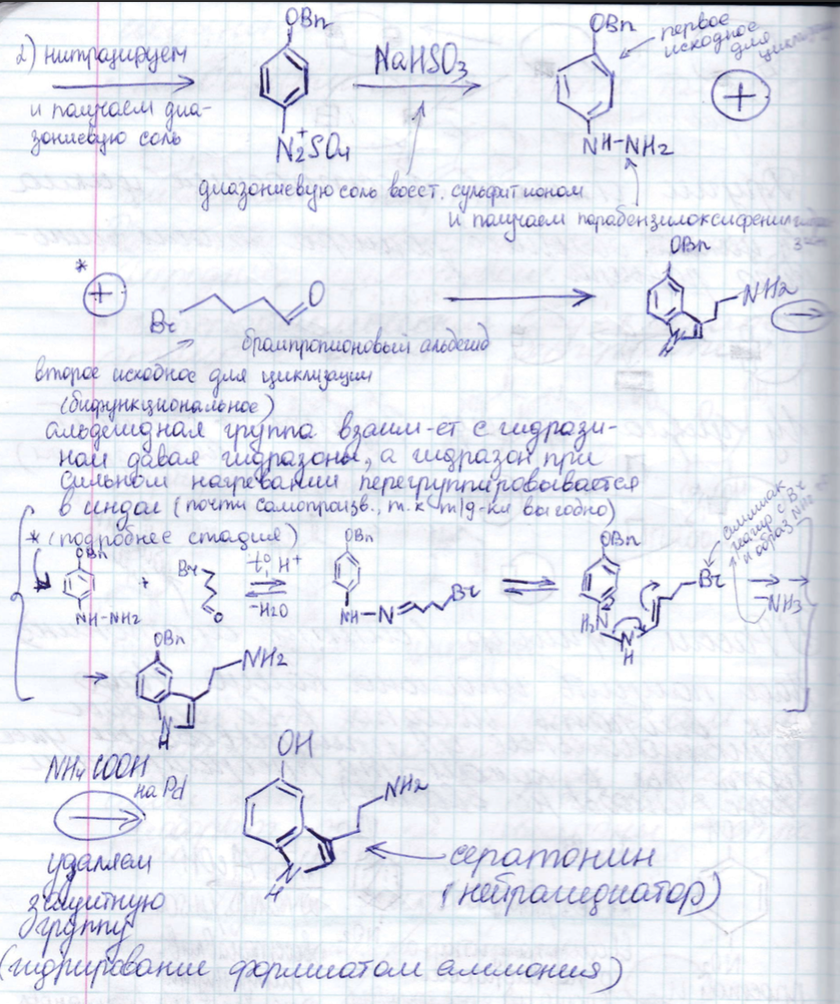
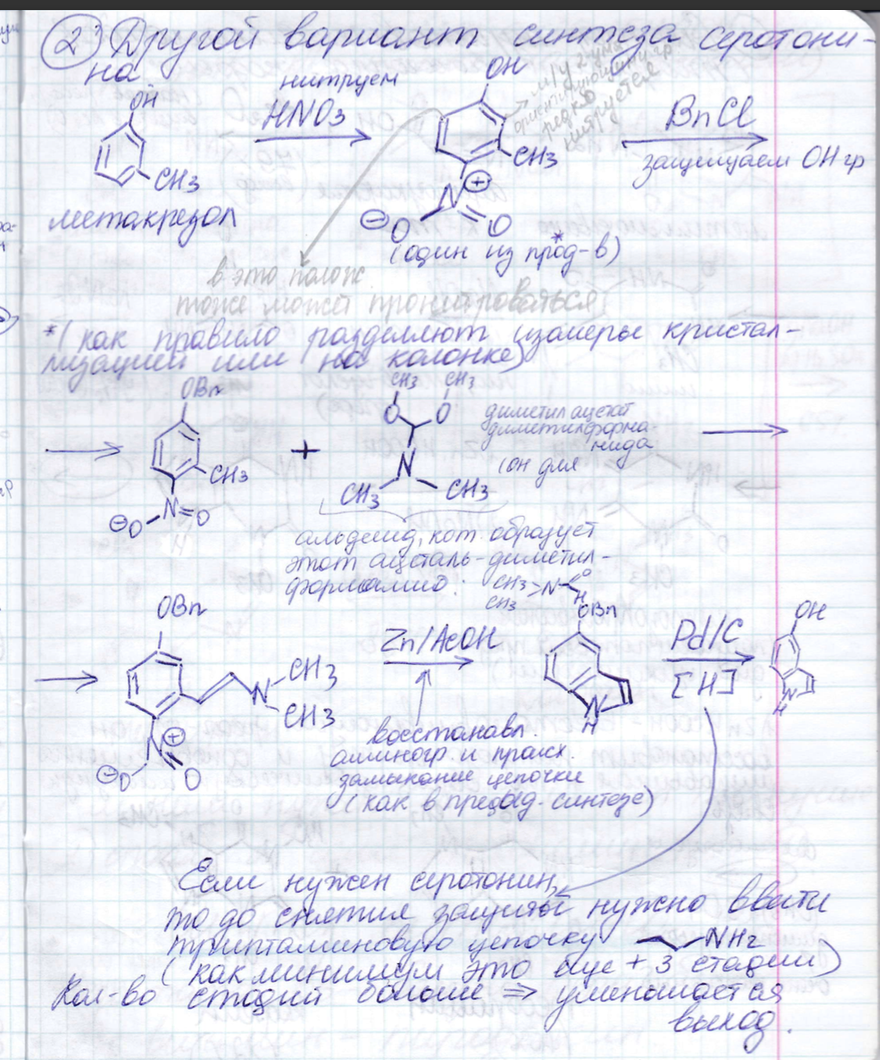

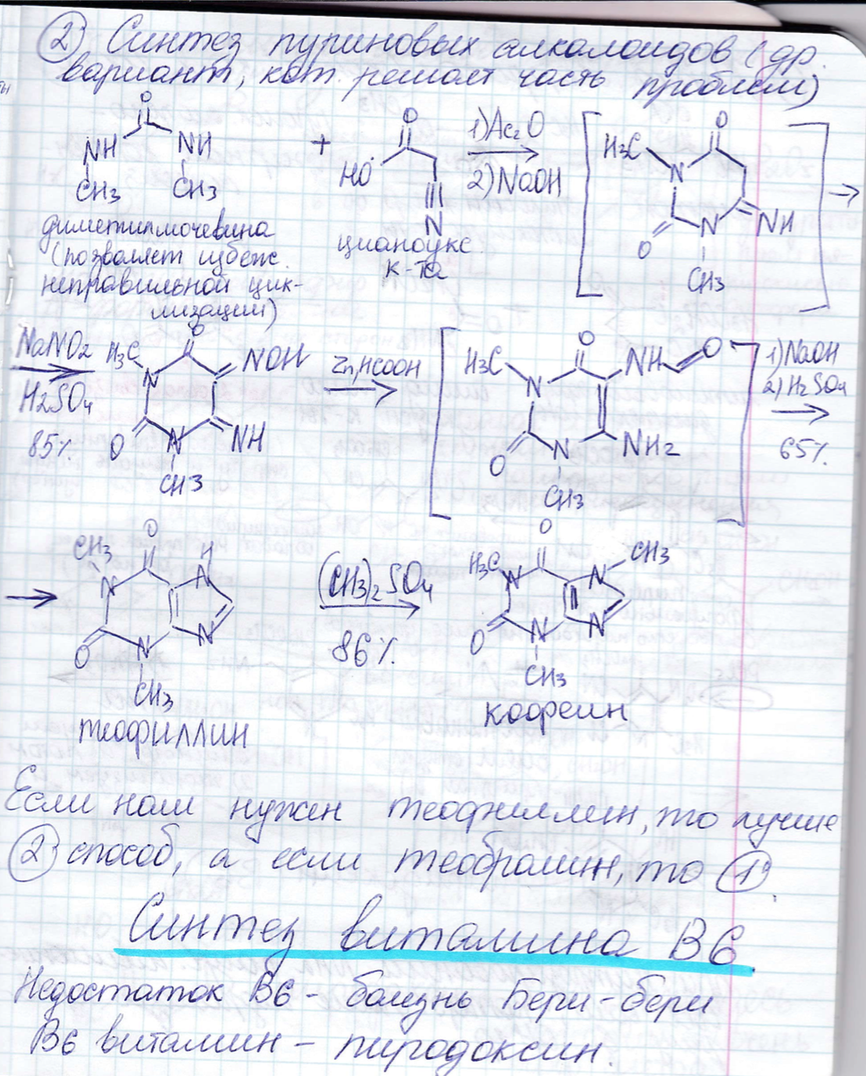
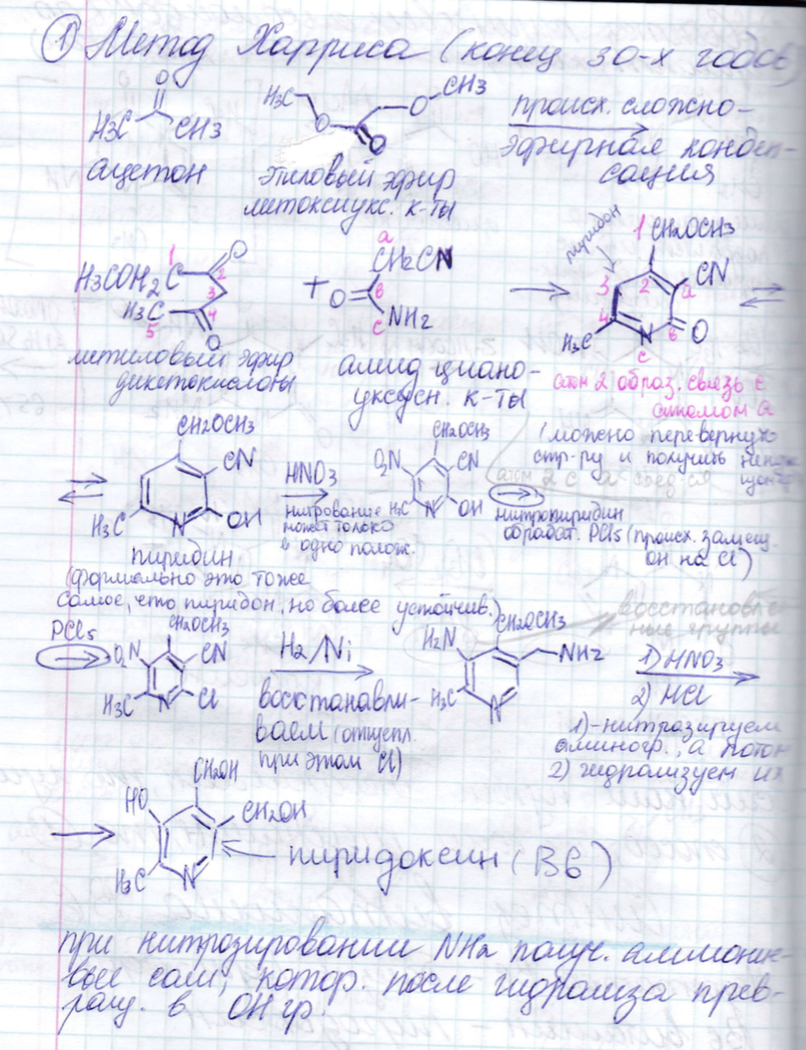

6. Физико-химические методы анализа в БТ: общая характеристика, области применения, возможности методов. Спектроскопия. Оптические методы исследования: УФ, ИК/КР, флуоресцентная спектроскопия. Блок-схема спектрометра, основные части, их функции и принципиальное устройство.

Физико-химические методы анализа основаны на измерении физических свойств веществ, которые появляются или изменяются в результате химических реакций. При этом сначала проводят реакцию, а затем измеряют физическое свойство продукта реакции или используют измерение физического свойства в ходе реакции.
Область применения: качественный и количественный анализ
Задачи физико-химических методов:
1) Установление структуры молекулы или молекулярного ансамбля
2) Установление чистоты вещества или состава смеси
3) Исследование молекулярной динамики и межмолекулярных процессов
Методы по физическим принципам:
-
Взаимодействие вещества с излучением/полем – спектральные методы (спектроскопия): УФ, ИК, ЯМР, флуоресценция, дифракционные методы
-
Взаимодействие вещества с веществом – химические методы анализа, элементный анализ, хроматография и т.д. (не дают данные по структуре вещества)
Задачи аналитического метода:
1) прямая задача: А = F(x), где А – наблюдаемый эффект, х – свойства вещества, прямая задача решается всегда
Берем образец вещества – подвергаем его воздействию и наблюдаем эффект (помещаем образец в спектрометр – подвергаем его монохроматическому излучению и наблюдаем поглощение излучения)
2) обратная задача: x = F’(А), когда из наблюдаемого эффекта узнаем свойства вещества
Условия решения обратной задачи:
-
Любому х должно соответствовать единственное значение А
-
Изменение х не должно быть скачкообразным
СПЕКТРОСКОПИЯ
Спектральный анализ–совокупность методов количественного и качественного определения состава веществ, основанных на исследовании спектров испускания, поглощения, люминесценции, отражения и рассеяния электромагнитного излучения.
Устройство спектрального аналитического прибора:
Аналоговый – волновой сигнал, т.е.
вызванный колебанием (получаем информацию
от частоты, амплитуды колебаний)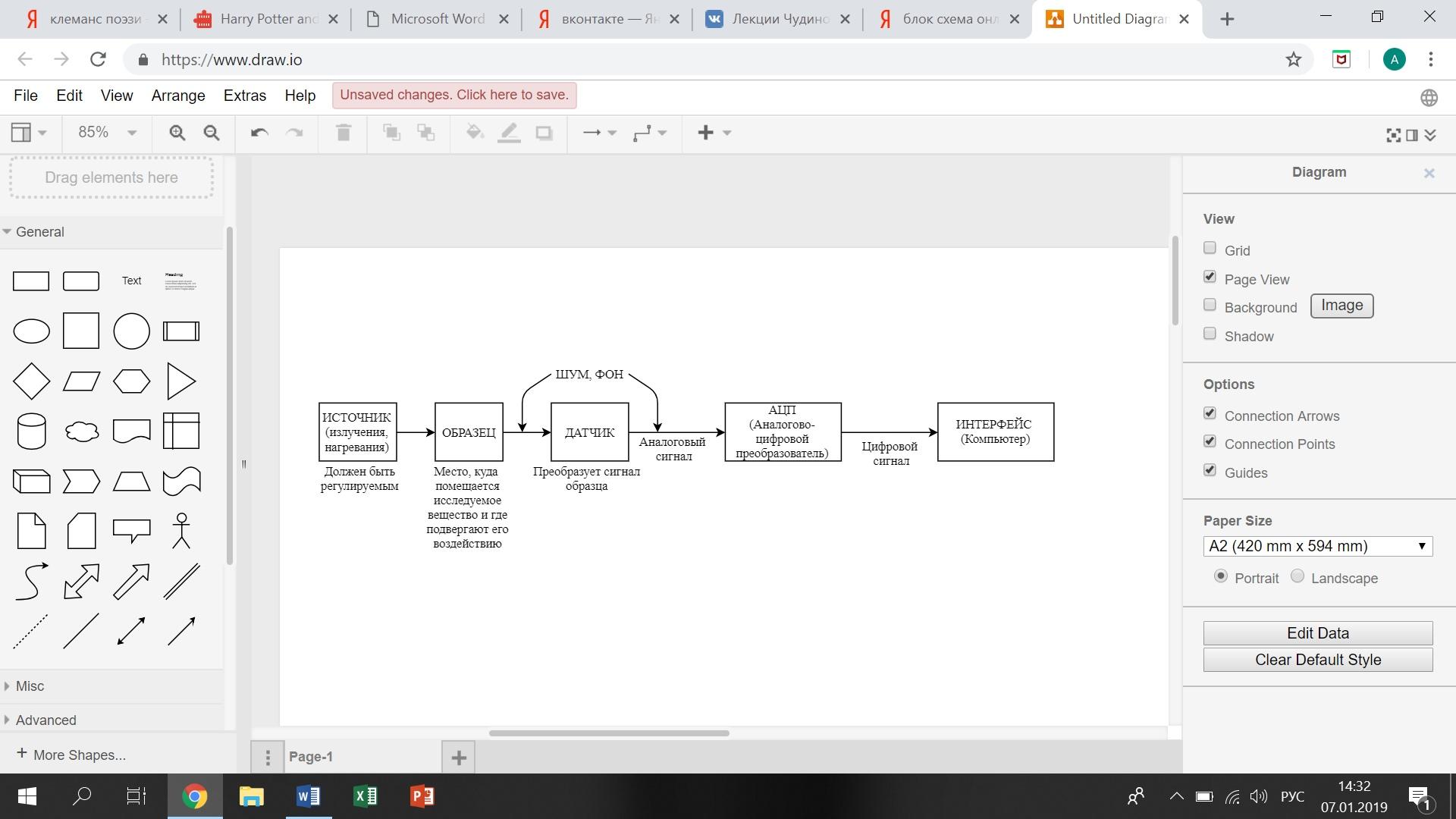
Цифровой – сигнал передает цифры – импульсная последовательность чисел; 1-есть импульс, 0-нет.
Высокая частота – шум
Низкая частота – фон, дрейф базовой линии
Промежуточная частота – полезная информация (пик)
Задачи обработки сигнала:
1) Увеличение отношения сигнал/шум (подбор оптимальных условий эксперимента)
2) Улучшение разрешения перекрывающихся пиков и устранение сигнала фона (разделить друг от друга наложенные пики)
3) Интегрирование сигналов для получения количественных данных (если интенсивность связана с какой-то характеристикой вещества, то мы хотим померить эту характеристику, для этого нам нужно проинтегрировать площадь под кривой и сопоставить количественно)
Оконная фильтрация – усреднение значений соседних точек (преобразование кривой в более «гладкий» вид)
Поглощение – преобразование энергии излучения в тепловую энергию вещества (если предмет прозрачный, то происходит пропускание)
До 10 нм – рентгеновское излучение – дифракция на атомной решетке (РСА)
10-1000 см – магнитный резонанс ядер атомов (ЯМР)
Рассеяние и дифракция элементарных частиц (электронов и нейтронов) – нейтронная дифракция, электронная спектроскопия
Разложение в спектр происходит из-за разного поглощения монохроматического излучения (т.е. одного цвета)
Спектр – зависимость интенсивности поглощения (пропускания или оптической плотности) от длины волны или волнового числа, падающего на образец света, выраженную в числовом или графическом виде
Энергия кванта света определяется уравнением Планка:
с
– скорость света (см/с);
ν (1) – частота;
λ – длина волны (см);
ν (2) – волновое число (см-1);
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ
(В видимом диапазоне длин волн (+УФ, ИК))
1) Электронная (УФ) спектроскопия
2) ИК-спектроскопия
3) Спектроскопия комбинационного рассеяния
4) Флуоресцентная спектроскопия
1:
σ*
разрыхляющая
π*
разрыхляющая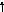

nнесвязывающая
πсвязывающая
σсвязывающая
Возможны 4 типа переходов: - σ-σ* (10-200нм: вакуумный УФ, т.к. воздух поглощает)
- π-π* (189 нм: УФ и видимый свет)
- n-σ*
- n-π* (279 нм: УФ и видимый свет)

УСТРОЙСТВО источника УФ- спектрометра
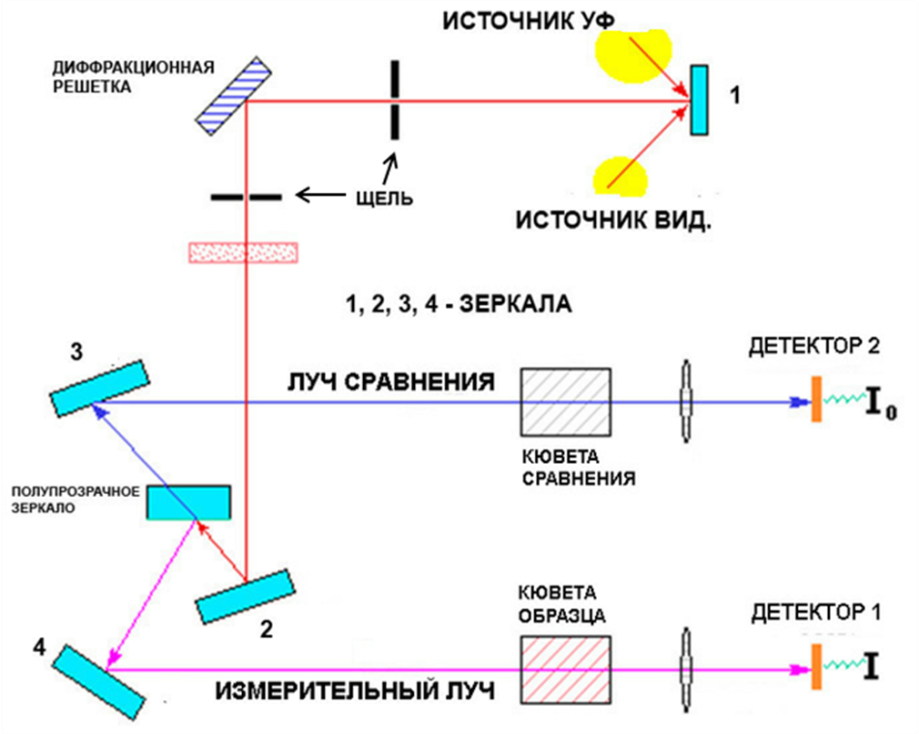
Спектрометры для получения УФ-спектров имеют следующее устройство. В качестве источника УФ-излучения обычно применяется водородная лампа (электрическая дуга в атмосфере водорода при низком давлении), которая дает практически непрерывный спектр излучения в области 190-360 нм. Для работы в видимой области служит лампа накаливания с вольфрамовой спиралью. Излучение от источника попадает в монохроматор, состоящий из зеркала, кварцевой призмы и щели. Отражаясь от зеркала, свет разлагается призмой и затем с помощью щели из спектра выделяется узкая область. При вращении призмы спектр перемещается по отношению к щели, что позволяет получать лучи света со строго определенной длиной волны, обычно с точностью ±0,5 нм. Монохроматическое излучение пропускается через кварцевую кювету, содержащую раствор исследуемого вещества в прозрачном для УФ-области растворителе. Толщина кювет 1-10 см, наиболее распространенные кюветы имеют сечение 1x1 см, и для их заполнения требуется около 3 мл раствора. Интенсивность прошедшего через кювету света измеряется с помощью фотоэлемента, величина тока которого пропорциональна интенсивности падающего света. Ток усиливается и регистрируется потенциометром. Сравнивается интенсивность светового луча, прошедшего через исследуемый раствор, и луча, пропущенного через аналогичную кювету с чистым растворителем. Получаемая разность соответствует поглощению растворенного исследуемого вещества. В современных регистрирующих приборах световой поток делится на два одинаковых пучка, один из которых проходит через исследуемый раствор, а другой — через растворитель, причем как сравнение интенсивностей прошедших через кюветы световых потоков, так и непрерывное изменение длин волн производится автоматически. В том и другом случае получают УФ-спектр вещества, представляющий собой зависимость оптической плотности раствора D (или е) от длины волны поглощаемого света. В точках максимума мольный коэффициент поглощения вычисляют по уравнению:

УФ ПОДХОДИТ для исследования ферментативных процессов!!
Аминокислоты, пептиды, белки – максимум поглощения 280 нм (триптофан, тирозин), НК – 260 нм (тимин/аденин)
УФ:
ОПРЕДЕЛЕНИЕ В СОСТАВЕ ОБРАЗЦА ОПРЕДЕЛЕННЫХ ГРУПП
ДЛЯ ИЗУЧЕНИЯ СТРУКТУРЫ НЕИЗВЕСТНЫХ ВЕЩЕСТВ УФ СПЕКТРОСКОПИЯ НЕ ПОДХОДИТ!
УФ идеально подходит для количественного анализа (чувствительный метод)
Используют дейтериевые лампы, кварцевые кюветы (стекло поглощает)
Прохождение света через вещество подчиняется закону Бугера-Ламберта-Бера
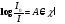
A – оптическая плотность,
ℓ – толщина образца,
С – концентрация,
c - коэффициент пропорциональности (коэффициент экстинкции или показатель поглощения).
Поглощение света происходит за время порядка 10-15 с, что соответствует периоду колебаний световой волны. В течение этого времени заметно не изменяются ни положение, ни импульсы тяжёлых ядер и их относительное движение до акта поглощения света и сразу же после него одинаковы (правило Франка-Кондона).
Молекула, попавшая на верхние колебательные уровни любого возбуждённого состояния, быстро теряет избыток колебательной энергии при столкновениях с окружающими молекулами. Это процесс колебательной релаксации. Безызлучательный переход между электронными состояниями одинаковой мультиплетности называется внутренней конверсией, аналогичный переход между состояниями разной мультиплетности – интеркомбинационной конверсией.
200-700
нм рабочий диапазон, связан с переходами.
Каждый переход имеет линию – энергию.
(кванту вырезается полоска)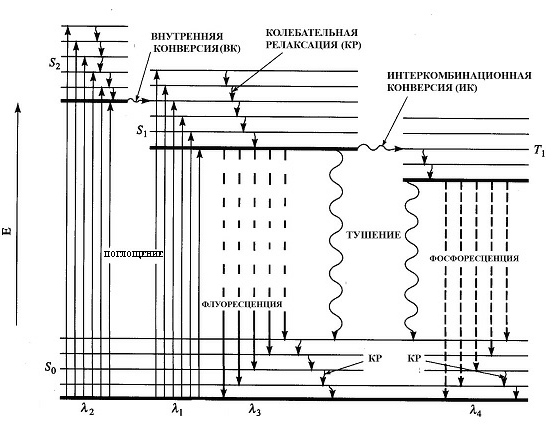
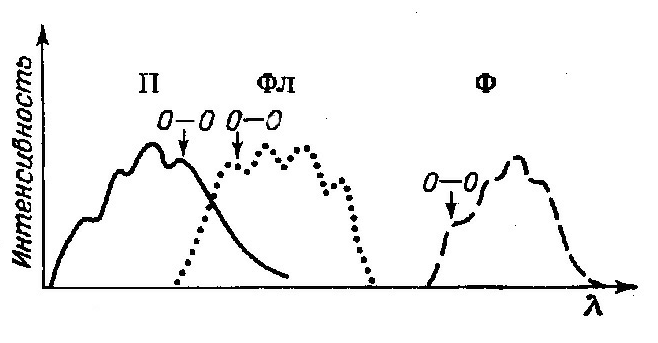
Помимо безызлучательного перехода молекула может попасть в основное состояние S0 , испустив квант. Если квант был испущен с синглетного возбуждённого состояния, то такой тип люминесценции называется флуоресценцией. Длительность флуоресценции составляет 10-8 – 10-10 сек.
Оcновными параметрами флуоресценции являются её спектры, выход, длительность и поляризация.
Квантовый выход флуоресценции F= (If )/( Io – If)
Возможен и другой путь излучательной релаксации возбуждённого синглетного состояния. Возбуждённая молекула может безызлучательным путём перейти в триплетный возбуждённый уровень с изменением спина.
Это так называемое метастабильное состояние. Перейдя на триплетный уровень, молекула может находится на нём примерно 10-3 – 10 сек, что значительно больше длительности синглетного возбуждённого состояния.
Тушением флуоресценции называют любые процессы, которые уменьшают интенсивность флуоресценции данного вещества. К тушению может проводить множество процессов, в том числе реакции в возбужденном состоянии, перенос энергии, образование комплексов и тушение при столкновениях.
Флуоресценция хинина, хлорофилла
Свечение, испускаемое при переходе молекулы с триплетного в основное синглетное состояние называется фосфоресценцией .
Если в молекуле нет двойных связей, то она будет прозрачна в УФ диапазоне.
Чем более сопряженная система, тем интенсивнее поглощение, тем более красное/черное вещество.
Прохождение света через вещество подчиняется закону Бугера-Ламберта-Бера

Хромофор– ковалентно ненасыщенная группа, обуславливающая поглощение в видимой или УФ областях спектра (С=С, С=О, фенил, NO2)
Ауксохром – насыщенная группа, присоединение которой к хромофору изменяет как длину волны, так и интенсивность максимума поглощения (ОН, NН2, Сl)
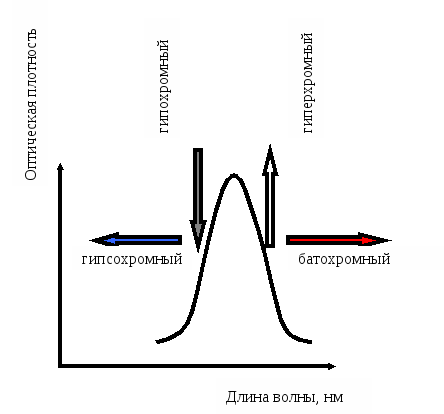
Батохромный сдвиг – сдвиг поглощения в сторону более длинных волн вследствие замещения или влияния растворителя (красный сдвиг)
Гипсохромный сдвиг – сдвиг поглощения в сторону более коротких волн вследствие замещения или влияния растворителя (синий сдвиг)
Гиперхромный эффект – увеличение интенсивности поглощения
Гипохромный эффект – уменьшение интенсивности поглощения
2, 3:колебательная спектроскопия.
К колебательной спектроскопии относятся инфракрасная (ИК) спектроскопия и спектроскопия комбинационного рассеяния (КР)
ИК спектроскопия основана на поглощении энергии излучения, мы меряем поглощение
КР (комбинационного рассеяния) спектроскопия основана на рассеянии излучения, мы измеряем рассеяние света веществом
ИК-спектры (как и спектры в УФ/вид. области) получают в режиме поглощения, КР-спектроскопия основана на рассеянии излучения
Отличие в УФ – в качестве опт. Материала – кварц, стекло
ИК – материал из солей щелочных материалов
ИК – зависимость интенсивности от частоты
ИК спектр может оценить меру водородных связей
Колебательная спектроскопия позволяет получать информацию о функциональных группах в молекуле - их наличии, взаимодействии и ориентации. но ИК НЕ ДАЕТ ДАННЫХ О ТОМ, КАК ЭТИ ГРУППЫ СВЯЗАНЫ МЕЖДУ СОБОЙ.
Диапазоны:
1) видимая; длина волны: 0,4-0,8 мкм; волновое число: 25000-12500 см-1
2)ближняя ИК; длина волны: 0,8-2,5 мкм; волновое число: 12500-4000 см-1
3)средняя ИК; длина волны: 2,5-25 мкм; волновое число: 4000-400 см-1
4) дальняя ИК; длина волны: 25-100 мкм; волновое число: 400-10 см-1
Молекула в результате взаимодействия с фотоном монохроматического излучения сначала возбуждается до неустойчивого (виртуального) состояния. Затем она может отдавать этот фотон, не обмениваясь с ним энергией, т.е. возвращаться в исходное состояние. Это – релеевское рассеяние света. Однако фотон может передать часть энергии молекуле, молекула переходит на более высокий уровень – стоксовое КР. Если молекула была в возбужденном состоянии, то она может передать часть энергии фотону, следовательно, она перейдет на более низкий уровень – антистоксовое КР.
КР – низкоэнергетический процесс.
ПРАВИЛА:
1) Чтобы молекула поглощала энергию ИК излучения, при колебаниях молекулы должен меняться дипольный момент (чем больше полярность связей, тем больше интенсивность полос в спектре)
2) Чтобы колебание было активным в КР спектрометрии, при молекулярных колебаниях должна меняться поляризуемость (чем меньше полярность связи и больше ее поляризуемость, тем более интенсивный КР спектр)
Валентное колебание – ритмичное движение вдоль оси связи, при котором межатомное расстояние увеличивается или уменьшается (меняется длина связи)
Деформационное колебание – изменение угла, образованного связями около общего атома
Такие группы, как CH3, C=O, O-H, NH2, C=C, поглощают почти при постоянных длинах волн независимо от молекулы, следовательно на спектре появляются групповые (характеристические) полосы поглощения.
Кюветы – солевые пластинки (монокристаллы), следовательно, растворители – хлороформ, четыреххлористый углерод (не вода и спирт), источник излучения –раскаленная спираль.
4:флуоресцентная спектроскопия – высокая чувствительность, возможность анализировать низкие концентрации, используется дл определения конформации белка.
Колебательная релаксация – молекула быстро теряет избыток колебательной энергии
Внутренняя конверсия – безызлучательный переход между электронными состояниями одинаковой мультиплетности
Интеркомбинационная конверсия - безызлучательный переход между состояниями разной мультиплетности
Если квант был
испущен с синглетного возбужденного
состояния, то такой тип люминесценции
называется флуоресценцией
(10-8
– 10-10
сек): S1
S0,
T1
T0

Фосфоресценция
– переход
молекулы с триплетного в основное
синглетное состояние: T1
S0,
S1
T0

Тушение флуоресценции – любые процессы, которые уменьшают интенсивность флуоресценции данного вещества (перенос энергии, реакции в возбужденном состоянии, образование комплексов, тушение при столкновении)

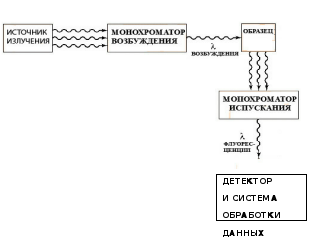
Монохроматор испускания
Монохроматор возбуждения
Образец
Детектор и обработка данных
Источник излучения





λ возбуждения λ флуоресценции
Квантовый выход флуоресценции: Ф = (I0 – I1)/If
Монохроматор — спектральный оптико-механический прибор, предназначенный для выделения монохроматического излучения. Принцип работы основан на дисперсии света.
7. Масс-спектрометрия. Принципы, устройство масс-спектрометра, методы ионизации, различные способы разделения ионов. Интерпретация масс-спектров.
Масс-спектрометрия – это способ изучения веществ, вычислением массы и числа ионов при ионизации вещества (основан на ионизации атомов и молекул вещества с последующим разделением образующихся ионов в соответствии с их массовым числом m/z – отношением массы иона к его заряду – в электрическом или магнитном поле)
Аналитические способности метода:
-
Определение массы ядер и атомов и оценка распространенности изотопов в природе
-
По отношению масс изотопов материнского и дочернего излучений определить возраст горных пород, археологических объектов
Метод применяют для:
-
Элементного анализа твердых неорганических веществ и материалов
-
Идентификации и установления структуры органических соединений, включая определение молярной массы
-
Исследования состава и структуры поверхностей твердых тел
-
Изотопного анализа и разделения изотопов
-
Химического анализа смесей
На масс-спектре по оси абсцисс откладывается отношение m/z, а по оси ординат – интенсивность, характеризующая относительное количество ионов данного вида (Пишут m/z, но принято считать, что это масса, так как рассматриваем только однозарядные ионы. Если у иона заряд больше 1, то они не попадают в детектор (но это не всегда так))
В спектре молекулярный ион располагается справа (крайний), так как его масса самая большая (если есть какие-то пики правее его, то либо есть более тяжелые примеси, либо в процессе фрагментации образовались ионы большей массы, либо неправильно определена масса)
Интенсивность выражается в % по отношению к полному ионному току (суммарная интенсивность всех ионов в масс-спектре) или по отношению к максимальной интенсивности ионного тока в масс-спектре.
Молекула, сталкивающаяся с электроном:
М + е = М+ + 2е = М1+ + М2
Молекулярный ион (не очень стабильный, поэтому происходит дальнейшая фрагментация)
Некоторые вещества очень неустойчивые, поэтому не образуют молекулярные ионы, а сразу распадаются на фрагменты
«+» МС: для анализа достаточно нанограммов вещества, высокая чувствительность, универсальность, высокая специфичность и селективность
«–» МС: анализируется не само вещество, а продукт его деструкции (обратно превратить этот продукт в наше вещество невозможно), высокая чувствительность забивает картину примесями, нельзя определить структуру вещества
Закономерности фрагментации:
-
Правило Стивенсона-Одъе (фрагмент с большей энергией ионизации имеет большую склонность к удержанию неспаренного электрона, следовательно, вероятность образования иона с меньшей энергией ионизации будет больше)
-
«Четно-электронное» правило
А-Б+. = А+ + Б.
А-Б+= А+ + Б0
А-Б+. = А+. + Б0
А-Б+≠ А+. + Б.
Анализ по масс-спектрам:
-
Определение молярной массы (источник информации – положение молекулярного пика М+ или его производных (М+1)+ и (М-1)+)
-
Определение брутто-формулы– используют соотношение интенсивностей пиково изотопов элементов или HRMS (число атомов С в молекуле определяют по интенсивности пика иона с массой (М+1)+ - он имеет такую же массу, но он содержит атомы 13С)
Разрешение
масс-спектрометра:
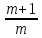 ,
если возможно отличить массы 10000 и 10001,
то высокое разрешение, если 100 и 101 –
низкое разрешение.
,
если возможно отличить массы 10000 и 10001,
то высокое разрешение, если 100 и 101 –
низкое разрешение.
Пример –
фрагментация метанола: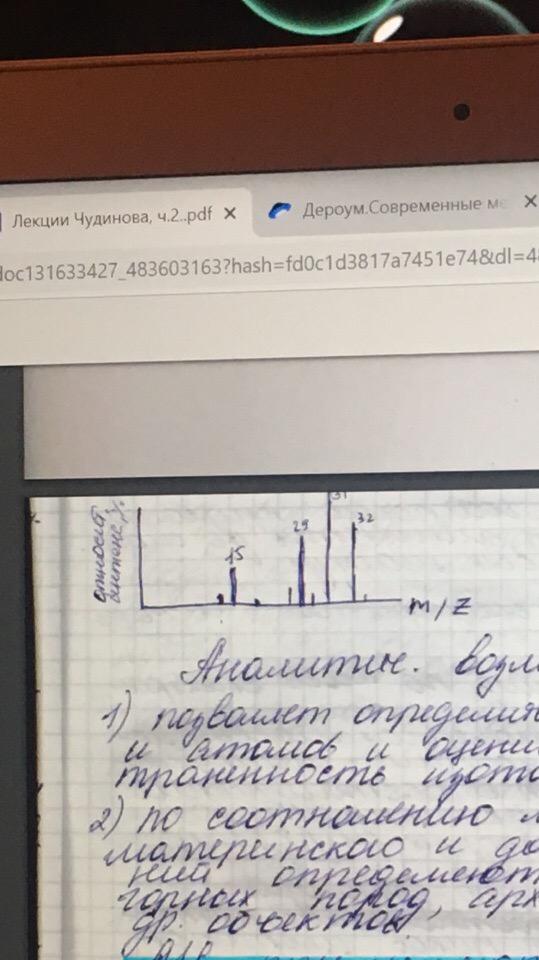
-
CH3OH + e = CH3OH+. + 2e 32 а.е.
-
CH3OH+. = CH2OH+ + H. 31а.е.
-
CH2OH+ = CHO++ H2 29а.е.
-
CH3OH+.= CH3+ + OH. 15а.е.
Масс-спектрометр – вакуумный прибор (для исключения соударений с другими ионами и молекулами вакуум поддерживается постоянно), использующий физические законы движения заряженных частиц в магнитных и электрических полях
Для поддержания вакуума нужен жидкий азот, поэтому даже когда прибор не используется, на него тратится много денег
Блок-схема масс-спектрометра:
4
1
2
3
5




1 – система ввода образца;
2 – источник ионизации с ускорителем ионов;
3 – масс-анализатор (устройство для разделения ионов);
4 – детектор;
5 – измерительное или регистрирующее устройство.
Принцип метода:
-
Пробу вводят в источник ионизации, где молекулы ионизируются
-
Образующиеся положительные ионы выводятся из зоны ионизации, ускоряются электрическим полем и одновременно фокусируются в пучок, а нейтральные молекулы удаляются вакуум-насосом
-
Поток ускоренных ионов попадает в масс-анализатор, где ионы разделяются по массе (сила Лоренца). Разделенные ионы будут двигаться «полосочками», каждая полосочка соответствует определенной массе, а расстояние между полосочками – разрешение прибора (чем дальше полосы, тем выше разрешение)
-
Разделенные пучки ионов попадают в детектор, где ионный ток преобразуется в электрический сигнал, который усиливается и регистрируется (детектор – фотопластинка)
