
- •4.Константа электролитической диссоциации слабых электролитов. Закон разведения Оствальда.
- •5. Константа диссоциации воды. Ионное произведение воды. Водородный показатель рН.
- •6. Активность и коэффициент активности электролита. Средние ионные активности и коэффициенты активности. Средняя ионная моляльность, средний стехиометрический коэффициент.
- •7.Зависимость среднего ионного коэффнциента активности электролита от концентрации раствора и валентности ионов электролита. Ионная сила. Закон ионной силы.
- •8.Электролитическая теория сильных электролитов Дебая-Гюккеля, ионная атмосфера. Предельный закон Дебая-Гюккеля.
- •9.Удельная э/п р-ра,ее экс.Определение по сопротивл. Р-ра.Ед.Измер.В си.
- •12. Подвижность ионов.Ур-ние,связ. Подвижность(э/п)ионов при бескон.Разб.С пред.Эквив.Э/п р-ра(з-н Кольрауша).Опред.Степени дис.Слаб.Электрол.По э/п р-ра.
- •15.Кондуктометрия(кондукт.Титрование),опред.Растворимости и пр труднораствор.Соед,опред.РН р-ра.
- •16.Понятие о межфазной разности потенц.И строение двойного электр.Слоя на границе Ме-р-р.Нулевой р-р,потенц.Нулевого заряда.
- •17.Электр.Потенциал.Станд.Вод.Электрод.Зав-ть велич.Электр.Потенц.От прир.Электр.И от акт.Потенц.-опред.Ионов.Ур-ние Нернста.
- •18.Гальванический элемент. Процессы, протекающие на отрицательных и положительных электродах элемента. Правила записи гальванического элемента и электродных реакций.
- •31.Кинетика необратимых реакций третьего порядка
- •32.Кинетика Необратимые реакции n-ого порядка
- •34.Методы определения порядка реакции
- •37.Кинетика параллельных реакций первого порядка
- •1.Предмет электрохимии. Проводники первого и второго рода. Определение понятия электролит.
- •2.Основные положения теории электролитической диссоциации.Причины электролитической диссоциации электролитов при их растворении.
- •3.Сильные и слабые электролиты. Степень диссоциации, изотонический коэффициент.Уравнение связывающее степень диссоц. С изотон. Коэф.
- •46. Гетерогенный катализ
- •47.Мультиплетная теория гетерогенного катализа.
- •49.Цепные реакции.
31.Кинетика необратимых реакций третьего порядка
Рассмотрим реакцию
A
+ В +С → D + Е и простой случай, соответствующий
равенству исходных и текущих концентраций
реагентов[ A]0
= [B]0
= [C]0;[A]
= [B]
= [C],
 ,
, ,
,
 .Из
уравнения видно, что критериями
правильности выбранного третьего
порядка является линейность зависимостейили
.Из
уравнения видно, что критериями
правильности выбранного третьего
порядка является линейность зависимостейили
 от
t, для всех пар значений t и [A] и обратно
пропорциональная зависимость между
временем полупревращения и квадратом
начальной концентрации реагента
от
t, для всех пар значений t и [A] и обратно
пропорциональная зависимость между
временем полупревращения и квадратом
начальной концентрации реагента ;
константа скорости третьего порядка
может быть определена по тангенсу угла
наклона зависимостиили от времени.
;
константа скорости третьего порядка
может быть определена по тангенсу угла
наклона зависимостиили от времени.
32.Кинетика Необратимые реакции n-ого порядка
Аналогичный подход применяется к выводу кинетических уравнений для константы скорости реакций более высоких порядков. Можно показать, что для реакции типа А + В + С + … продукты при условии С0А = С0В = С0С = … константа скорости определяется уравнением
 Отсюда
для времени полупревращения получим
Отсюда
для времени полупревращения получим
t1/2
= или t1/2
=
или t1/2
=
33.Период полупревращения для реакций различных порядков.
Время, в течение которого концентрация исходного вещества уменьшается в два раза, называется периодом (временем) полупревращения. Оно обозначается t1/2.
Реакции нулевого порядка.
А B
 ,
,
т.е. время полупревращения прямо пропорционально начальной концентрации вещества (при увеличении С0 в 2 раза, t1/2 увеличивается в 2 раза).
Реакции первого порядка
Время полупревращения для реакции первого порядка не зависит от начальной концентрации вещества этот факт характерен только для реакций первого порядка и может служить признаком, определяющим этот тип реакций

Реакции второго порядка
А + В D.
Время полупревращения для реакции второго порядка обратно пропорционально начальной концентрации веществ:
 .
.
реакции n-ого порядка (кроме n = 1).
для времени полупревращения получим
t1/2
= или
или
t1/2
=
34.Методы определения порядка реакции
Метод изоляции или метод избытка.
Частный порядок ni можно определить, взяв все вещества, кроме данного, взять в большом избытке. Так, в случае реакции
А + В + С D
скорость равна
 .
.
Если вещества В и С взяты в большом избытке, то при протекании реакции их концентрации практически не изменяются, т.е.
 .
.
 .
.
Тогда, определив порядки реакции по каждому из реагирующих веществ, можно найти общий порядок реакции::n = n1 + n2 + n3.
Метод подстановки.
заключается в том, что опытные результаты текущие концентрации веществ в моменты времени t последовательно подставляются в интегральные кинетические уравнения реакций нулевого, первого, второго порядков и определяется, какое из уравнений дает практически постоянную величину константы скорости. Именно это уравнение и определяет порядок исследуемой реакции.
Графический вариант метода подстановки.

Рис9Линейные зависимости различных функций концентрации реагирующих веществ от времени.

Г рафический
метод состоит в построении зависимостей
различных функций концентрации от
времени и определения, для какой из них
наблюдается прямолинейная зависимость.
рафический
метод состоит в построении зависимостей
различных функций концентрации от
времени и определения, для какой из них
наблюдается прямолинейная зависимость.
Линейные зависимости для реакций различных порядков получаются в следующих координатах (рис. 9): нулевого порядка С = f (t), первого порядка lnС = f (t), второго порядка 1/С = f (t).
Для
реакций более высоких порядков выбираются
координаты
 t.
t.
Метод определения порядка реакции по времени полупревращения.
Порядок реакции определяется на основе опытной зависимости времен полупревращения (t1/2) от начальных концентраций веществ (C0), для n = 0 время полупревращения прямо пропорционально величине С0, для n = 1 не зависит от С0, а n = 2 обратно пропорционально С0. Для реакции любого другого порядка справедливо соотношение
 , (20)
, (20)
где t1/2(1) и t1/2(2) время полупревращения при начальных концентрациях С01 и С02, соответственно.
Возможен графический вариант метода: по оси ординат откладываются значения ln(t1/2), а по оси абсцисс значения lnC0 (рис. 10), тогда n = tg + 1.
Дифференциальный метод Вант-Гоффа.
применяют, когда в реакции участвует одно вещество, или при участии нескольких веществ, когда все вещества, кроме данного (А), взяты в большом избытке. Тогда скорость реакции равна
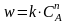 . (21)
. (21)
Прологарифмируем уравнение
lnw
= lnk
+ n
lnС
что в координатах lnw lnC мы получим линейную зависимость, причем n = tg.
Построив зависимость lnw от lnC, можно определить порядок реакции, равный в данном случае тангенсу угла наклона прямой (n = tg).

35.Обратимые реакции первого порядка
Обратимыми называются реакции, в которых наряду с превращением исходных веществ в продукты протекает с заметной скоростью и противоположно направленная реакция превращения продуктов в исходные вещества.
В системах, в которых протекают такие реакции, через некоторое время достигается состояние химического равновесия.
Обратимые реакции – это реакции типа:
Реакция идет до установления равновесия, при котором
wпрямой = wобр., т.е. k1CA = k2CB
В состоянии равновесия
 =
kравн.
=
kравн.
Поскольку вещество А расходуется в прямой реакции и образуется в обратной, то суммарная скорость по изменению концентрации вещества А со временем описывается следующим уравнением
 , (16)
, (16)
где w1 и w2 скорости прямой и обратной реакций, соответственно;
С0А начальная концентрация вещества А (начальная концентрация вещества В принята равной нулю);
СА и СВ текущие концентрации веществ А и В в момент времени t (рис. 6).


Кинетические кривые для обратимой реакции
а) С0В = 0, б) С0В 0.
36.Уравнения позволяющее определить константы скорости прямой и обратной реакции,степен превращения.
