
- •5.Принцип Паоули, правило Гунда
- •6.Правило заполнения энергетических уровней и подуровней орбиталями
- •11.Изотопы, изобары, валентность элемента
- •12.Периодический закон д.И. Менделеева
- •13.Энергия ионизации, сродства к электрону и электроотрицательность
- •61.Характерестические функции
- •62.Первый закон термодинамики
- •63.Второй и третий закон термодинамики
- •64.Закон Гесса и его следствия
- •65.Закон Киргоффа
- •66.Правило фаз Гиббса
- •69.Правило Курнакова
61.Характерестические функции
1)Внутренняя энергия- энергия, которую имеет в себе любое физическое тело.
Состоит из энергии электронного, ядерного, поступательного, вращательного и колебательного движения
2)теплосодержание
3)Энтропия- функция состояния термодинамической системы характерезующая направление протекания процесса, теплообмен между системой и окружающей средой, а так же направление протикания самопроизвольных процессов в замкнутой системе.
62.Первый закон термодинамики
Является постулатом и не может быть выведен логическим путем. Он вытикает из суммы человеческого опыта.
1)в изолированной системе общий запас энегрии остается неизменным
2)все виды энергии переходят друг в друга в строго эквивалентных количествах
3)если в коком либо процессе энергия одного вида исчезает, то взамен ей появляется энергия в другом виде и в количествах строго эквивалентных первых
4)вечный двигатель первого рода не существует.
63.Второй и третий закон термодинамики
Третий закон- Абсолютный ноль температуры принципиально недостижим
Второй закон-
1)быстро или медленно каждая система стремится к истинному равновесию
2)тепло не может самопроизвольно переходить от более холодного тела к более нагретому
3)вечный двигатель второго рода невозможен.
64.Закон Гесса и его следствия
Закон: Тепловой эффект химической реакции не зависит от пути процесса, а зависит от физического состояния исходных и конечных веществ.
Из закона Гесса выходит два следствия:
1)тепловой эффект химической реакции равен сумме тепловых эффектов образования веществ конечных продуктов минус сумма тепловых эффектов образования веществ исходных
2)тепловой эффект химической реакции равен сумме тепловых эффектов згарания веществ исходных и минус сумма тепловых эффектов сгорания продуктов реакции.
65.Закон Киргоффа
Объясняет изменение теплового эффекта реакции с ростом температуры.
Температурный коэффициент теплового эффекта процесса = изменению теплоемкости в результате этого процесса.
66.Правило фаз Гиббса
Число степеней свободы с равновесной гетерогенной системе = числу компонентов к+2 и минус число фаз.
С=к+2-ф
Для жидкого и твердого состояния- С=к+1-ф
69.Правило Курнакова
1)Если расплавить близкие по свойствам металлы, то в узлах кристаллических решеток находятся атомы разных металлов, которые могут замещать друг друга. При этом образуется однородные сплавы, которые называются твердым раствором.
2)Если сплав является механической смесью, то под микроскопом можно разглядеть кристаллы отдельных металлов.
3)Если во время сплавления металлов они взаимодействуют друг с другом, то образуются интерметаллические соединения.
72.Принципы Ле Шателье
Если на систему , которая находится в равновесии действовать или влиять внешним путем и изменять какое либо условие, которое определяет положение равновесия, то оно смещается в направлении той реакции, которой протикание ослабляет эффект внешнего воздействия.
73.Скорость химических реакций
Скорость химической реакции подчиняется закону действующих масс. Его открыл Вааге в 19веке.
Закон: Скорость реакции, которая протекает в гомогенной среде прямо пропорциональна произведению молярной концентрации реагирующих веществ в различных степенях.
74.Молекулярность реакций
Молекулярность реакций определяется числом молекул одновременно взаимодействующих в элементарном акте химического преобразования.
Молекулярность реакции- Реакции, где в элементарном акте участвует 1 молекула.
75.Виды сложных реакций
1)параллельные реакции
2)последовательные реакции
3)сопряженные реакции
А+В=С
А+М=N (М-индикатор)
4)обратимые реакции
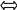 N2+3H2
2NH3
N2+3H2
2NH3
76.Катализаторы
Катализаторами называются реакции, скорость которых изменяется с введением в систему других веществ – катализаторов, состав и количество которых остается неизменным до конца реакции.
77.Адсорбция
Адсорбция- поглощение поверхностью одного тела(адсорбента) вещества из внешней среды(адсорбтива).
Процесс адсорбции обратимый.
Адсорбция зависит от площади адсорбента, температуры, концентрации адсорбтива и т.д.
