
- •1,Физико-химич характеристика природных вод. Основные компоненты природных вод. Классифприр вод.
- •2, Вода, как химическое соединение.
- •3.Требования, предъявляемые к качеству питьевой воды. Основные показатели химич и физические качества воды. Пдк веществ и физических показателей.
- •4,Цветность, мутность природной воды. Кислотность и щелочность воды. Виды определение.
- •5.Формы углек-ты в воде. Углекислотное равновесие воды. Определение карбонатной, гидрокарбонатной углек-ты.
- •6.Жесткость воды. Виды. Определение карбонатной и общей жесткости воды.
- •10.Ионное произведение воды (kw) (вывод). Термодинамическая константа диссоциации воды (Кα). Водородный и гидроксильный показатели. Расчет рН и рОн для сильных и слабых электролитов.
- •11.Индикаторы,типы. Теории индикаторов, их характеристика. Фенолфталеин, метиловый оранжевый. Важнейшие характеристики индикаторов. Определение рН растворов.
- •12.Как рассчитать рН буферных систем.
- •13.Электролиты. Электролитическая диссоциация, механизм диссоциации солей, кислот, оснований с ионной и полярной связью.
- •14.Степень и константа диссоциации электролитов. От каких факторов они зависят. Закон разбавления Оствальда (вывод)
- •15.Гидролиз солей.Типыгидролиза.Степень и константа гидролиза.Факторы,вызывающиеусилинеие или ослабление гидролиза данной соли.
- •16.Как протекает гидролиз соли,образованной сильным оснаванием и слабой кислотой;слабым основанием и сильной кислотой?Расчет константы ,степени гидролиза и pH для такого типа солей.
- •1.Сильноеоснавание и слабая кислота.
- •18.Дисперсные системы,ихвиды,характеристика.Суспензии,эмульсии.Методы получения коллоидных систем.
- •20.Строение гидрозоля. Строение двойного электрического поля. Кривая падения потенциала.
- •21.Методы очистки воды. Что такое фильтрация, седиментация, флотация, кальмация, сорбция? Виды сорбции.
- •22.Удаление мелко- и грубодисперсной взвеси методом отстаивания и фильтрации. Кривые седиментации моно- и полидисперсной взвеси.
- •24. Разрушение дисперсных систем.Коагуляция. Скорость и порог коагуляции. Факторы, вызывающие коагуляцию. Флокулянты, их действие и значение.
- •25. Методы обеззараживания воды. Хлорирование воды. Характеристика. Что такое активный хлор, остаточный хлор, оптимальная доза хлора. Кривая хлороёмкости воды. Как ее получить.
- •26. Виды хлорирования. Озонирование воды. Олигодинамия.
- •27.Удаление из воды Fe, Mn, h2SiO3
- •30.Методы умягчения воды: термический, реагентный и метод ионного обмена.Катиониты, аниониты.
- •2.Реагентные методы:
- •3.Метод ионного обмена:
13.Электролиты. Электролитическая диссоциация, механизм диссоциации солей, кислот, оснований с ионной и полярной связью.
Электролиты – вещ-ва, кот. В водном растворе или расплаве проводят электрический ток. Вещ-ва с ионной связью или с полярной ковалентной связью. Это соли, щелочи, кислоты.
Процесс разрушения молекул вещ-ва под действием растворителей или постоянного электрического тока наз-тсядиссоциацией. При распаде этот процесс дает 2 типа ионов:
-катионы(kat)
(+):
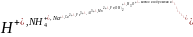
-анионы
(-):

Ионное уравнение реакции: Согласно теории электролитической дис-ции, все реакции водных р-ров – это реакции между ионами.

2Na+
+
S2-
+ 2H+
+SO42-
→
H2S
+ 2Na+
+
SO42-
(2)
2H+ + S2- → H2S (3)
1-тип хим. соединений соль-кислота
2-сила электролита
3-что практически реагирует между собой.
Диссоциация кислот: Сильные к-ты диссоциируют в одну ступень (ступенчато до конца, необратимо), слабые – обратимо, ступенчато и сила их определяется Кд (табл.)

I

II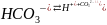
Диссоциация оснований:
I.
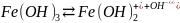
II.


Диссоциация солей:
1)Средние, 2)кислые, 3)основные, 4)комплексные, 5)двойные.
1)дис-ют в 1 ступень.

2)дис-ют ступенчато
3)дис-ют ступенчато:
Ступ.1: по типу сильного электролита, необратимо.
2: по типу слабого электролита, обратимо, как слабая к-та или основание.
Кислая
соль:



I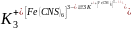 дис-ет ступенчато
дис-ет ступенчато
II
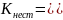 см.
табл.
см.
табл.
Титруем солью Мора:
(NH4)SO4۰
FeSO4۰
18H2O
(NH4)۰ Fe(SO4)2۰ 18H2O – устойчива.
Диссоциация
смешанных солей: Cl2+H2O HClHClO
HClHClO
NaClO → Na+ + ClO-

Хлоридгипохлоридкальция
14.Степень и константа диссоциации электролитов. От каких факторов они зависят. Закон разбавления Оствальда (вывод)
α- число, показывающее какая часть всех растворенных молекул электролита распадается на ионы, наз-сястепенью электролитической диссоциации.
 n-
кол-во распавшихся молекул, N-
общее кол-во молекул.
n-
кол-во распавшихся молекул, N-
общее кол-во молекул.
α =0,4 - 40% молекул продиссоциировали
α = 1 100% диссоциация
α = 0 диссоциация отсутсвует
В зависимости от значения α все электролиты делятся на:
-сильные электролтиы α > 30%
-слабые электролиты α <30%
-электролиты средней силы α = 3 – 30% (H3PO4, H2SO3, HF)
α > 30% кислоты: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3, HCNS.
щелочи :NaOH, KOH, Ba(OH)2, Sr(OH)2
α<30% H2O, NH4OH, CH3COOH, H2S, H2SiO3, HCN.
Kдис= 10-2 – 10-16
Kдис показывает на сколько полно дис-ет слабый электролит. Чем больше Kдис, тем больше концентрация ионов в растворе.
Константа зависит от:
-природы электролита,
-природы растворителя,
-температуры.
Не зависит от концентрации электролита. При разбавлении р-раKдис не изменяется.
H2SiO3, Fe(OH)3, H2CO3
I
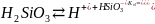
II

З-н разбавления Оствальда:
Отражает зависимость 3 величин сильного элемента
CH3COOH
H+
+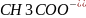
cα-cαcαcα
CM, αдис, Сα

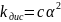 –
закон
разбавления Оствальда
–
закон
разбавления Оствальда
 моль/л
(%)
моль/л
(%)
С разбавлением раствора электролита α возрастает
Используя ур-ниеОствальда
15.Гидролиз солей.Типыгидролиза.Степень и константа гидролиза.Факторы,вызывающиеусилинеие или ослабление гидролиза данной соли.
Гидролиз-реакция обмена между различными веществами о водой.
Неорганич вещ-во +вода наз-сягидролизом,аорганичвещ.+воданаз-сягидротация.Гидролиз солей протекает в природе:водоемах,почве.Хлорирует воду :CL2 +H2O=HCL+HCLO(хлорноватитая)В природе протекает гидролиз жиров,сложныхэфиров,алюмосиликатов.В результате гидролиза происходит разрушение горных пород.Применяется при очистке воды,устранение жесткости воды,а так же при гидролизе целлюлозы,крахмала и крахмала содержащих продуктов получают спирт,глюкозу.Процес гидролиза-пищеварение в организме.
(соль)NaCl=7;(сода) Na2 CO3 >7;(бурая соль)FeCl3<7
При дабовлении воды р-р приобретает определенное значение pH.
Гидролизом называется обратимый процесс взаимодействия ионов соли с ионами воды,приводящий к образованию слабого электролита и изменению реакции среды.Сущ. 4 типа гидролиза(4 типа солей:кислые,средние,основные железо-аммонийные квасцы).Соль,образованная сильным основанием и слабой кислотой;соль,образованная слабым основанием и сильной кислотой,соль,образ-ая сильным основанием и сильной к-той;слабым основанием и слабой кислотой.
Константа
гидролиза:Kгид= ;Степень
гидролиза h=
;Степень
гидролиза h=
 моль/л(
моль/л( 100%);h=
100%);h= моль,%.Еслиh=
30%,то 30 молекул соли гидролизованны,а
70% не подвержены гидролизу.Степень
гидролиза зависит от природы
соли,концентрации соли и температуры.
моль,%.Еслиh=
30%,то 30 молекул соли гидролизованны,а
70% не подвержены гидролизу.Степень
гидролиза зависит от природы
соли,концентрации соли и температуры.
-Природа соли.Чем слабее электролит (меньше Кд),тем выше константа гидролиза(вытекает из ф-лы)и так же чем Кгид больше тем больше и степень гидролиза.
-Концентрация соли.С разбавлением р-ра соли становиться степень гидролиза и константа гидролиза становиться больше.
-Температура.С повышением t константа воды повышается и константа гидролиза увеличивается.
Факторы.NH4++HOH=NH4OH+H+ pH< 7
1)+H2O.Разбавление ра-ра соли гидролиз усиливает.
Принцип ле-шателье:2)>t, -Q( гидролиз усиливется)
3)+HCl,Гидролиз подавляется.[H+]↑,значит смещается влевоэ
4)Na(OH).H++OH-=H2O гидролиз усиливается.
5)Na2CO3 pH>7(усил)
AlCl3 pH<7(ослаб)
NaClpH=7 (усил)
