
- •Билет 1 Современная аналитическая химия. Классификации биологических объектов. Методология получения биологического материала и экстракции биологических молекул и субклеточных структур
- •Принципы ямр-спектрометрии
- •Билет 2 Основные типы ямр-спектрометров
- •Билет 3 Центрифуги и их роторы.
- •Билет 4 Методы центрифугирования для разделения клеток, субклеточных структур и биологических молекул
- •Билет 5 Мембранные технологии разделения биологического материала
- •Билет 6 Хроматография. Классификация методов хроматографии
- •Основные методы рентгеновского анализа биологического материала
- •Билет 7 Общая схема и основные элементы конструкции газовых хроматографов
- •Современная рентгеновская томография
- •Билет 8 Общая схема и основные элементы конструкции жидкостных хроматографов
- •Билет 9 Основные хроматографические методы разделения и анализа биологических веществ
- •Масс-спектрометрия (идентификация молекулы по ее осколкам). Основные типы конструкции масс-спектрометров
- •Билет 10 Основные электрофоретические методы разделения и анализы биологических объектов
- •Основные способы ионизации молекул для их масс-спектрометрического анализа
- •Билет 11 Спектрометрия и классификация методов спектрометрии
- •Масс-спектрометрия биологических объектов
- •Билет 12 Спектрометрия видимого и ультрафиолетового спектра. Общая схема и основные элементы конструкции спектрофотометров для измерений в видимом и ультрафиолетовом диапазонах спектра
- •Изотопные и радиоизотопные методы в биохимии и биофизике
- •Билет 13 Спектрофлюоресцентные методы анализа. Общая схема и основные элементы конструкции спектрофлюориметров.
- •Биофизические основы современных методов анализа первичной структуры нуклеиновых и белковых молекул
- •Билет 14
- •Принципы микроскопии сверхвысокого разрешения
- •Билет 15 Фурье- спектрометрия. Основные типы ик-Фурье-спектрометров
- •Методы электронной микроскопии
- •Билет 16 Спектрометрия комбинационного рассеивания (Раман спектрометрия)
- •Оптические методы анализа клеточной и субклеточной структуры
- •Билет 17 Принципы эпр-спектромерии
- •Билет 18 Проблемы измерения и анализа в современных биохимических, молекулярно-биологических, медицинских и биотехнологических исследованиях
Билет 13 Спектрофлюоресцентные методы анализа. Общая схема и основные элементы конструкции спектрофлюориметров.
Метод оптической спектроскопии, метод молекулярной люминисценции. Он подразделяется на методы флуоресцентной, фосфорисцентной и хемилюминесцентной спектроскопии. Первые два основаны на измерение интенсивности излучения, испускаемого в результате поглощения фотонов (фотолюминесценция). Хемилюминесценция-это процесс испускания света молекулами, возбужденными в ходе химической реакции.
Флуоресценция-это процесс излучательного перехода с низшего возбужденного синглетного состояния в основное.
Фосфоресценция происходит за одну стадию.
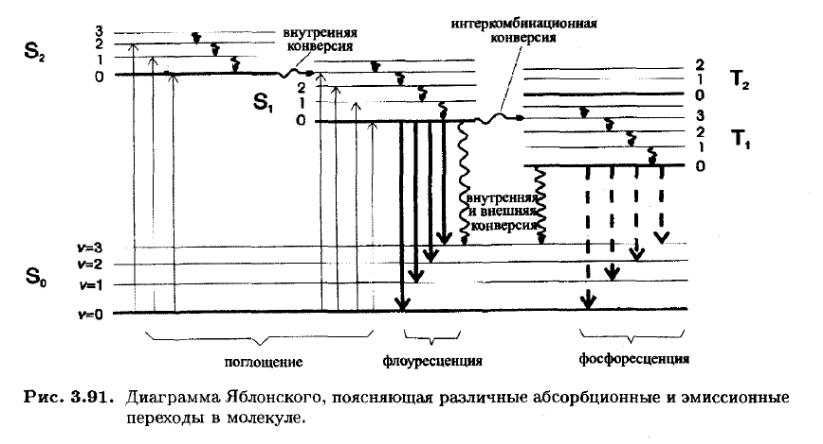
Флюоресцентный метод применим для непросредственного определения некоторых органических веществ. С его помощью можно контролировать чистоту природных вод, поскольку среди органических загрязнителей, как правило, всегда имеются флуоресцирующие. С помощью флуоресцирующих органических реагентов можно определить ионы металлов.

Прибор для измерения интенсивности флуоресценции отличается от абсорбционного спектрофотометра тем, что измерение происходит под углом (обычно прямым) к падающему лучу света. Поэтому кюветы должны быть прозрачными во всех направлениях. Высококачественный флуоресцентный спектрометр включает в себя два монохроматора. Это позволяет независимо регистрировать и спектр возбуждения, и спектр флуоресценции.
Для регистрации фосфоресценции необходимы еще два дополнительных устройства. Одно из них-механический и электронный прерыватель, позволяющий облучать пробу очень короткиии импульсами и тем самым отделить длительное фосфоресцентное свечение от кратковременного флуоресцентного. Кроме того, фосфоресценция обычно наблюдается лишь при очень низких температурах (при повышении температуры происходят интенсивные процессы дезактивации триплетного состояния вследствии столкновений между молекулами). Поэтому фосфоресцентный спектрометр, как правило, включает в себя и устройство для охлаждения пробы до температуры жидкого азота.
Биофизические основы современных методов анализа первичной структуры нуклеиновых и белковых молекул
Общая схема: Для определения аминокислотной последовательности белка прежде всего разделяют его полипептидные цепи (если макромолекула состоит из неск. цепей). Затем определяют аминокислотный состав цепей, N- и С-концевые аминокислотные остатки и аминокислотные последовательности. Полипептидные цепи подвергают специфич. расщеплению протеолитич. ферментами или хим. реагентами. Смесь образовавшихся фрагментов разделяют и для каждого из них определяют аминокислотный состав и аминокислотную последовательность. Анализ аминокислотного состава включает полный гидролиз исследуемого белка или пептида и количеств. определение всех аминокислот в гидролизате. (Гидролиз – процесс в ходе которого при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия)
Разделение пептидов: При выборе методов разделения пептидов учитывают физ.-хим. свойства, кол-во и длину молекул разделяемых соединений. Для первичного фракционирования смесей коротких пептидов, содержащих до 15-20 аминокислотных остатков, в большинстве случаев используют ионообменную хроматографию на катионитах. Дальнейшее разделение и очистку проводят с помощью хроматографии и электрофореза на бумаге или пластинках с тонким слоем целлюлозы или силикагеля.
Определение аминокислотной последовательности: Осн. метод исследования аминокислотной последовательности пептидов и белков - хим. деградация с помощью фенилизотиоцианата. Этот метод позволяет последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов. Для их идентификации наиб. часто используют тонкослойную хроматографию, жидкостную хроматографию высокого давления, а также масс-спектрометрию.
Определение нуклеотидной последовательности :Для непосредственного анализа первичной структуры белков обычно используют секвенатор, иногда масс-спектрометр.
Методы изучения пространственной структуры: существует большое количество методов для исследования белков в растворе: УФ-, ИК- и Раман-спектроскопи, ЯМР и ЭПР
