
Скорость



Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
Полезно знать формулу Майера для удельных теплоёмкостей: .
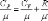
или
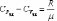 .
.
Пусть
мы нагреваем один моль идеального газа
при постоянном объёме(dA = 0). Тогда первое
начало термодинамики запишем в виде:
,
 (4.2.3)
(4.2.3)
т.е. бесконечно малое приращение количества теплоты равно приращению внутренней энергии dU.
Теплоемкость
при постоянном объёме будет равна: ,
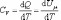 (4.2.4)
(4.2.4)
В
общем случае 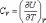 ,
,
так как U может зависеть не только от температуры. Но в случае идеального газа справедлива формула (4.2.4).
Из
(4.2.4) следует, что

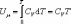 ,
,
,
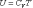 (4.2.5)
(4.2.5)
Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных), поэтому формула (4.2.5) справедлива для любого процесса.
Для
произвольной идеальной массы газа:
, 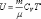 (4.2.6)
(4.2.6)
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом: .
.
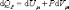
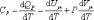 (4.2.7)
(4.2.7)
Из
основного уравнения молекулярно-кинетической
теории . При изобарическом процессе Р
= const. Следовательно, из (4.2.7) получим:
. 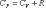 (4.2.8)
(4.2.8)
Это уравнение Майера для одного моля газа.
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
Второй закон термодинамики.
А что такое второй закон термодинамики? Мы знаем, что если при работе приходится преодолевать трение, то потерянная работа равна выделившемуся теплу. Если мы преодолеваем трение в комнате при температуре Т и делаем это достаточно медленно, то температура в комнате изменится ненамного. Мы превращаем работу в тепло при постоянной температуре. Ну, а можно ли поступить наоборот? Сумеем ли мы каким-то способом превратить тепло в работу при постоянной температуре? Второй закон термодинамики утверждает, что это невозможно. Было бы очень хорошо научиться превращать тепло в работу, изменив лишь направление процесса, похожего на трение. Если исходить только из закона сохранения энергии, можно считать, что тепловая энергия, например колебательная энергия молекул, способна служить удобным источником полезной энергии. Но Карно утверждал, что при постоянной температуре тепловую энергию нельзя извлечь из ее источника. Иначе говоря, если бы весь мир имел повсюду одинаковую температуру, то оказалось бы невозможным превратить тепловую энергию в работу. Хотя процессы, при которых работа переходит в тепло, могут идти при постоянной температуре, невозможно обратить их и вернуть работу обратно. Если говорить точно, Карно утверждал, что при постоянной температуре нельзя извлечь тепло из его источника и превратить в работу, не производя больше никаких изменений в заданной нам системе или в окружающем пространстве. Последняя фаза очень важна. Предположим, что в запаянном контейнере находится сжатый воздух при постоянной температуре; мы позволили ему расшириться. Такое устройство может совершать работу; оно может привести в движение пневматический молоток. При расширении, например, воздух чуть-чуть охлаждается, но если в нашем распоряжении очень большое море, огромный тепловой резервуар, то мы снова сможем нагреть его. Итак, мы взяли из моря (резервуара) тепло и произвели работу при помощи сжатого воздуха. Однако Карно не ошибся. Ведь мы не сумели оставить все в системе без изменения. Чтобы сжать снова воздух, которому мы позволили расшириться, нам понадобится произвести дополнительную работу. Покончив с этим, мы обнаружим, что не только не смогли заставить систему работать при заданной температуре Т, но еще и сами вложили некую работу. Мы должны говорить только о таких случаях, когда полный результат всего процесса сводится к изъятию тепла и превращению его в работу, точно так же, как при преодолении трения конечный результат есть превращение работы в тепло. Если процесс сводится к движению по окружности; то систему можно вернуть точно в исходное положение, но конечным результатом этого процесса будет переход в тепло затраченной на преодоление трения работы. А можно ли обратить этот процесс? Повернуть, скажем, какую-нибудь ручку, чтобы все повернулось вспять, трение производило полезную работу, а моря остыли? Карно сказал, что этого не может быть. Давайте и мы предположим, что это невозможно. Если бы это стало вдруг возможным, то это означало бы, что, помимо многих других полезных вещей, мы смогли бы, например, без всяких затрат отнять тепло у холодного тела и отдать его горячему. Между тем каждый знает, что тепло переходит от горячего тела к холодному. Если мы просто приложим нагретое тело к холодному и больше ничего делать не будем, то, насколько известно, горячее тело никогда не станет горячее, а холодное — холоднее! Но если бы мы смогли произвести работу, отобрав тепло, скажем, у океана или от чего-нибудь еще, не изменив его температуры, то эту работу можно было бы,
призвав на помощь трение, снова превратить в тепло, но уже при другой температуре. Например,второе плечо нашей воображаемой машины может тереться обо что-то, что и так уже нагрелось. Полный результат процесса в этом случае сводится к охлаждению «холодного» тела, в нашем случае океана, и нагреванию горячих трущихся частей машины. Гипотезу Карно, второй закон термодинамики, иногда формулируют так: тепло не может перетечь само собой от холодного тела к горячему. Но мы только что убедились в эквивалентности этих утверждений. Повторим их снова. Первое: нельзя осуществить процесс, единственным результатом которого является превращение тепла в работу при постоянной температуре. Второе: тепло не может перетечь само собой от холодного тела к горячему. Мы будем чаще пользоваться первой формулировкой.
Анализ работы тепловой машины, проделанный Карно, весьма похож на то, что мы делали в гл. 4 (вып. 1), когда изучали подъемные машины и рассуждали о законе сохранения энергии. Более того, приведенные там аргументы подсказаны аргументами Карно о работе тепловых машин. Поэтому некоторые рассуждения в этой главе покажутся вам уже знакомыми.
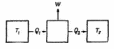
Предположим, что «котел» построенной нами тепловой машины поддерживается при температуре Т1. За счет отнятого у котла тепла Q1 пар совершил работу W и выделил в «конденсоре» тепло Q2 [температура конденсора равна Т2 (фиг. 44.3)]. Карно не уточнил, чему равно это тепло, потому что не знал первого закона и не предполагал, что Q2 равно Q1 потому что не верил этому. Многие считали, что Q1 и Q2 одинаковы, так предписывала калорическая теория. Но Карно этого не предполагал, в этом одна из тонкостей его аргументов. Если же использовать первый закон, то мы найдем, что выделенное тепло Q2 равно теплу Q1 за вычетом совершенной работы:

50. Теплоемкость идеального газа. Уравнение Маейра.
Теплоёмкость
тела характеризуется количеством
теплоты, необходимой для нагревания
этого тела на один градус:  (4.2.1)
(4.2.1)
Размерность теплоемкости: [C] = Дж/К.
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К.
Для
газов удобно пользоваться молярной
теплоемкостью Cμ- количество теплоты,
необходимое для нагревания 1 моля газа
на 1 градус: 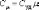 (4.2.2)
(4.2.2)
[Cμ] = Дж/(моль×К).
Из п. 1.2 известно, что молярная масса – масса одного моля:
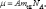
где А – атомная масса; mед - атомная единица массы; NА - число Авогадро; моль μ – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода 12С.
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV.
СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2).
Рис. 4.2
Следовательно,
проводимое тепло затрачивается и на
нагревание и на совершение работы.
Отсюда ясно, что .
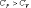
Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния.
Величины СР и СV оказываются связанными простыми соотношениями. Найдём их.
47. Потенциальная энергия.


Тангенциальное и нормальное ускорения



Первый закон термодинамики.


Внутреннее трение.


46. Явление переноса.
Диффузия.

Теплопроводность
Угловая скорость. Связь угловой скорости с линейной.


Идеальный газ
Введем ограничения, которые свойственны любой физической теории.
Идеальный газ - модель реального газа, которая удовлетворяет следующим требованиям:
Расстояние между молекулами гораздо больше их размеров (молекулы можно считать материальными точками);
Силами взаимодействия, кроме моментов соударения, можно пренебречь (потенциальная энергия взаимодействия молекул по сравнению с кинетической энергией хаотического движения пренебрежимо мала);
Столкновение молекул друг с другом и со стенками абсолютно упругое;
Движение каждой молекулы подчиняется классическим законам динамики Ньютона.
Реальный разреженный газ приблизительно ведет себя как идеальный газ.
Основное уравнение молекулярно-кинетической теории идеального газа
Основное
уравнение молекулярно-кинетической
теории идеального газа устанавливает
связь между макроскопической величиной
- давлением, которое может быть измерено,
например манометром, и микроскопическими
величинами, характеризующими молекулу:
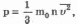
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы

можно записать:

Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
43. Распределение частиц в потенциальном поле.
Закон Больцмана для распределения частиц идеального газа во внешнем потенциальном поле. n=n0exp(-e p/(kT)) Больцман доказал, что это распределение справедливо не только в случае потенциальных сил земного тяготения, но и в любом потенциальном поле сил совокупности любых одинаковых частиц, находящихся в состоянии хаотического движения. В соответствии с этим это распределение было названо законом Больцмана для распределения частиц идеального газа во внешнем потенциальном поле.
44. Энергия заряженного конденсатора.

45. Кинетическая энергия.

41. Средняя длина пробега молекул.

42. Конденсатор.



Угловое ускорение. Связь углового ускорения с тангенциальным.

Основные газовые законы.
Состояние газа определяется тремя его величинами: T температурой, P давлением и V объемом. Нормальными условиями принято считать температуру Т=0 по Цельсию, давление P= 101,325 кПа (атмосферное). При таких условиях приняты следующие обозначения: Vо – объём газа, а давление — через Pо.
Закон Бойля — Мариотта : при T= const давление газа обратно пропорционально объему газа:
Р2/Р1 = V1/V2 или PV = const.
Закон Гей - Люссака: при Р=const объем газа изменяется прямо пропорционально абсолютной температуре :
V1/T1 = V2/T2 или V/T = const.
При V=const давление газа изменяется прямо пропорционально абсолютной температуре:
Р1/Т1=P2/Т2.
Объединяя эти законы, получим универсальный газовый закон:
PV/T = P0V0/T0.
Законы Ньютона.
Первый закон.

Второй закон.


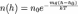
для давления:
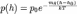
где n0 и p0 - плотность п давление на нек-ром начальном уровне h0, m - масса частицы газа. Иногда вместо m удобнее пользоваться молекулярной массой m = m/mu (mu- атомная единица массы), при этом в показателе степени вместо mg/kT следует писать mg/RT, где R - газовая постоянная. Показатель экспоненты в (1) можно также записать в виде (h - h0)/H, где т. н. высота однородной атмосферы H = kT/mg характеризует протяжённость атмосферы (масштаб высоты) и скорость убывания n и р с высотой. H численно равна перепаду высот, на к-ром n (или р) уменьшается в е раз. Чем больше H, тем медленнее убывает с высотой n (или р) и тем протяжённее атмосфера.
40. Электроемкость.


38. Потенциал. Разность потенциалов.
Потенциал является энергетической характеристикой электрического поля.
Потенциал численно равен работе, которую надо совершить, чтобы положительный заряд в один кулон переместить из бесконечности или с поверхности земли в данную точку электрического поля.
Пример: заряд в один кулон переместили из бесконечности или с поверхности земли в данную точку электрического поля при этом была совершена работа в пять джоулей.
Значит потенциал в данной точке равен пяти единицам потенциала.
Единицей потенциала является Вольт (В).
Потенциал равен одному вольту (В), если при перемещении заряда в один кулон из бесконечности или с поверхности земли в данную точку электрического поля совершена работа в один джоуль (Дж) .
Разность потенциалов (напряжение) .
Напряжением называется разность потенциалов двух точек электрического поля. Напряжение также измеряется в вольтах. Наряду с основными единицами в практике принято пользоваться их долями или многократно увеличенными значениями :
0,000001В называется микровольтом мкВ ( одна миллионная вольта, 10-6)
0,001В называется милливольт мВ (одна тысячная вольта, 10-3)
1000 В называется киловольт 103
Если точки электрического поля имеют одинаковые потенциалы, то напряжение между этими точками равно нулю .
39. Барометрическая формула.
БАРОМЕТРИЧЕСКАЯ ФОРМУЛА - определяет зависимость от высоты h плотности n или давления p идеального изотермического газа, находящегося в гидростатическом равновесии в однородном поле силы тяжести. Высота h отсчитывается в направлении, противоположном ускорению силы тяжести g. Б. ф. явл. частным случаем Больцмана распределения, обычно используется для описания атмосфер космич. тел (планет, звёзд). Для плотности Б. ф. можно записать в виде:
Третий закон Ньютона.

Внутренняя энергия идеального газа

Закон сохранения импульса.

Распределение энергии по степеням свободы





37. Энтропия. Теорема Кладиуса.


Основное уравнение динамики вращательного движения

