
- •Вопросы к экзамену первой части курса «Общая и неорганическая химия»
- •Примеры экзаменационных билетов Экзаменационный билет № 1
- •1. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов в энергетических ячейках (атомных орбиталях), в электронных оболочках и слоях. Правило Хунда.
- •1. Последовательность заполнения электронных оболочек и слоев в атомах. Принцип наименьшей энергии, правило Клечковского. Способы изображения электронных структур атомов.
- •1. Периоды, группы, подгруппы и семейства s-, p-, d- и f-элементов с точки зрения электронного строения атомов. Объяснение различной длины периодов. Длинно- и короткопериодный варианты системы.
- •1. Периодические свойства атомов. Радиусы (размеры) атомов и ионов и их изменение по периодам и группам периодической системы. D- и f-сжатие.
- •2. Типы окислительно-восстановительных реакций (межмолекулярного окисления-восстановления, диспропорционирования, внутримолекулярного окисления-восстановления). Привести примеры.
- •Ответ на экзаменационный билет № 1
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
1. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов в энергетических ячейках (атомных орбиталях), в электронных оболочках и слоях. Правило Хунда.
2. Особые случаи гидролиза солей (полный гидролиз, совместный гидролиз двух солей). Привести примеры.
3. Мышьяк образует два оксида с содержанием кислорода 24,2% и 37,8%. Привести формулы оксидов и эквивалентные массы мышьяка в этих оксидах.
Экзаменационный билет № 9.
1. Периодическая система элементов и ее связь со строением атомов. Периодические и непериодические свойства элементов. Физический смысл порядкового номера элемента в системе. Современная формулировка периодического закона.
2. Явление катализа. Катализаторы и ингибиторы. Механизм гомогенного катализа (теория образования промежуточных соединений).
3. Никелевое изделие покрыто серебром. Какое это покрытие – анодное или катодное? Какие процессы происходят при повреждении покрытия: а) в кислой среде; б) во влажном воздухе? Привести суммарные уравнения процессов коррозии в этих средах.
Экзаменационный билет № 10.
1. Последовательность заполнения электронных оболочек и слоев в атомах. Принцип наименьшей энергии, правило Клечковского. Способы изображения электронных структур атомов.
2. Зависимость скорости химической от температуры. Правило Вант-Гоффа. Температурный коэффициент скорости реакции. Энергия активации. Уравнение Аррениуса.
3. Два электрода, магниевый и медный, погружены в растворы соответственно хлоридов магния и меди (II) с концентрацией ионов магния 0,01 моль/л, концентрацией ионов меди 1 моль/л. Написать электрохимическую схему получившегося элемента, электродные процессы, протекающие при его работе и вычислить ЭДС.
Экзаменационный билет № 11.
1. Периоды, группы, подгруппы и семейства s-, p-, d- и f-элементов с точки зрения электронного строения атомов. Объяснение различной длины периодов. Длинно- и короткопериодный варианты системы.
2. Зависимость скорости химической реакции от концентраций реагирующих веществ. Закон действия масс. Константа скорости реакции. Молекулярность и порядок реакции. Влияние давления на скорость реакции.
3. Определить тип химической связи в молекулах H2O, CH4, AsCl5. Дать обоснованный ответ. Описать методом валентных связей строение данных молекул.
Экзаменационный билет № 12.
1. Периодические свойства атомов. Радиусы (размеры) атомов и ионов и их изменение по периодам и группам периодической системы. D- и f-сжатие.
2. Типы окислительно-восстановительных реакций (межмолекулярного окисления-восстановления, диспропорционирования, внутримолекулярного окисления-восстановления). Привести примеры.
3. Во сколько раз увеличится скорость прямой реакции при повышении температуры на 85С, если = 2?
Экзаменационный билет № 12.
1. Энергия ионизации атомов и ее изменение по периодам и группам периодической системы. Сродство к электрону, электроотрицательность атомов, их изменение по периодам и группам периодической системы.
2. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Реакции в кислых, нейтральных и щелочных растворах. Составление уравнений окислительно-восстановительных реакций электронно-ионным методом (методом полуреакций). Привести примеры.
3. Какое вещество и какой массы выделится на аноде при электролизе водного раствора сульфата меди (II), длившемся 3,5 часа при силе тока 20 ампер? Приведите уравнения электродных процессов и суммарное уравнение электролизе.
Ответ на экзаменационный билет № 1
Вопрос 1.
Электрон внутри атома, находясь на своей орбитали, характеризуется четырьмя квантовыми числами:
1) главным квантовым числом n, характеризующим энергетический уровень в атоме, на котором находится электрон;
2) орбитальным квантовым числом l, характеризующим геометрию электронного облака, т.е. геометрию электронной орбитали;
3) магнитным квантовым числом ml, характеризующим
4) спиновым квантовым числом ms, характеризующим собственный магнитный момент электрона.
Квантовые числа получили такое название за то, что имеют строго определенные значения, которые они могут принимать.
Главное квантовое число n показывает номер энергетического уровня, на котором находится электрон. Поскольку номер уровня, как и любой другой номер, может быть только натуральным числом, то n принимает значения от +1 до + с шагом через единицу, т.е. n[1, 2, 3, 4,..., +). Главное квантовое число n является основной энергетической характеристикой электрона в атоме, поскольку характеризует удаленность электрона от ядра и, следовательно, энергию взаимодействия этого электрона с положительно заряженным ядром атома. Соответственно, главное квантовое число может определять радиус (размеры) электронного облака:
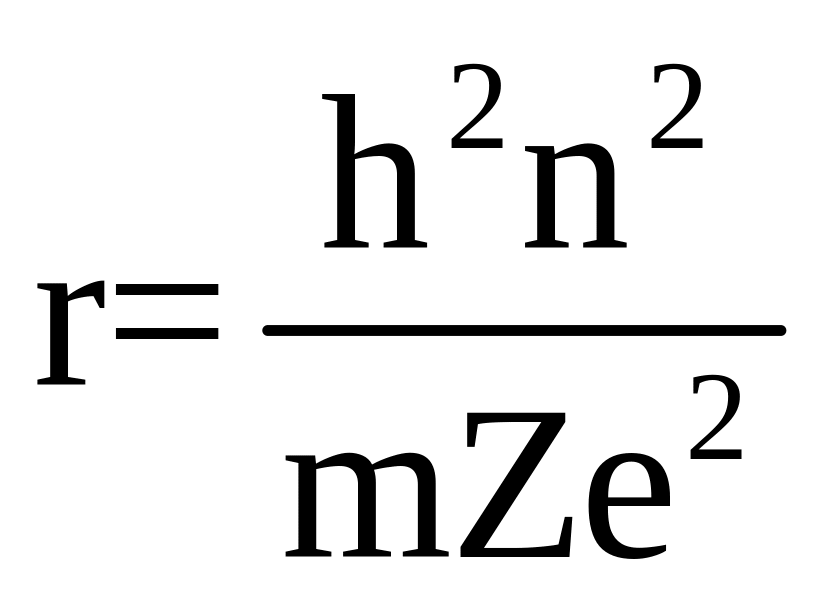
где h – постоянная Планка, n – главное квантовое число, m – масса электрона, Z –заряд ядра атома, e – заряд электрона. Как видно, радиус электронного облака напрямую зависит от главного квантового числа n.
