
1.1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
1.) Уравнение Q = U + pV выражает ……………
а) первый закон термодинамики
Ответ: а).
2.) В первом законе термодинамики Q = U + pV …………
а) Q 1) давление
б) U 2) изменение объема
в) p 3) работа
г) V 4) изменение внутренней энергии
5) тепло, теплота подводимая к системе
Ответ: а)-5; б)-4; в)-1; г)-2.
3.) Тепло, теплота подводимая к системе равна изменению её энтальпии при
б) р = пост, Т = пост
Ответ: б).
4.) Согласно закону Гесса тепловой эффект реакции
а) зависит от физического состояния и химической природы исходных веществ и продуктов реакции
г) не зависит от пути протекания реакции
Ответ: а), г).
5.) Тепловой эффект реакции 2Н2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г) рассчитывается по формуле
в)
![]()
Ответ: в).
6.) Протекание реакции Fe2O3(тв.) С(т) = 2Fe(т) + 3СО(г)
(Н=490 кДж/моль, S = 541Дж/моль К)
а) возможно при температуре 1000К
г) невозможно при температуре 500К
Ответ: а), г).
7.) Изобарно – изотермический потенциал реакции TiO2(т) + 2C(т) = Ti(т) + 2CO(г)
(Н=723 кДж/моль, S = 365Дж/моль К)
при температуре 1000К равен
б) +358 кДж/моль
Ответ: б).
8.) Протекание прямой реакции
СН4(г) + СО2(г) 2СО(г) + 2Н2(г) изолированной системе
а) возможно, т.к. Sх.р. 0
Ответ: а).
9.) Экзотермической является реакция
в) N2(г) + 3H2(г) = 2NH3(г); Н = -92,4 кДж
Ответ: в).
10.) Энтропия системы СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(г)
б) уменьшается
Ответ: б).
1.2. ХИМИЧЕСКАЯ КИНЕТИКА
1.) Общий порядок реакции возрастает в реакциях ………
а)
![]()
б)
![]()
в)
![]()
г)
![]()
Ответ: г), в), б), а).
2.) Закон действующих масс строго соблюдается для реакции
б) N2(г) + 3H2(г) 2NH3(г)
Ответ: б).
3.) При увеличении концентрации хлора в 2 раза и концентрации NO в 3 раза скорость реакции 2NO(г) + Cl2(г) 2NOCl(г)
а) возрастёт в 18 раз
Ответ: а).
4.) Скорость обратной реакции 2N2O5(г) = 4NO2(г) + O2(г) возрастет в 243 раза при ………….
а) увеличении давления в 2 раза
б) увеличении давления в 3 раза
в) уменьшении давления в 2 раза
г) уменьшеии давления в 3 раза
Ответ:
5.) Скорость химической реакции при повышении температуры на 300С возрастет в ………раз (=4)
в) 64
Ответ: в).
6.) При одновременном увеличении температуры на 200С (=2) и концентраций реагирующих веществ в 3 раза скорость реакции 2А(г) + В(г) 2С(г)
в) возрастёт в 108 раз
Ответ: в).
7.) В уравнении Аррениуса
![]()
а) k 1. абсолютная температура
б) A 2. энергия активации
в) Eа 3. предэкспоненциальный множитель
г) R 4. универсальная газовая постоянная
д) T 5. константа скорости
Ответ: а)-5; б)-3; в)-2; г)-4; д)-1
8.) Скорость прямой реакции 2NO + H2 N2O + H2O увеличится в 27 раз при увеличении концентраций исходных веществ
б) в 3 раза
Ответ: б).
9.) Порядок реакции 2NO(г) + Cl2(г) 2NOCl(г)
в) 2
Ответ: в).
1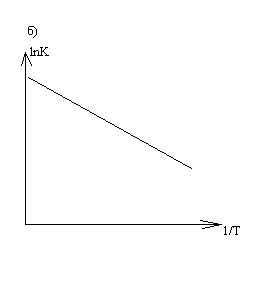 0.)
Зависимость
0.)
Зависимость
![]() представлена на графике
представлена на графике
Ответ: б).
11.) Увеличение давления в системах S(т) + O2(г) SO2(г) и 2SO2(г) + O2 2SO3(г)
в) увеличит скорости обеих реакций
Ответ: в).
12.) Увеличение давления в системе А(г)
+ 2В(г) С(г)
в 4 раза и одновременное повышение
температуры на 40 0С (![]() )……
)……
а) увеличат скорость реакции в 1024 раза
Ответ: а).
13.) Скорость реакции 2А(г) + 2В(г)
2С(г) возрастет
в 81 раз (![]() )
……..
)
……..
б) при увеличении температуры от 25 0С до 65 0С
Ответ: б).
14.) При увеличении давления в системе 2NO(г) + O2(г) 2NO2(г) в 2 раза
в) скорость прямой реакции возрастет в 8 раз, обратной – 4 раза
Ответ: в).
15.) Константа скорости реакции при увеличении температуры от 500К до 1000К (Еа = 95,5 кДж/моль) возрастет в
г) 105 раз
Ответ: г).
1.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Равновесие
![]() сместится вправо при увеличении
концентрации
сместится вправо при увеличении
концентрации
б) Br2
в) H2O
Ответ: б), в).
2.) Выход аммиака увеличится N2 + 3H2 2NH3; Н 0 при
а) увеличении концентрации Н2, уменьшении температуры
Ответ: а).
3.) Увеличение давления в системе 2NO(г) + O2(г) 2NO2(г)
б) сместит равновесие вправо
Ответ: б).
4.) Константа равновесия для равновесной системы 3Fe + 4H2O(г) Fe3O4 + 4H2 имеет вид:
в)

Ответ: в).
5.) Равновесие в системе H2(г) + I2(г) 2HI(г) сместится влево при
г) при увеличении концентрации HI
Ответ: г).
6.) Увеличении температуры сместит равновесие реакции N2O4 2NO2; -56,84кДж
б) в обратном направлении
Ответ: б).
7.) Константа равновесия реакции СО2(г) + Н2(г) СО(г) + Н2О(г) при равновесных концентрациях [CO2]=0,02; [H2]=0,01; [CO]=0,1; [H2O]=0,04 моль/л равна
а) 20
Ответ: а).
8.) Константа равновесия реакции H2
+ I2
2HI равна 64 при равновесных
концентрациях [HI]=![]() ,
[H2]=
,
[H2]=![]() и [I2]=x
моль/л, где x равен …………..
и [I2]=x
моль/л, где x равен …………..
г) 0,025
Ответ: г).
9.) Увеличение температуры сместит равновесие в системе 2А(г) + 2В(г) 2С(г) + 3Д(г); Н 0 в том же направлении, что и
а) уменьшении давления
Ответ: а).
10.) Для смещения равновесия реакции Н2(г) + S(т) Н2S(г); Н 0 в сторону увеличения выхода Н2S следует
г) понизить температуру
Ответ: г).
11.) Повышение температуры смещает равновесие вправо
в) 3Н2(г) + Sb2S3(т) 3H2S(г) + 2Sb(т) Н=89 кДж
г) CH4(г) + 2H2S(г) CS2(г) + 4H2(г); Н=230 кДж
Ответ: в), г).
12.) Равновесие сместится в сторону образования исходных веществ при сжатии смеси газов
в) N2O4 2NO2
г) 4NH3 + 5O2 4NO + 6H2O
Ответ: в), г).
13.) Константа равновесия для системы Fe2O3(т) + 3CO(г) 3Fe(т) + 3CO2(г) рассчитывается:
г)
![]()
Ответ: г).
14.) Равновесие Cl2(г) + 2NO(г) 2NOCl(г); Н=-73 кДж сместится вправо
а) при увеличении давления и уменьшении температуры
Ответ: а).
15.) Увеличение температуры в системе 3СО(г)+2Н2О(г) СН3ОН(г) + 2СО2(г); Н=-172 кДж
смещает равновесие в том же направлении, что и
в) уменьшение давления
Ответ: в).
2.1. СТРОЕНИЕ АТОМА
1.) Энергетический уровень характеризуется:
а) главным квантовым числом
Ответ: а).
2.) Орбитальное квантовое число l характеризует
в) форму АО и орбитальный момент количества движения электрона
Ответ: в).
3.) Ориентацию АО в пространстве описывает квантовое число:
в) ml
Ответ: в).
4.) Собственный вращательный момент электрона вокруг своей оси описывает квантовое число:
г) ms
Ответ: г).
5.) Согласно правилу Клечковского заполнение атомных орбиталей верно в ряду:
б) 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
Ответ: б).
6.) Число атомных орбиталей в подуровне рассчитывается по формуле:
а) N=2 . l+1
Ответ: а).
7.) Максимальная ёмкость энергетического уровня рассчитывается по формуле:
г) N=2n2
Ответ: г).
8.) Явление «проскока» электрона наблюдается в атоме
в) Cu
Ответ: в).
9.) Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d3
а) V
Ответ: а).
10.) Электронная конфигурация Сl- иона…..-
б) ….3s2 3p6
Ответ: б).
2.2. Электронные формулы и электронные структуры
1.) Элементом, имеющем электроны на энергетических уровнях с главными квантовыми числами 1, 2, 3, 4, является:
г)
![]()
Ответ: г).
2.) Значения квантовых чисел n, l, ml для внешнего электрона атома Cr:
в) 3, 0, 0
Ответ: в).
3.) Значения квантовых чисел n, l, ml для внешнего электрона атома Cr:
г) 4, 0, 0
Ответ: г).
4.) Значение квантовых чисел n, l, ml для внешнего электрона атома рубидия:
г) 5, 0, 0
Ответ: г).
5.) Внешний 8-электронный энергетический уровень у:
а) Cl-
б) S2-
в) Cs+
г) Kr
Ответ: а), б), в), г).
6.) По возрастанию энергии орбитали расположены в ряду:
а) 4d, 4s, 5p, 4p
б) 5d, 4f, 5p, 6s
в) 3d, 4p, 4s, 5p
г) 5d, 4f, 6s
Ответ:
7.) Элемент, в атоме которого три внешние электрона имеют квантовые числа n=3, l=1, это:
в) Al
Ответ: в).
8.) Суммарный спин неспаренных электронов атома хрома в основном энергетическом состоянии равен:
а) 3
Ответ: а).
9.) Значение квантовых чисел n, l, ml ms для внешнего электрона атома индия:
г) 5, 1, -1, +1/2
Ответ: г).
10.) Период, группа, подгруппа Периодической системы для элемента с электронной формулой 1s22s22p63s23p64s23d5:
в) 4, VII, побочная
Ответ: в).
2.3. Взаимосвязь структуры и свойств простых веществ
1.) Пары элементов, образующих ионные соединения:
а) Na и O
в) Rb и F
д) Ba и Br
Ответ: а), в), д).
2.) Валентность ионов О- и О+ по обменному механизму:
б) 1 и 3
Ответ: б).
3.) Трения
![]() при sp2 – гибридизации:
при sp2 – гибридизации:
в) участвует в образовании - связи
Ответ: в).
4.) Донором скольких электронных пар является атом кислорода молекулы Н2О:
в) двух
Ответ: в).
3.1. ХАРАКТЕРИСТИКИ И СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ
1.) Валентный угол уменьшается у молекул
а) BeCl2, BCl3, CCl4
Ответ: а).
2.) Энергия ионизации молекул в ряду Н2О, H2S, H2Se, H2Te
а) уменьшается
Ответ: а).
3.) Энергия связи в ряду HF, HCl, HBr, HI …………
б) уменьшается
Ответ: б).
4.) Характеристиками связи служат
в) энергия связи, длина связи, валентный угол
Ответ: в).
5.) Валентный угол в молекуле BF3 составляет:
в) 1200
Ответ: в).
6.) Валентность хлора в соединениях:
а) HClO4 1) 1
б) HCl 2) 3
в) HClO2 3) 2
г) HClO3 4) 7
5) 5
Ответ: а)-4); б)-1); в)-2; г)-5
7.) Степень ионности связи убывает в ряду ……..
а) Na2O, Li2O
Ответ: а).
8.) Наименее прочная связь между элементами в молекуле
в) H2Te
Ответ: в)
9.) Дипольные моменты убывают в ряду молекул:
в) HCl, HBr, HI
Ответ: в).
10.) Валентность азота по обменному и донорно – акцепторному механизмам в молекуле NH4Cl равна соответственно:
г) 3 и 1
Ответ: г).
11.) Линейное строение имеет молекула
в) CO2
Ответ: в).
12.) Центральный атом не гибридизирован в
б) H2Se
Ответ: б).
13.) Дипольный момент равен нулю для молекулы
а) N2
Ответ: а).
14.) Свойствами химической связи являются
б) насыщаемость
в) поляризуемость
Ответ: б), в).
15.) Валентность по обменному механизму атома серы в основном и возбужденных состояниях равна
г) 2, 4, 6
Ответ: г).
16.) С ростом межъядерного расстояния в ряду LiF, LiCl, LiBr, LiI энергия связи
б) уменьшается
Ответ: б).
17.) Энергия связи уменьшается в ряду
в) HF, HCl, HBr, HI
Ответ: в).
18.) Валентный угол в ряду H2O, H2S, H2Se, H2Te
а) уменьшается
Ответ: а).
19.) Смещение электронного облака в сторону более электроотрицательного атома, участвующего в образовании связи, характеризует
б) поляризуемость
Ответ: б).
20.) Степень полярности связи оценивается
![]() ,
где
,
где
1.) i а) длина связи
2.) l б) длина диполя
3.) d в) энергия связи
г) ионность связи
Ответ: 1)-г); 2)-а); 3)-б).
3 .2.
МЕТОДЫ ОПИСАНИЯ ХИМИЧЕСКОЙ СВЯЗИ
.2.
МЕТОДЫ ОПИСАНИЯ ХИМИЧЕСКОЙ СВЯЗИ
σ*
1.) Схема σсв соответствует
1S 1S
АО АО МО
образованию молекулы:
б) Н2
О твет:
б).
твет:
б).
2.) Образование - МО из АО неспаренных электронов
σ*
π*
2p2 ( ) ( ) 2p4
2s2![]() πсв
2s2
πсв
2s2
2s2
σсв
соответствует молекуле
б) СО
Ответ: б).
3.) Одним из положений метода ВС является
в) АО при перекрывании не деформируются образуя область повышенной электронной плотности
Ответ: в).
4.) Одним из основных положений метода МО является
г) молекулярная орбиталь – линейная комбинация атомных орбиталей
Ответ: г).
5.) Энергетическая диаграмма соответствует молекуле:
2S 2S
1S σсв 1S
а) Li2
Ответ: а).
6.) Одна - связь и - связь образуется в молекуле
б) HCl
Ответ: б).
7.) Четыре - связи образуются в молекуле:
г) CH4
Ответ: г).
8.) Молекуле С2Н2 имеет
г) три - связи и две - связи
Ответ: г).
9.) - связь образуется в молекуле
в) C2H4
Ответ: в).
10.) Две - связи образуются в молекуле:
а) H2S
Ответ: а).
3.3. КОВАЛЕНТНАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ
1.) Соединения с ковалентной полярной связью записаны в ряду
б) HCl, NO2, H2S
Ответ: б).
2.) Вещества с ионной связью указаны в ряду
а) CaCl2, NaBr, KI
Ответ: а).
3.) Образование ковалентной связи по донорно-акцепторному механизму возможно в молекула
в) NH3
Ответ: в).
4.) Соединения с неполярной ковалентной связью находятся в ряду
г) O2, H2, N2
Ответ: г).
5.) В молекуле N2O все связи
б) ковалентные полярные
Ответ: б).
6.) Образование полярной ковалентной связи возможно при взаимодействии
а) водорода и хлора
Ответ: а).
7.) Водородная связь образуется между молекулами
б) Н2О и Н2О
Ответ: б).
8.) Дипольные моменты уменьшаются HCl, HBr, HI, так как разность электроотрицательностей атомов в этом ряду
в) уменьшается
Ответ: в).
9.) Металлическая связь характерна для
в) натрия, серебра, серы
Ответ: а).
10.) Дипольный момент рассчитывается по формуле:
б)
![]()
Ответ: б).
4.1. СРУКТУРА И СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
1.) Более сильно металлические свойства выражены у атома, имеющего электронную формулу:
б) 1s22s22p63s23p64s2
Ответ: б).
2.) Более сильно неметаллические свойства выражены у атома с электронной конфигурацией
г) ……….3s23p5
Ответ: г).
3.) К щелочным металлам относится атом элемента, имеющий электронную конфигурацию
а) ………6s1
Ответ: а).
4.) К галогенам относится атом элемента с электронной структурой.
s p d
г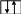
 )
)
s p
Ответ: г).
5.) Атому железа (Z = 26) соответствует электронная формула
б) 1s22s22p63s23p64s23d6
Ответ: б).
6.) К р – электронному семейству относится элементы, имеющие электронные конфигурации
а) ……..3s23p6
д)…….5s24d05p5
Ответ: а), д).
7.) Более сильными электроно – акцепторными свойствами обладает атом с электронной структурой
а)
s p
Ответ: а).
8.) Более активным металлом является атом элемента с электронной конфигурацией
г)…….5s1
Ответ: г).
9.) Электроно-донорные свойства возрастают в ряду
а) N, P, S, Cl
Ответ: а).
10.) Неметаллические свойства убывают в ряду
г) Be, Mg, Ca, Sr
Ответ: г).
4.2. ВЗАИМОСВЯЗЬ СТРУКТУРЫ И СВОЙСТВ СОЕДИНЕНИЙ
1.) В периоде слева направо
б) возрастает энергия ионизации
Ответ: б).
2.) В группе сверху вниз
в) увеличиваются металлические свойства
Ответ: в).
3.) Сродство к электрону в периоде слева направо
б) увеличивается
Ответ: б).
4.) С увеличением порядкового номера от натрия к хлору у элементов
в) металлические свойства ослабевают
Ответ: в).
5.) Окислительная способность уменьшается в ряду:
а) F2, Cl2, Br2, I2
Ответ: а).
6.) Энергия ионизации возрастает в ряду
в) Cs, Rb, K, Na, Li
Ответ: в).
7.) Степень окисления хлора возрастает в ряду соединений
г) HCl, HClO, HClO2, HClO3, , HClO4
Ответ: г).
8.) Атом Mn имеет степень окисления наивысшую в соединении
г) KMnO4
Ответ: г).
9.) Близость физических и химических свойств наблюдается у атомов
а) C, Si, Ge
Ответ: а).
10.) Гидриды с формулой ЭН3 образуют атомы элементов:
б) N, P, As
Ответ: б).
11.) Высшая и низшую степень окисления атом азота имеет в соединениях
а) HNO3, NH4OH
Ответ: а).
12.) Степень окисления атома серы возрастает в ряду соединений
б) H2S, SO2, H2SO4
Ответ: б).
13.) Степень окисления атома фосфора в соединениях Н3РО4, Р2О3, РН3 соответственно равна ……….
г) +5, +3, -3
Ответ: г).
14.) Степень окисления +5 имеет атом мышьяка в соединении
в) H3AsO4
Ответ: в).
15.) Степень окисления атома хлора возрастает в ряду ………
б) HCl, HClO, HClO4
Ответ: б).
16.) Окислительные свойства атома марганца в ряду KMnO4, K2MnO4, MnSO4
б) уменьшаются
Ответ: б).
17.) Наибольшую окислительную активность KMnO4 проявляет
в) в кислой среде
Ответ: в).
18.) Сернистая кислота является окислителем в реакции:
в) H2SO3 + 2H2S = 3S + 3H2O
Ответ: в).
19.) Степень окисления азота уменьшается в ряду соединений …………..
а) NO2, HNO2, NO, NH3
Ответ: а).
20.) Мышьяк является окислителем в реакции
г)As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O
Ответ: г).
21. Восстановление исходной частицы происходит в :
а) MnO4 - → Mn+2
в) Cr2O72- → Cr3+
г) VO3- → V3+
Ответ: а), в), г)
22. Окисление исходной частицы происходит в:
б) MnO2 → MnO42-
г) H2S → S O42-
д) NH3 → N2
Ответ: б),г), д)
23. Кислород проявляет валентность, равную двум, потому что:
в) во внешнем энергетическом уровне нет свободных АО;
Ответ: в)
24. Восстановителем в процессе: Fe2+ + Cr2O72- + H+ → Fe3+ + Cr3+ + H2O
в) Fe2+
Ответ: в)
25. Пары веществ, между которыми не происходит окислительно-восстановительное взаимодействие:
а) H2S и HI
г) NH3 и HCl
Ответ: а), г), д)
26. До каких продуктов может быть окислена вода:
а) O2 и H+
в) H2O2 + H+
Ответ: а), в)
27.Концентрированная азотная кислота реагирует с :
в) Cu
Ответ: в)
28. С раствором NH4OH, образуя комплексное соединение, реагирует:
г) Cu(OH)2
Ответ: г)
29. Электронные уравнения, соответствующие процессу образования SO2 из атомов, это:
г) S0 - 4ē = S+4
O 0 +2ē = O-2
Ответ: г)
30. Молекула H2O, являясь и донором, и акцептором протона превращается при этом соответственно в ионы:
а) гидроксид-анион и катион гидроксония;
Ответ: а)
5.1. ХАРАКТЕРИСТИКА РАСТВОРОВ, СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРИЦИЙ РАСТВОРОВ.
1.) 20 г едкого натра растворили в 500 г воды (М NaOH = 40 г/моль). Моляльная концентрация раствора равна:
б) 1,0 моль/кг
Ответ: б)
2.) 10 г азотной кислоты растворили в 40 мл воды, получив раствор с плотностью 1,115 г/моль. Молярность полученного раствора равна:
а) 3,5 моль/л
Ответ: а)
3.) 10,45 г серной кислоты растворили в 39,55 мл воды. Молярность полученного арствора с плотностью 1,15 г/мл равна:
г) 2,45 моль/л
Ответ: г)
4.) Нормальность раствора едкого кали, в 500 мл которого содержится 112 г КОН, равна:
а) 4 * 10-3 н
Ответ: а)
5.) Процентная концентрация раствора медного купороса (плотностью 1,084 г/мл), полученного при растворении 1,2 г СuSO4 в 13.8 мл воды, равна:
в) 6,0 %
Ответ: В)
6.) Молярная концентрация 2%-ного раствора НСООН с плотностью 1,00 г/мл равна:
г) 0,43 моль/л
Ответ: г)
7.) Нормальная концентрация 2М раствора Hcl равна (М Hcl = 36,5 г/моль)
б) 2 н
Ответ: б)
8.) Молярная концентрация 1 н раствора H2SO4 равна (М H2SO4= 98 г/моль)
в) 0,5 моль/л
Ответ: в)
9.) Смешали 250 мл 5%-ного раствора NaOH и 150 мл 10%-ного раствора NaOH. Процентная концентрация полученного раствора равна … (%)
а) 5,6
Ответ: а)
10.) Слили равные объемы 10%-ного и 25%-ного растворов H2SO4. Процентная концентрация полученного раствора равна … (%)
г) 17,5
Ответ: г)
11.) Для приготовления 5 л 8%-ного раствора Na2SO3 cплотностью 1,075 г/мл потребуется … г сульфита натрия.
а) 430
Ответ: а)
12.) Массовая доля глюкозы в растворе, содержащем 280 г воды и 40 г глюкозы, равна … %
б) 12,5
Ответ: б)
13.) Выпариванием 400 г 50%-ного растовра серной кислоты удалили 100 г воды. Массовая доля H2SO4 в полученном растворе равна … %.
в) 66,7
Ответ: в)
14.) Плотность 25%-ного раствора, 1 мл которого содержит 0,458 г растворенного вещества, равна … г/мл.
г) 1,83
Ответ: г)
15.) Из 75 мл 0,75 н раствора Н3РО4 можно приготовить … мл 0,1 М раствора кислоты
а) 187,5
Ответ: а)
16.) Для приготовления 1 л 0,25 н раствора соды потребуется … мл 2 М раствора Na2CO3
в) 62,5
Ответ: в)
17.) Молярность 9% - ного раствора С12Н22О11 с плотностью 1,035 г/мл равна … моль/л
в) 0,27
Ответ: в)
18.) Нормальность концентрированной соляной кислоты с плотностью 1,18 г/мл, содержащей 36,5 % масс HcI, равна
а) 11,8 н
Ответ: а)
19.) Моляльная концентрация 9%-ного раствора С12Н22О11 с плотностью 1,035 г/мл равна … моль/кг
г) 0,29
Ответ: г)
20.) В 500 мл 0,25 н раствора соды содержится … г Na2CO3
б) 6,63
Ответ: б)
5.2. СВОЙСТВА РАСТВОРОВ.
1.) Раствор, содержащий 60 г мочевины (М в-ва = 60 г/моль) в 500 г воды (К = 1,86), замерзает при температуре … оС:
а) -3,72
Ответ: а)
2.) Температура замерзания 15%-ного раствора уксусной кислоты (М в-ва = 60г/моль,К=1.86оС), равна … оС:
г) – 5,47
Ответ: г)
3.) Молекулярная масса неэлектролита, температура замерзания 10%-ного водного раствора которого равна – 2,58 оС, составляет … г/моль (К = 1.86 оС)
а) 80
Ответ: а)
4.) Температура кипения 20%-ного водного раствора изопропанола (Е = 0,25 оС), равна … оС
б) 102,17
Ответ: 6)
5.) Процентная концентрация водного раствора CO(NH2)2, замерзающего при - 0,93 оС (К = 1.86 оС), составляет
в) 3
Ответ: В)
6.) Раствор неэлектролита, 0,512 г которого растворено в 10 г растворителя, кипит при 46,67 оС (tкип р-ля = 46,20 оС, Е = 2,36 оС). Молярная масса неэлектролита равна … г/моль.
в) 256
Ответ: в)
7.) Температура кипения раствора KNO3 , 9,09 г которого растворено в 100 мл воды, равна … оС ( i = 0,71, Е = 0,52 оС)
а) 100,8
Ответ: а)
8.) Температура замерзания раствора, содержащего в 250 г воды 54 г глюкозы (МС6Н12О6= 98г/моль, К = 1,86 оС), равна … оС
г) – 2,23
Ответ: г)
9.) При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения повысилась на 0,453оС. Молекулярная масса растворенного вещества … г/моль (Е=2,02 оС)
Ответ: 145
10.) Температура кипения водного раствора С12Н22О11 равна 101,4 оС. Температура замерзания этого раствора равна … М (К = 1,86 оС, Е = 0,52 оС)
Ответ: - 3,72
11.) Осмотическое давление 0,5 М раствора глюкозы С6Н12О6 при 25 оС равно
г) 1,24 МПа
Ответ: г)
12.)При 25 оС осмотическое давление некоторого водного раствора равно 1240 КПа. При 0 оС оно составит … КПа
в) 1140 КПА
Ответ: в)
13.) При 315 К давление насыщенного пара над водой составляет 8,2 КПа. При растворении 36 г С6Н12О6 в 540 г воды осмотическое давление над раствором понизится на … Па (температура не изменится)
а) 50
Ответ: а)
14.) При 25 оС давление насыщенного пара воды равно 3,166 кПа. При той же температуре давление насыщенного пара над 5%-ным раствором мочевины СО(NH2)2 (Мв-ва = 60 г/моль) составит … КПа
Ответ: 3,119 КПа
15.) При 25 оС осмотическое давление равно 2,47 КПа. Один литр этого раствора содержит … молей неэлектролита
б) 10-3
Ответ: б)
