- •1 Вопрос.
- •2 Вопрос. Сложение двух гармонических колебаний одинакового направления и частоты
- •12 Билет.
- •1 Вопрос. Явление переноса
- •2 Вопрос. Вынужденные колебания. Резонанс.
- •Здесь же явление переноса!смотрите выше! Вывод уравнения теплопроводности
- •2 Вопрос.
- •14 Билет
- •1 Вопрос.
- •2 Вопрос.
- •15 Билет.
- •1 Вопрос.
- •2 Вопрос.
11 билет
1 Вопрос.
Работа при изобарном расширении газа. Одним из основных термодинамических процессов, совершающихся в большинстве тепловых машин, является процесс расширения газа с совершением работы. Легко определить работу, совершаемую при изобарном расширении газа.
Если при изобарном расширении газа от объема V1 до объема V2 происходит перемещение поршня в цилиндре на расстояние l (рис. 106), то работа A', совершенная газом, равна
![]() ,
(33.1)
,
(33.1)
где p —
давление газа, ![]() —
изменение его объема.
—
изменение его объема.
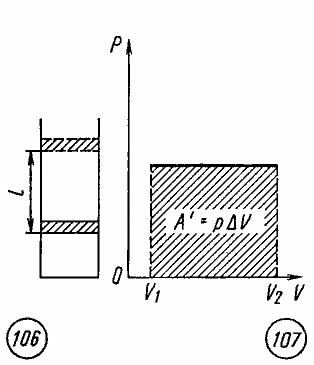
Как видно из рисунка 107, при изображении изобарного процесса расширения газа в координатных осях p , V площадь фигуры, ограниченной графиком процесса, кординатами V1 и V2, осью абсцисс, пропорциональна работе газа A'.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты Q, полученного телом, к соответствующему приращению его температуры T:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая теплоёмкость (С) — это количество теплоты, которую необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которую необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (Сμ) — это количество теплоты, которую необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:
![]()
Где μ - молярная масса
R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
А при постоянном давлении
![]()
2 Вопрос. Сложение двух гармонических колебаний одинакового направления и частоты
При
сложении двух гармонических колебаний
одинакового направления и частоты,
результирующее смещение будет суммой
(![]() )
смещений
)
смещений ![]() и
и ![]() ,
которые запишутся следующими выражениями:
,
которые запишутся следующими выражениями:
![]() ,
, ![]() ,
Сумма
двух гармонических колебаний также
будет гармоническим колебанием той же
круговой частоты:
=
,
Сумма
двух гармонических колебаний также
будет гармоническим колебанием той же
круговой частоты:
= ![]() .
Значения
амплитуды А и начальной фазы φ этого
гармонического колебания будет зависеть
от амплитуд исходных колебаний и их
начальных фаз (Рис. 1.2).
.
Значения
амплитуды А и начальной фазы φ этого
гармонического колебания будет зависеть
от амплитуд исходных колебаний и их
начальных фаз (Рис. 1.2).
|
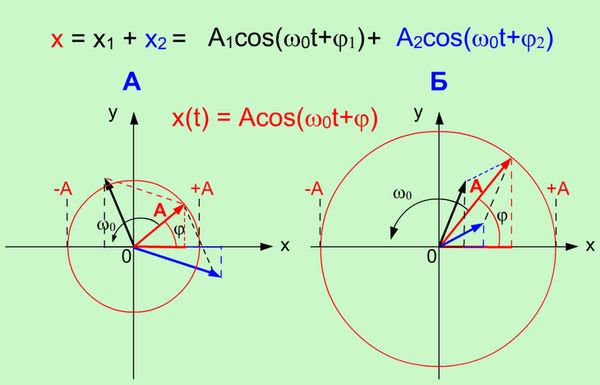
Рисунок 1.2. Сложение двух гармонических колебаний одинакового направления и частоты |
На
рисунке 1.2. приведено два примера А и В
сложения гармонических колебаний с
использованием метода
векторных диаграмм. Из
векторных диаграмм видно, что направление
(начальная фаза φ)
и длина А вектора амплитуды суммарного
гармонического колебания зависит, как
от направления (от начальных фаз), так
и от длины векторов амплитуд исходных
гармонических колебаний.
Если
угол (разность фаз:
Δφ = φ1 - φ2)
между векторами А1 и А2 равен
0, то исходные колебания находятся
в фазе и
суммарная амплитуда (А =А1 +А2)
будет максимальна. Если угол (разность
фаз: Δφ = φ1 - φ2)
между векторами А1 и А2 равен
- π или π, то исходные колебания находятся
в противофазе и
суммарная амплитуда (А = ![]() А1 -А2
)
будет минимальна.
А1 -А2
)
будет минимальна.