
- •Ответы на билеты по химии
- •1. Периодический закон и периодическая система химических элементов д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Предельные углеводороды
- •Строение молекулы метана
- •Разложение
- •Билет №2
- •2. Непредельные углеводороды ряда этилена (алкены)
- •1. Строение алкенов
- •Физические и химические свойства :
- •Отдельные представители
- •Билет №3.
- •1. Виды химической связи и способы ее образования в неорганических соединениях: ковалентная (полярная, неполярная, простые и кратные связи), ионная, водородная.
- •Химические свойства
- •1. Классификация химических реакций
- •2. Крахмал, целлюлоза
- •Билет 5.
- •1. Обратимость химических реакций, химическое равновесие
- •2. Ацетилен…
- •1. Скорость химических реакций
- •Катализ и катализаторы
- •2. Ароматические углеводороды (арены)
- •1. Основные положения теории химического строения а.М. Бутлерова
- •1. Изомерия органических соединений и ее виды.
- •2. Классификация оксидов
- •1. Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
- •2. Фенол…
- •2. Предельные одноатомные спирты
- •2. Жиры, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах.
- •1. Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
- •2. Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
- •1. Основания, их классификация и химические свойства на основе представлений об электролитической диссоциации.
- •2. Глюкоза — представитель моносахаридов, химическое строение, физические и химические свойства, применение.
- •1. Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
- •2. Взаимное влияние атомов в молекулах органических веществ на примере этанола и фенола.
- •Алюминий…
- •2. Анилин
- •Физические свойства
- •Важнейшие химические свойства анилина
- •Применение
- •2. Белки
- •Структура белка
- •Физические свойства
- •Химические свойства
- •Функции белков в организме
1. Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
2. Фенол…
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Простейший представитель этого класса — собственно фенол, С6Н5ОН.

фенол
Строение фенола. Одна из двух неподеленных электронных пар атома кислорода втягивается в -электронную систему бензольного кольца. Это приводит к двум эффектам: а) увеличивается электронная плотность в бензольном кольце, причем максимумы электронной плотности находятся в орто- и параположениях по отношению к группе ОН; б) электронная плотность на атоме кислорода, напротив, уменьшается, что приводит к ослаблению связи О―Н. Первый эффект проявляется в высокой активности фенола в реакциях электрофильного замещения, а второй - в повышенной кислотности фенола по сравнению с предельными спиртами.
Физические свойства. Фенолы в большинстве своем — кристаллические вещества (метакрезол — жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в холодной воде, но хорошо - в горячей и особенно в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения и плавления. Так, собственно фенол представляет собой бесцветные кристаллы с tпл = 41 °С и tкип =182 °С. С течением времени кристаллы краснеют и темнеют.
Получение фенолов.
Фенолы в значительных количествах содержатся каменноугольной смоле. Фенол получают также сплавлением натриевой соли бензолсульфокислоты с едким натром.
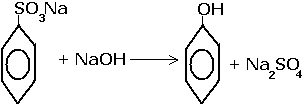
Химические свойства фенола.
У фенола ярко выражены кислотные свойства. Это связано с тем, что свободная электронная пара кислорода в феноле оттянута к ядру.

При взаимодействии фенола со щелочами образуются соли - феноляты

Фенол, за счёт гидроксильной группы будет взаимодействовать со щелочными металлами.

С галогенами фенолы взаимодействуютза счёт замещения водорода бензольного кольца.

Применение фенолов.
Фенол используется в производстве пластических масс, пикриновой кислоты, красителей, средств для борьбы с насекомыми. Все фенолы обдадают бактерицидным действием, поэтому они применяются в качестве дезинфицирующих средств в медицине и ветеринарии.
Билет 10.
1.
Неметаллы, их положение в периодической
системе химических элементов Д. И.
Менделеева, строение их атомов.
Окислительно-восстановительные свойства
неметаллов на примере элементов подгруппы
кислорода.




2. Предельные одноатомные спирты
Органические соединения, в молекулах которых с предельным углеводородным радикалом связана одна гидроксильная группа, называются предельными одноатомными спиртами.
Общая формула: CnH2n+1OH или R-OH
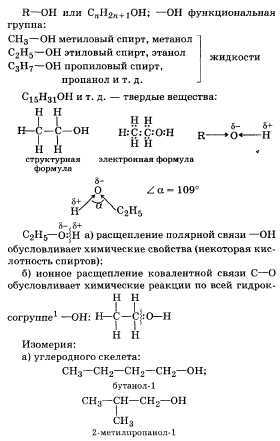
Химические свойства
1.Реакции с участием гидроксогруппы (OH)
1)взаимодействуют со щелочными металлами
2C2H5 OH+2Na--->2C2H5 ONa + H2
2)взаимодействуют с галогеноводородными кислотами
C2H5 OH + HBr--->C2H5Br +HOH
3)реакции этерификации
(при этом образуются сложные эфиры)
CH3-COOH + OH-C2H5 →HOH + CH3-CO– O -C2H5 (t°, к.H2SO4 )
4)дегидратация спиртов
а) внутримолекулярная
H3С-СH2OH →CH2=CH2 + H2O (t°>140°С, к.H2SO4 в избытке)
б) межмолекулярная (t°<140°С, к.H2SO4 )
2 C2H5 OH →H2O + C2H5 -O–C2H5
2.Реакции окисления
1)горение - полное окисление
C2H5 OH + 3O2→2CO2 + 3H2O
2)окисление окислителями
H3C-CН2-OH + CuO → H2O + Cu + CH3-CОH (t°)

![]()
Билет 11. |
1. Электрохимический ряд напряжений
металлов. Вытеснение металлов из
растворов солей другими
металлами.
|
2.
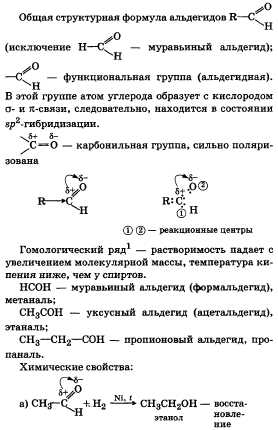
Альдегиды, их химическое строение
и свойства. Получение, применение
муравьиного и уксусного альдегидов.

Билет 12.
1.
Водородные соединения неметаллов.
Закономерности в изменении их свойств
в связи с положением химических элементов
в периодической системе Д. И. Менделеева.




2.
Предельные одноосновные карбоновые-
кислоты, их строение и свойства на
примере уксусной кислоты.




Билет 13.
1. Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na2O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов:
![]()
Молекулярные оксиды р-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам наглядно проявляется у оксидов элементов 3-го периода.




