
- •По классам аминоацил-тРнк-синтетаз Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- •Стереохимия аминокислот
- •Конфигурации пептидной связи
- •8. Белки. Классификация белков. Функции белков.
- •9. Методы выделения и очистки белков: диализ, ультрафильтрация, центрифугирование, гель-хроматография, электрофорез, ионная, аффинная и гидрофобная хроматографии.
- •10. Получение генноинженерных белков.
- •11. Первичная структура белка. Этапы установления первичной структуры белка. Аминокислотный состав. Определение n- и с-концевых аминокислот.
Конфигурации пептидной связи
Для планарной пептидной связи возможны две конфигурации:
-
Транс-конфигурация,
-
Цис-конфигурация.
В транс-конфигурации α-атомы углерода и боковые цепи расположены по разные стороны пептидной связи, в то время как в цис-конфигурации – с одной и той же. «Транс» – форма пептидных связей значительно более широко распространена (встречаясь в 99,6% случаев), нежели «цис», из-за того, что в последнем случае велика вероятность пространственного столкновения между боковыми группами аминокислот.
Исключением является аминокислота пролин [7], если она будет соединена через аминогруппу с какой-либо другой аминокислотой. Пролин – единственная из протеиногенных аминокислот, содержащих около Cα не первоначальную, а вторичную аминогруппу. В ней атом азота связан с двумя атомами углерода, а не с одним, как у других аминокислот. У пролина, включенного в пептид, заместители при атоме азота отличаются не так сильно, как в других аминокислотах. Поэтому разница между «транс» и «цис» конфигурациями весьма незначительна, ни одна из них не имеет энергетического преимущества.

6. Синтез пептидов. Типы пептидного синтеза, стратегия синтеза. Твердофазный синтез пептидов.





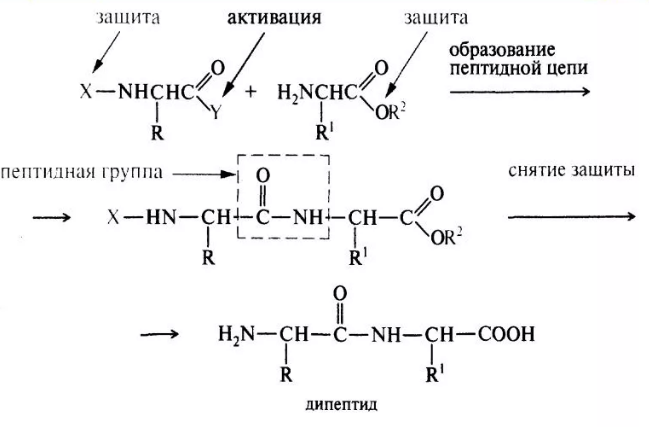
7. Использование ферментов в синтезе пептидов. Семисинтез. (полусинтез)Сравнительная характеристика методов синтеза пептидов.
Ферментативный синтез. Некоторые биологические катализаторы, гидролизующие пептидные связи, в определенных условиях способны катализировать обратныую реакцию, а именно образовывать пептидные связи между отдельными аминокислотами. Одним из таких способов смещения равновесия каталитической реакции является ее проведение в органическом растворителе в присутствии небольших количеств воды.

Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды дают возможность подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов даёт возможность выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большая часть терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
