
- •По классам аминоацил-тРнк-синтетаз Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- •Стереохимия аминокислот
- •Конфигурации пептидной связи
- •8. Белки. Классификация белков. Функции белков.
- •9. Методы выделения и очистки белков: диализ, ультрафильтрация, центрифугирование, гель-хроматография, электрофорез, ионная, аффинная и гидрофобная хроматографии.
- •10. Получение генноинженерных белков.
- •11. Первичная структура белка. Этапы установления первичной структуры белка. Аминокислотный состав. Определение n- и с-концевых аминокислот.
10. Получение генноинженерных белков.



11. Первичная структура белка. Этапы установления первичной структуры белка. Аминокислотный состав. Определение n- и с-концевых аминокислот.
Первичная структура
Линейную последовательность аминокислотных остатков в полипептидной цепи называют "первичная структура белка".


12. Установление последовательности аминокислотных звеньев ступенчатой деградацией по Эдману.(и конец 11)


14. Фрагментация полипептидной цепи: химические и ферментативные методы гидролиза.
Ферментативный метод вкратце

Поподробнее
трипсин









Химотрипсин


Термолизин



Хим расщепление





15. Конформация полипептидной цепи в белках. Вторичная структура белка. Спиральные структуры. Складчатые структуры.
В белках различают два уровня конформации пептидных цепей — вторичную
И третичную структуры.
Вторичная структура белков
Вторичная структура белков обусловлена прежде всего свойствами пептидного остова. Карбонильная группа и NH –группа способны образовывать водородную связь между собой:
I I
C = O - H N
I I
Минимуму
свободной энергии соответствует такое
состояние пептида, когда все эти группы
связаны водородной связью. Пептид
стремится принять конформацию с
максимумом водородных связей. Однако
возможность их образования ограничивается
тем, что пептидная связь имеет частично
двойной характер, поэтому вращение
вокруг нее затруднено. Пептидная цепь
приобретает не произвольную, а строго
определенную конформацию, фиксируемую
водородными связями. Известны несколько
способов укладки полипептидной
цепи: a -спираль - образуется
внутрицепочечными водородными связями
между NH-группой одного остатка аминокислоты
и CO-группой четвертого от нее
остатка; b -структура (складчатый
лист) - образуется межцепочечными
водородными связями или связями между
участками одной полипептидной цепи
изогнутой в обратном направлении;
беспорядочный клубок - это участки, не
имеющие правильной, периодической
пространственной организации. Но
конформация этих участков также строго
обусловлена аминокислотной
последовательностью. Содержание a -спиралей
и b -структур в разных белках
различно: у фибриллярных белков -
только a -спираль или только b -складчатый
лист; а у глобулярных белков - отдельные
фрагменты полипептидной цепи:
либо a -спираль, либо b -складчатый
лист, либо беспорядочный клубок.
Альфа-СПИРАЛЬ
Наиболее распространенным элементом вторичной структуры является правая α-спираль (αR). Пептидная цепь здесь изгибается винтообразно (ось выделена оранжевым цветом). Ha каждый виток приходится 3,6 аминокислотного остатка, шаг винта (т.е. минимальное расстояние между двумя эквивалентными точками) составляет 0,54 нм. α-Спираль стабилизирована почти линейными водородными связями между NH-группой и СО-группой четвертого по счету аминокислотного остатка. Таким образом, в протяженных спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей. Неполярные или амфифильные α-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах.
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Складчатые структуры
Две следующие почти вытянутые конформации пептидной цепи называются "β-складчатым листом", так как плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B складчатых структурах также образуются поперечные межцепочечные водородные связи. Если цепи ориентированы в противоположных направлениях (1), структура называется антипараллельным складчатым листом (βα), а если цепи ориентированы в одном направлении (2), структура называется параллельным складчатым листом (βn). В складчатых структурах α-С-атомы располагаются на перегибах, а боковые цепи ориентированы почти перпендикулярно средней плоскости листа, попеременно вверх и вниз. Энергетически более предпочтительной оказывается βα-складчатая структура с почти линейными H-мостиками. В растянутых складчатых листах отдельные цепи чаще всего не параллельны, а несколько изогнуты относительно друг друга.
β-Петля
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка расположены таким образом, что цепь делает реверсивный поворот (на 180о). Оба приведенных на схеме варианта петли (типы I и II) встречаются довольно часто. Обе структуры стабилизированы водородным мостиком между 1 и 4 остатками.
16. Понятие о третичной и четвертичной структуре белка. Методы установления пространственной структуры белков. Денатурация и ренатурация белков.
Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей a -спирали, b -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. Существует несколько видов взаимодействия между R-группами, в основном нековалентного характера:

Третичная структура в значительной степени определяется первичной структурой.
В стабилизации третичной структуры белка принимают участие:
-
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
-
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
-
водородные связи;
-
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Т.о. третичная структура определяет форму белковой молекулы:
- глобулярные белки (форма клубка с неровной поверхностью);
- фибриллярные белки (форма вытянутых нитей, они выполняют опорные функции).
Свои биологические функции белки проявляют на уровне третичной и четвертичной структуры.
Четвертичная структура белка– это способ укладки в пространстве нескольких полипептидных цепей, имеющих первичную, вторичную и третичную структуры. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных нековалентными связями. Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами.
Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждый протомер взаимодействует с другим во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.


Денатурация может быть:
-
Обратимой, если возможно восстановление свойственной белку структуры. Такой денатурации подвергаются, например, рецепторные белки мембраны.
-
Необратимой, если восстановление пространственной конфигурации белка невозможно. Обычно это происходит при разрыве большого количества связей, например, при варке яиц.(ваще научились восстанавливать, но на всякий будем помнить и об этом)
17. Ферменты. Классификация и номенклатура ферментов. Строение ферментов и понятие об активном центре. Специфичность действия ферментов.

ФЕРМЕНТЫ (от лат. fermentum - закваска) (энзимы), белки, выполняющие роль катализаторов в живых организмах. Осн. ф-ции ферментов- ускорять превращение в-в, поступающих в организм и образующихся при метаболизме (для обновления клеточных структур, для обеспечения его энергией и др.), а также регулировать биохим. процессы (напр., реализацию ге-нетич. информации), в т. ч. в ответ на изменяющиеся условия.
Классификация
-
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза».
-
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза».
-
Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы и др.
-
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты.
-
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза»
-
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества.
Номенкл
Номенклатура ферментов. На первых этапах развития энзимологии названия ферментам давали их первооткрыватели по случайным признакам (тривиальная номенклатура). Например, к тривиальным относятся названия ферментов: пепсин, трипсин, химотрипсин. Первая попытка ввести правило для названий ферментов была предпринята Е. Дюкло в 1898 г. (рациональная номенклатура). Согласно рациональной номенклатуре, простой фермент называли по названию субстрата с добавлением окончания -аза (ДНКаза, РНКаза, амилаза, уреаза). Для названия холофермента по рациональной номенклатуре использовали название кофермента (пиридоксальфермент, геминфермент). Позднее в названии фермента стали использовать название субстрата и тип катализируемой реакции (алкогольдегидрогеназа).
В 1961 г. V Международный биохимичекий конгресс, проходивший в Москве, утвердил научную номенклатуру ферментов. Согласно этой номенклатуре название фермента складывается из химического названия субстрата (субстратов), на который действует фермент, типа катализируемой реакции и окончания -аза. Например, фермент, осуществляющий гидролиз мочевины (рациональное название - уреаза), по научной номенклатуре называют карбамидамидогидролазой


Активный центр фермента — участок поверхности молекулы фермента, непосредственно взаимодействующий с молекулой субстрата. Образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Возникает на уровне третичной структуры белка-фермента.
В его пределах различают три области:
1) каталитический центр — область (зона) активного центра фермента, непосредственно участвующая в химических преобразованиях субстрата. Формируется за счет радикалов 2–3 аминокислот. Если фермент — сложный белок, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента — кофермент (например, все водорастворимые витамины и жирорастворимый витамин K);
2) адсорбционный центр — участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Формируется 1, 2, чаще 3 радикалами аминокислот, расположенными рядом с каталитическим центром.
3) аллостерические центры — такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит — обратимо) с тем или иным веществом (лигандом). Это связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами, или аллостерическими ингибиторами данного фермента.
Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
18. Принципы ферментативной кинетики. Влияние на скорость ферментативной реакции концентрации фермента, концентрации субстрата, температуры, рН среды. Конкурентное и неконкурентное ингибирование.
Ферментативная кинетика – это наука,изучающая закономерности влияние природы реагирующих веществ и сопутствующих факторов на скорости ферментативных реакций.
Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Скорость ферментативной реакции - мера каталитической активности фермента, её обозначают как активность фермента.
Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.

Km = концентрации субстрата, при которой скорость реакции соответствует половине максимальной скорости. Km имеет размерность моль л-1. Величина Km не имеет строго фиксированного значения. Она может меняться в зависимости от структуры субстрата, от рН среды, температуры.
Михаэлис и Ментен вывели уравнение, которое выражает количественное соотношение между скоростью ферментативной реакции и концентрацией субстрата при условии, что известны максимальная скорость (Vmax) и объединенная константа, константа Михаэлиса (Km).

Его можно алгебраически преобразовать в другие формы, более удобные для графического представления экспериментальных результатов. Одно из самых распространенных преобразований сводится к тому, что приравнивают друг другу величины обратные левой и правой части уравнения Михаэлиса-Ментена.

Это уравнение называется уравнением Лайнуивера-Берка.Тангенс угла наклона прямой равен Km/ Vmax, отрезок, отсекаемый прямой на оси абцисс равен -1/ Km. Отрезок, отсекаемый прямой на оси ординат равен 1/Vmax. Следовательно, из этого графика легко можно точно определить значения Vmax и Km.
Зависимость скорости ферментативной реакции от количества ферментов

Зависимость накопления продукта (А) и убыли субстрата (Б) от времени (продолжительности) протекания реакции. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени. В реакциях, катализируемых ферментами 1 и 2, начальная скорость реакции, катализируемой ферментом 1, ниже, чем скорость реакции, катализируемой ферментом 2, так как тангенс угла наклона касательной к кривой профиля реакции, проведённой из "О" точки у второго фермента выше, как в случае накопления продукта (А), так и убыли субстрата (Б). Скорость в любой момент времени t определяется тангенсом угла наклона касательной к профилю реакции в момент времени t.

К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата

Неконкурентным
называют такое ингибирование ферментативной
реакции, при котором ингибитор
взаимодействует с ферментом в участке,
отличном от активного центра. Неконкурентные
ингибиторы не являются структурными
аналогами субстрата.

19. Нуклеиновые кислоты: биологическая роль, строение и классификация. Структурные компоненты нуклеиновых кислот: гетероциклические основания, углеводы, фосфорная кислота.
Нуклеиновые кислоты – это высокомолекулярные органические соединения, биополимеры, образованные остатками нуклеотидов. Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты (фосфодиэфирная связь). Различают два класса нуклеиновых кислот:
- дезоксирибонуклеиновая кислота (ДНК). Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые тимин (T) и цитозин (C).
- рибонуклеиновая кислота (РНК). Сахар — рибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые урацил (U) и цитозин (C).
Биологическая роль нуклеиновых кислот заключается в том, что ДНК хранит наследственную информацию организма в виде последовательности дезоксирибонуклеотидов, различающихся азотистыми основаниями.
Рибосомные РНК (рРНК) Они содержатся в рибосомах - внутриклеточных органеллах, принимающих участие в биосинтезе белка.
Матричные РНК (мРНК) Функция мРНК заключается в переносе генетической информации, записанной в ДНК, на синтезируемый белок.
Функции тРНК заключаются в доставке аминокислот к рибосомам, взаимодействии с мРНК и рибосомами в процессе биосинтеза белка.


И остаток фосфорной кислоты.
Строение ДНК

20. Гетероциклические основания пиримидинового и пуринового ряда: физико-химические свойства. Минорные компоненты нуклеиновых кислот.
Пуриновые Пиримидиновые


Пуриновые и пиримидиновые основания характеризуются высокой температурой плавления (>300 °С). Рентгеноструктурный анализ пуриновых и пиримидиновых оснований показал, что молекулы пиримидинов имеют плоское, а молекулы пуринов -- псевдоплоское строение. Пурины и пиримидины представляют собой слабые основания.
19. Нуклеиновые кислоты: биологическая роль, строение и классификация. Структурные компоненты нуклеиновых кислот: гетероциклические основания, углеводы, фосфорная кислота.
НУКЛЕИНОВЫЕ КИСЛОТЫ –(био роль) биологические полимерные молекулы, хранящие всю информацию об отдельном живом организме, определяющие его рост и развитие, а также наследственные признаки, передаваемые следующему поколению. Нуклеиновые кислоты есть ядрах клеток всех растительных и животных организмов, что определило их название (лат. nucleus – ядро). С химической точки зрения синтез нуклеиновой кислоты - это полимеризация, т.е. последовательное присоединение строительных блоков. Такими блоками служат нуклеозидтрифосфаты.
Установление состава нуклеиновых кислот путем их последовательного гидролитического расщепления позволяет выделить следующие структурные компоненты.

(КОМПОНЕНТЫ)Гетероциклические основания, входящие в состав нуклеиновых кислот (нуклеиновые основания), — это гидрокси- и аминопроизводные пиримидина и пурина. Нуклеиновые кислоты содержат три гетероциклических основания с пиримидиновым циклом (пиримидиновые основания) и два — с пуриновым циклом (пуриновые основания). Нуклеиновые основания имеют тривиальные названия и соответствующие однобуквенные обозначения.

В составе нуклеиновых кислот гетероциклические основания находятся в термодинамически стабильной оксоформе. Кроме этих групп нуклеиновых оснований, называемых основными, в нуклеиновых кислотах в небольших количествах встречаются минорные основания: 6-оксопурин (гипоксантин), 3-N-метилурацил, 1-N-метилгуанин и др.
УГЛЕВОДЫ:Нуклеиновые кислоты включают остатки моносахаридов – D-рибозы и 2-дезокси –D-рибозы. Оба моносахарида присутствуют в нуклеиновых кислотах в b -фуранозной форме.

ФОСФОРНАЯ КИСЛОТА:Остатки фосфорной кислоты (H3PO4) входят в состав нуклеотидов и этерифицируют D-рибозу и 2-дезокси-D-рибозу в положениях 3 и 5. В этой связи нуклеотиды и полинуклеотиды можно рассматривать, с одной стороны, как сложные эфиры нуклеозидов (фосфаты), а с другой как кислоты.
Остатки моносахаридов и фосфорной кислоты выполняют структурную функцию и являются носителями гетероциклических оснований.
СТРОЕНИЕ:Полимерные формы нуклеиновых кислот называют полинуклеотидами.
Существуют 4 уровня структурной организации нуклеиновых кислот: первичная, вторичная, третичная и четвертичная. Первичная структура представляет собой цепочки из нуклеотидов соединяющихся через остаток фосфорной кислоты (фосфодиэфирная связь). Вторичная структура - это две цепи нуклеиновых кислот соединённые водородными связями. Стоит отметить, что цепи соединяются по типу "голова-хвост" (3' к 5'), по принципу комплементарности (азотистые основания находятся внутри этой структуры). Третичная структура, или же спираль, образуется за счет радикалов азотистых оснований (образуются водородные дополнительные связи, которые и сворачивают эту структуру, тем самым обуславливая её прочность). И наконец 4 структура - это комплексы гистонов и нитей хроматина.
Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот — дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК).
Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, аденозинтрифосфорная кислота, важнейший аккумулятор энергии в клетке.
Классификация: ДНК и РНК.
Структура ДНК. В окончательном варианте полимерная молекула ДНК содержит в боковом обрамлении азотсодержащие гетероциклы. В образовании ДНК участвуют четыре типа таких соединений, два из них представляют собой шестичленные циклы, а два – конденсированные циклы, где шестичленное кольцо спаяно с пятичленным(аденин, тимин, гуанин, цитозин)


На втором этапе сборки к свободным группам ОН дезоксирибозы присоединяются показанные выше азотсодержащие гетероциклические соединения, образуя у полимерной цепи боковые подвески

Присоединенные к полимерной цепи молекулы аденина, тимина, гуанина и цитозина обозначают первыми буквами названий исходных соединений, то есть, А, Т, Г и Ц.
Сама полимерная цепь ДНК имеет определенную направленность – при мысленном продвижении вдоль молекулы в прямом и обратном направлении одни и те же группировки, входящие в состав цепи, встречаются на пути в разной последовательности. При движении в одном направлении от одного атома фосфора к другому вначале на пути следования идет группа СН2, а затем две группы СН (атомы кислорода можно не принимать во внимание), при движении в противоположном направлении последовательность этих групп будет обратной
*НАПРАВЛЕННОСТЬ ПОЛИМЕРНОЙ ЦЕПИ ДНК. При описании того, в каком порядке чередуются присоединенные гетероциклы, принято использовать прямое направление, то есть от группы СН2 к группам СН.*

На следующей стадии две молекулы ДНК объединяются, располагаясь таким образом, чтобы начало и концы цепей были направлены в противоположные стороны. В этом случае гетероциклы двух цепей обращены навстречу друг другу и оказываются расположенными неким оптимальным образом, имеется в виду, что между парами группировок С=О и NH2 , а также между єN и NH=, входящими в состав гетероциклов, возникают водородные связи. Ниже показано, как располагаются две цепи относительно друг друга и как при этом возникают водородные связи между гетероциклами. Самая важная деталь – состоит в том, что пары, связанные водородными связями, жестко определены: фрагмент А всегда взаимодействует с Т, а фрагмент Г – всегда с Ц. Строго определенная геометрия этих групп приводит к тому, что эти пары исключительно точно подходят друг другу (как ключ к замку), пара А-Т связана двумя водородными связями, а пара Г-Ц – тремя связями.
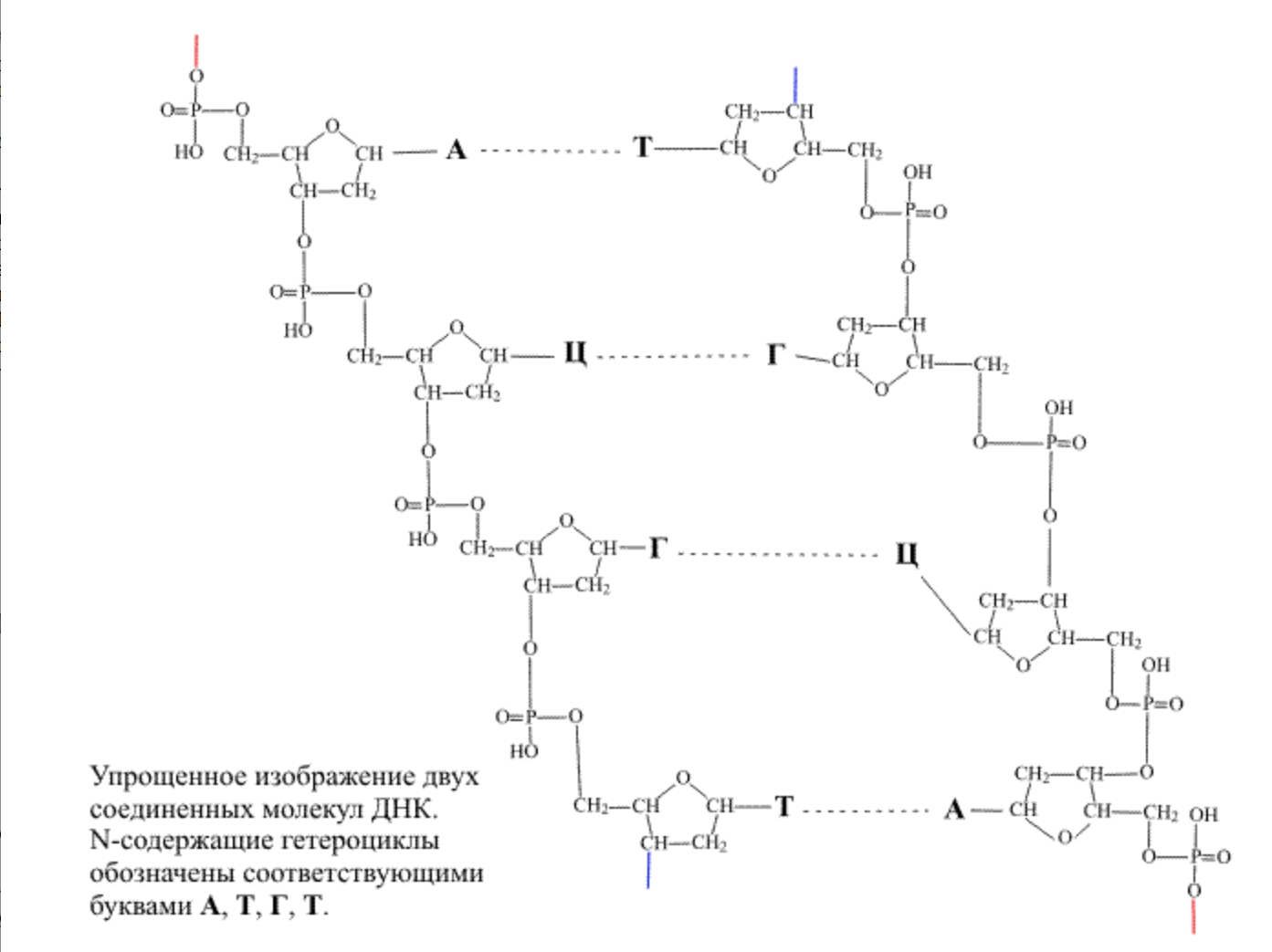
Водородные связи заметно слабее обычных валентных связей, но из-за большого их количества вдоль всей полимерной молекулы соединение двух цепей становится достаточно прочным. В молекуле ДНК содержится десятки тысяч групп А, Т, Г и Ц и порядок их чередования в пределах одной полимерной молекулы может быть различным, например, на определенном участке цепи последовательность может иметь вид: -А-А-Т-Г-Ц-Г-А-Т-. Поскольку взаимодействующие группы строго определены, то на противолежащем участке второй полимерной молекулы обязательно будет последовательность –Т-Т-А-Ц-Г-Ц-Т-А-. Таким образом, зная порядок расположения гетероциклов в одной цепи, можно указать их размещение в другой цепи. Из этого соответствия следует, что суммарно в сдвоенной молекуле ДНК количество групп А равно количеству групп Т, а количество групп Г – количеству Ц(правило Э.Чаргаффа).
Во время поворота всей конструкции вокруг вертикальной оси (рис. 8) отчетливо видна спиральная форма двух полимерных молекул, которые как бы навиты на поверхность цилиндра, это широко известная двойная спираль ДНК.

Строение полимерной цепи и обязательное присутствие четырех типов гетероциклов однотипно для всех представителей живого мира. У всех животных и высших растений количество пар А – Т всегда несколько больше, чем пар Г – Ц. Отличие ДНК млекопитающих от ДНК растений в том, что у млекопитающих пара А – Т на всем протяжении цепи встречается ненамного чаще (приблизительно в 1,2 раза), чем пара Г – Ц. В случае растений предпочтительность первой пары гораздо более заметна (приблизительно в 1,6 раза).
Химические свойства ДНК. При действии щелочей двойная спираль распадается на две составляющие цепи, которые вновь могут объединиться, если вернуться к исходным условиям. В слабокислых условиях происходит гидролиз, в результате частично расщепляются фрагменты –Р-О-СН2- с образованием фрагментов –Р-ОН и НО-СН2 , соответственно результате образуются мономерные, димерные (сдвоенные) или тримерные (утроенные) кислоты, представляющие собой звенья, из которых была собрана цепь ДНК.
Более глубокий гидролиз позволяет отделить участки дезоксирибозы от фосфорной кислоты, а также группировку Г от дезоксирибозы. При действии сильных кислот (помимо распада фрагментов –Р(О)-О-СН2-) отщепляются и группировки А и Г. Действие иных реагентов (например, гидразина) позволяет отделить группировки Т и Ц. Более деликатное расщепление ДНК на компоненты проводят с помощью биологического препарата – дезоксирибонуклеазы, выделяемой из поджелудочной железы (окончание -аза всегда указывает на то, что данное вещество представляет собой катализатор биологического происхождения – фермент). Начальная часть названия – дезоксирибонуклеаза – указывает, какое именно соединение расщепляет этот фермент. Все указанные способы расщепления ДНК ориентированы, в первую очередь, на детальный анализ ее состава.
Самая важная информация, содержащаяся в молекуле ДНК, – порядок чередования групп А, Т, Г и Ц . Для этого создан широкий набор ферментов, которые находят в молекуле ДНК строго определенную последовательность, например, Ц-T-Г-Ц-A-Г (а также соответствующую ей последовательность на противоположной цепи Г-А-Ц-Г-Т-Ц) и вычленяют ее из состава цепи. лее сопоставляются результаты, полученные при действии широкого набора различных ферментов по заранее разработанной схеме, в результате удается определить последовательность таких групп на определенном участке ДНК.
Структура РНК во многом напоминает ДНК, отличие в том, что в основной цепи фрагменты фосфорной кислоты чередуются с рибозой, а не с дезоксирибозой (рис.). Второе отличие – к боковому обрамлению присоединяется гетероцикл урацил (У) вместо тимина (Т), остальные гетероциклы А, Г и Ц те же, что у ДНК. Урацил отличается от тимина отсутствием метильной группы, присоединенной к циклу, на рис. 10 эта метильная группа выделена красным цветом.
Участие ДНК и РНК в синтезе белков – одна из основных функций нуклеиновых кислот. Белки – важнейшие компоненты каждого живого организма. Мышцы, внутренние органы, костная ткань, кожный и волосяной покров млекопитающих состоят из белков. Это полимерные соединения, которые собираются в живом организме из различных аминокислот. В такой сборке управляющую роль играют нуклеиновые кислоты, процесс проходит в две стадии, причем на каждой из них определяющий фактор – взаимоориентация азотсодержащих гетероциклов ДНК и РНК.
Основная задача ДНК – хранить записанную информацию и предоставлять в тот момент, когда начинается синтез белков. В связи с этим понятна повышенная химическая устойчивость ДНК в сравнении с РНК. Природа позаботилась о том, чтобы сохранить по возможности основную информацию неприкосновенной.
источник: http://files.school-collection.edu.ru/dlrstore/87e74361-fdd9-6577-e717-41c1f5a40b59/1011832A.htm
20. Гетероциклические основания пиримидинового и пуринового ряда: физико-химические свойства. Минорные компоненты нуклеиновых кислот.
Пиримидиновый ряд: Урацил(Ura) только РНК, цитозин(Cyt) РНК, тимин(Thy) только ДНК.
Пуриновый ряд: аденин(Ade), гуанин(Gua).
Свойства гетероциклов: малорастворимы в воде; слабые основания ввиду азотистых функций в цикле; активные гетероциклы.

Помимо главных пиримидиновых оснований, в составе нуклеиновых кислот открыты минорные пиримидиновые основания, 5-метил- и 5-окси-метилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, 5-карбоксиурацил, 4-тиоурацил и др. Забегая несколько вперед, укажем, что только для тРНК список минорных оснований приближается к 50. На долю минорных оснований приходится до 10% всехнуклеотидов тРНК, что имеет, очевидно, важный физиологический смысл (защита молекулы РНК от действия гидролитических ферментов). Структурные формулы ряда минорных пиримидиновых основанийпредставлены в форме нуклеозидов – соединений с углеводным компонентом:

21. Нуклеозиды. Классификация и номенклатура. Строение нуклеозидов, тип гликозидной связи и ее конфигурация.
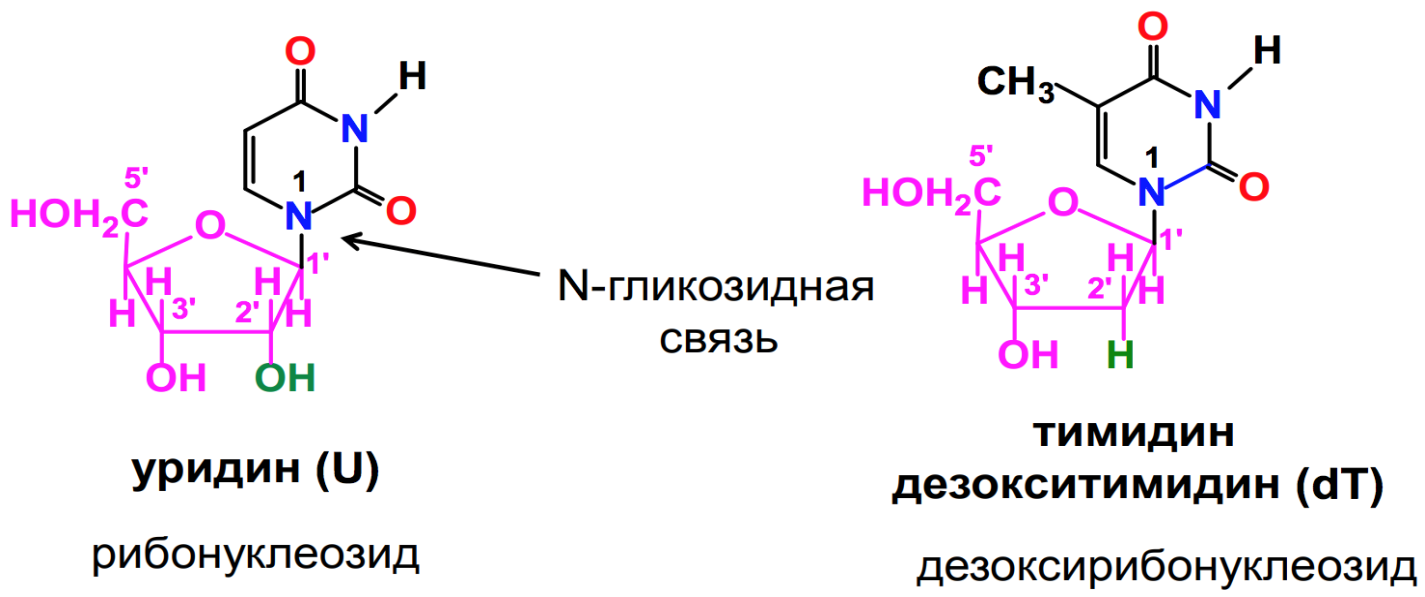
Нуклеозиды – это N-гликозиды, образованные нуклеиновыми основаниями и рибозой или дезоксирибозой.
Между аномерным атомом углерода моносахарида и атомом азота в положении 1 пиримидинового цикла или атомом азота в положении 9 пуринового цикла образуется b -гликозидная связь.

В зависимости от природы моносахаридного остатка нуклеозиды делят на рибонуклеозиды (содержат остаток рибозы) и дезоксирибонуклеозиды(содержат остаток дезоксирибозы). Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание –идин для производных пиримидина и -озин для производных пурина. К названиям дезоксирибонуклеозидов добавляют приставку дезокси-. Исключение составляет нуклеозид, образованный тимином и дезоксирибозой, к которому приставка дезокси- не добавляется, так как тимин образует нуклеозиды с рибозой лишь в очень редких случаях.

Для обозначения нуклеозидов используются однобуквенные обозначения, входящих в их состав нуклеиновых оснований. К обозначениям дезоксирибонуклеозидов ( за исключением тимидина) добавляется буква ”д”.
Наряду с представленными на схеме основными нуклеозидами в составе нуклеиновых кислот встречаются минорные нуклеозиды, содержащие модифицированные нуклеиновые основания (см. выше).
В природе нуклеозиды встречаются также в свободном состоянии, преимущественно в виде нуклеозидных антибиотиков, которые проявляют противоопухолевую активность. Нуклеозиды-антибиотики имеют некоторые отличия от обычных нуклеозидов в строении либо углеводной части, либо гетероциклического основания, что позволяет им выступать в качестве антиметаболитов, чем и объясняется их антибиотическая активность.
Как N-гликозиды, нуклеозиды устойчивы к действию щелочей, но расщепляются под действием кислот с образованием свободного моносахарида и нуклеинового основания. Пуриновые нуклеозиды гидролизуются значительно легче пиримидиновых.


5-метил-2'-дезоксицитидин
(обозначается m5dC;
ф-ла
I,
X = Н, Y = СН3;
dRib-остаток 2'-дезокси-рибозы) у ДНК,
а у прокариот (бактерии
и синезеленые водоросли)-также его
изомер (m4dC;
ф-ла I,
X = СН3,
Y = H) и N6-метил-2'-дезоксиаденозин
(m6dA;
ф-ла II) N1-метил-
и N2 -диметил-2'-дезоксигуанозин
(m1dG
и m22dG;
ф-ла III, соотв. X = СН3,
Y = Н и X = Н, Y = СН3) в РНК представлены
гл. обр. 2-О-метилрибозидами
(Nm; ф-ла IV, В-основание) 5-мети-луридин-т5U;
ф-ла V, X = Y = О, Z = СН3,
Rib -остаток рибозы) восстановления двойной
связи в положении
5,6 пиримидина(5,6-дигидроуридин-hU;
ф-ла VI).

Замена карбонильного атома кислорода на атомсеры (2-или 4-тиоуридин-S2U и S4U; ф-ла V, соотв. X = S, Y = О, Z = Н и X = О, Y = S, Z = H) или аминогруппы на гидро-ксил (инозин-ф-ла VII), а также в результате изменения взаимного расположения урацильного и углеводного остатков с образованием С-гликозидной связи (5-рибозилурацил, или псевдоуридин,-y; ф-ла VIII). Минорные нуклеозиды с заместителями, образующимися в результате ряда последовательных модификаций, напр. производное уридина (mcm5s2U; ф-ла V, X = S, Y = О, Z = CH2COOCH3) и аденозина (ms2t6A; ф-ла IX), в т.ч. циклизации (напр., виозин-W; ф-ла X). Такие гипермодифицированные минорные нуклеозиды всегда занимают в молекуле тРНК позицию 37, т.е. соседствуют с 3'-концевым нуклеозидом антикодона- участка молекулы тРНК, состоящего из трех нуклсотидов и узнающего соответствующий ему участок из трех нуклеотидов(кодон) в молекуле матричной РНК при трансляции (синтезе белка на РНК-матрице).
источник: http://www.xumuk.ru/encyklopedia/2628.html
22. Химическая модификация нуклеозидов по гетероциклическим основаниям: реакции метилирования, ацилирования, галогенирования, меркурирования, взаимодействие с бисульфитом, гидразином, гидроксиламином, тетраоксидом осмия, альдегидами.



23. Химическая модификация нуклеозидов по углеводному фрагменту: алкилирование, ацилирование, окисление, взаимодействие с карбонильными производными. Гидролиз гликозидных связей.


24. Нуклеотиды. Строение и свойства.
Нуклеоти́ды (нуклеозидфосфаты) — фосфорные
эфиры нуклеозидов.
Свободные нуклеотиды, в
частности АТФ, цАМФ, АДФ,
играют важную роль в энергетических и
информационных внутриклеточных
процессах, а также являются составляющими
частями нуклеиновых
кислот и многих коферментов.

Строение: Нуклеотиды являются сложными эфирами нуклеозидов и фосфорных кислот. Нуклеозиды, в свою очередь, являются N-гликозидами, содержащими гетероциклический фрагмент, связанный через атом азота с C-1 атомом остатка сахара.
В природе наиболее распространены нуклеотиды, являющиеся β-N-гликозидами пуринов или пиримидинов и пентоз — D-рибозы или D-2-дезоксирибозы. В зависимости от структуры пентозы различают рибонуклеотиды и дезоксирибонуклеотиды, которые являются мономерами молекул сложных биологических полимеров(полинуклеотидов) — соответственно РНК или ДНК[1].
Фосфатный остаток в нуклеотидах обычно образует сложноэфирную связь с 2′-, 3′- или 5′-гидроксильными группами рибонуклеозидов, в случае 2′-дезоксинуклеозидов 25
Большинство нуклеотидов являются моноэфирами ортофосфорной кислоты, однако известны и диэфиры нуклеотидов, в которых этерифицированы два гидроксильных остатка — например, циклические нуклеотиды циклоаденин- и циклогуанин монофосфаты (цАМФ и цГМФ). Наряду с нуклеотидами — эфирами ортофосфорной кислоты (монофосфатами) в природе также распространены и моно- и диэфиры пирофосфорной кислоты (дифосфаты, например, аденозиндифосфат) и моноэфиры триполифосфорной кислоты (трифосфаты, например, аденозинтрифосфат).
25. Синтез нуклеотидов (методы фосфорилирования).

26. Олиго- и полинуклеотиды. Номенклатура и строение. Тип межнуклеотидной связи.
Олигонуклеотидами называют соединения, в которых несколько нуклеозидов (до 20) соединены между собой фосфодиэфирными связями. Нуклеозид со свободной 5-OH-групой называется 5-концевым, а со свободной 3-OH-групой 3-концевым.
Полинуклеотиды представляют собой линейные гетерополимеры, также состоящие из последовательности мононуклеозидных единиц, соединенных фосфатным мостиком. Полинуклеотиды, состоящие из ковалентно связанных между собой остатков дезоксирибонуклеозидов, называются дезоксирибонуклеиновыми кислотами (ДНК), а полинуклеотиды, состоящие из остатков рибонуклеозидов рибонуклеиновыми кислотами (РНК). В обоих случаях мононуклеозиды связаны между собой при помощи фосфодиэфирных мостиков, соединяющих 3-положение одного мононуклеотида с 5-положением его соседа.
Нуклеиновые кислоты также различаются и по составу входящих в них гетероциклических оснований: урацил входит только в состав РНК, а тимин только в состав ДНК. Аденин, цитозин и гуанин являются постоянными компонентами полинуклеотидов.
Молекулярная масса ДНК достигает десятков миллионов. Это самые длинные из известных макромолекул. Значительно меньше молекулярная масса РНК (от нескольких сотен до десятков тысяч). ДНК содержатся в основном в ядрах клеток, РНК в рибосомах и протоплазме клеток.

ТИП
СВЯЗИ: нуклеотиды могут связываться
друг с другом при использовании фосфатной
связи С-О-Р. Так иогут образоваться
динуклеотиды, тринуклеотиды,
олигонуклеотиды. Нуклеиновые кислоты
являются полинуклеотидами, в которых
нуклеиновые кислоты связаны между
собой 3’ -5’ –фосфодиэфирными связями
С-О-Р-О-С.

27. Синтез олигонуклеотидов: фосфоди- и фосфотриэфирный, фосфиттриэфирный, Н-фосфонатный методы.


28. Твердофазный синтез олигонуклеотидов.
Полимеры: пористый полистирол, пористое стекло
В
настоящее время твердофазный синтез
проводится автоматически в олигонуклеотидных
синтезаторах, управляемых компьютерами.
Данные приборы состоят из серии клапанов,
соединённых с ёмкостями для реагентов,
а также соленоидами, которые открывают
или закрывают тот или иной клапан. В
свою очередь, соленоиды управляются
компьютером, выполняющим программу
синтеза.

29. Химико-ферментативный синтез ДНК.


30. ДНК. Вторичная структура ДНК. Конформация нуклеотидов. Конформации гетероциклических оснований, фуранозного цикла (С2’-эндо, С3’-эндо), гликозидной связи (син- и анти-конформации). Модель Уотсона-Крика. Макромолекулярные свойства ДНК.
Дезоксирибонуклеиновая кислота (ДНК) представляет собой биополимер (полианион), мономером которого является нуклеотид. Функции ДНК: хранение и передача информации; репарация; репликация.
Каждый нуклеотид состоит из остатка фосфорной кислоты, присоединённого по 5'-положению к сахару дезоксирибозе, к которому также через гликозидную связь (C—N) по 1'-положению присоединено одно из четырёх азотистых оснований. Именно наличие характерного сахара и составляет одно из главных различий между ДНК и РНК, зафиксированное в названиях этих нуклеиновых кислот (в состав РНК входит сахар рибоза)[12]. Пример нуклеотида — аденозинмонофосфат, у которого основанием, присоединённым к фосфату и рибозе, является аденин.
Исходя из структуры молекул, основания, входящие в состав нуклеотидов, разделяют на две группы: пурины (аденин [A] и гуанин [G]) образованы соединёнными пяти- и шестичленным гетероциклами; пиримидины (цитозин [C] и тимин [T]) — шестичленным гетероциклом.
Наиболее распространённой формой вторичной структуры ДНК является двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году.
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
-
водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
-
стэкинг-взаимодействия;
-
электростатические взаимодействия;
-
Ван-дер-Ваальсовы взаимодействия.
В зависимости от внешних условий параметры двойной спирали ДНК могут меняться, причём иногда существенно. Правоспиральные ДНК со случайной нуклеотидной последовательностью можно грубо разделить на два семейства — А и В, главное отличие между которыми — конформация дезоксирибозы.






31. Определение
первичной структуры нуклеиновых кислот.
Нуклеотидный состав, концевой анализ
(химические и ферментативные методы).



32. Блочный метод определения последовательности нуклеотидов ДНК. Методы избирательного расщепления ДНК с помощью эндонуклеаз.


33. Метод Максама-Гилберта (секвенирование (определение последовательности))
Центральный элемент метода секвенирования ДНК по Максаму-Гилберту - химическая деградация меченой цепи ДНК.
Несмотря на относительно низкую производительность метода секвенирования ДНК путем химической деградации по Максаму-Гилберту, этот метод в настоящее время все же продолжает использоваться и в отдельных случаях почти незаменим. Так, метод химической деградации применяется для секвенирования синтетических олигонуклеотидов в тех случаях, когда это необходимо.
Особо "трудные" участки с сильной вторичной структурой не всегда бывает возможно секвенировать с помощью ферментативного построения новой цепи ДНК и тогда используют данный метод. Кроме этого, с помощью секвенирующего гель-электрофореза возможно выявление ДНК/белковых взаимодействий после того, как исследуемая ДНК в комплексе с белком была подвергнута химической модификации по Максаму-Гилберту. К некоторому преимуществу метода секвенирования ДНК химической деградацией можно отнести то, что здесь определяется последовательность фрагмента ДНК, или геномного, или клонированного, в каком-либо подходящем векторе (т.е. реплицировавшегося in vivo), а не новосинтезированная in vitro копия, как в ферментативном методе с дидезокситерминаторами. Еще одно отличие метода секвенирования ДНК по Максаму-Гилберту от метода Сэнгера заключается в том, что его осуществление может начаться практически с любого сайта узнавания какой-нибудь рестрикционной эндонуклеазы, присутствующего во вставке и поэтому не требуется предварительного знания даже небольшого участка нуклеотидной последовательности, окружающего данное место. В этой связи метод секвенирования ДНК путем химической деградации иногда выступает в качестве стартового при выполнении крупномасштабных проектов по определению нуклеотидных последовательностей протяженных фрагментов ДНК. В то же время нельзя не отметить серьезный недостаток метода секвенирования ДНК по Максаму-Гилберту, заключающийся в высокой токсичности большинства используемых реагентов, обращение с которыми и их дальнейшая утилизация требуют соблюдения определенных правил.
Используется для секвенирования одно- и двухцепочечных фрагментов ДНК.
Этапы метода:
1) специфическая химическая фрагментация изучаемого полинуклеотида
2) фрагмент ДНК метят радиоактивным изотопом 32Р по 5'- или 3'-концу. У двухцепочечной ДНК метятся обе цепи
3) Подготовка меченных фрагментов к секвенированию. Для этого используются клонирующие векторы, содержащие синтетические полилинкеры. После гидролиза рестриктазами, образующими липкие концы, с помощью фрагмента Кленова избирательно метят клонированные фрагменты по одному концу.
4) Меченные фрагменты делят на порции и каждую подвергают определенной химической модификации. Ее проводят так, чтобы на одну молекулу ДНК в среднем приходилось по одной метке.
Пуриновые основания: диметилсульфат – метилирование аденина по положению N3, гуанина – N7. Обработка 0,1М HCl при температуре 0ºС приводит к отщеплению метиладенина. Инкубация при 90ºС в щелочной среде (0,1М NaOH) вызывает разрыв цепи ДНК в местах отщепления оснований. При обработке пиперидином происходит гидролиз цепи ДНК по остаткам метилгуанина.
 Пиримидиновые
основания:
гидразин. Если реакцию вести в бессолевой
среде, то модифицируются тимин и цитозин,
а в присутствии 2М NaCl – только цитозин.
При обработке пиперидином происходит
гидролиз цепи ДНК пр точкам модификации
Пиримидиновые
основания:
гидразин. Если реакцию вести в бессолевой
среде, то модифицируются тимин и цитозин,
а в присутствии 2М NaCl – только цитозин.
При обработке пиперидином происходит
гидролиз цепи ДНК пр точкам модификации
5) После параллельного проведения четырех различных обработок фрагмента ДНК полученные субфрагменты разделяют путем электрофореза в полиакриламидном геле на соседних дорожках
6) С помощью радиоавтографии геля на рентгеновской пленке считывается нуклеотидная последовательность ДНК


34. Понятие о репликации ДНК. Определение первичной структуры ДНК с использованием матричного синтеза и терминаторов (метод Сэнджера)
Репликация ДНК – процесс синтеза дочерней молекулы ДНК на матрице родительской молекулы ДНК.
Репликация проходит в 3 этапа: инициация репликации, элонгация и терминация.
Ферменты
(хеликаза, топоизомераза) и ДНК-связывающие
белки расплетают ДНК, удерживают матрицу
в развернутом состоянии. Цепи молекулы
ДНК расходятся, образуя репликационную
вилку. Правильность репликации
обеспечивается точным соответствием
комплементарных пар оснований и
активностью ДНК-зависимой ДНК-полимеразы,
способной распознать и исправить ошибку.
Репликация у прокариот осуществляется
несколькими разными ДНК-зависимая
ДНК-полимеразами. ДНК-полимераза 1
действует на отстающей цепи для удаления
РНК-праймеров и дорепликации очищенных
мест ДНК. ДНК-полимераза 3 – основной
фермент репликации ДНК, осуществляющий
синтез ведущей цепи ДНК и фрагментов
Оказаки при синтезе запаздывающей цепи.
Далее происходит закручивание. В
результате из 1 материнской ДНК образуются
2 дочерние.
Этот
хитроумный метод определения расположения
специфического основания во фрагменте
ДНК также называется «методом обрыва
цепи», потому что основан на остановке
синтеза новой цепочки ДНК. Принцип
данного метода зависит от двух фактов:
(а) синтез фрагмента двуцепочечной ДНК
из одноцепочечной цепочки ДНК инициируется
в присутствии ДНК-полимеразы; (б) синтез
ДНК останавливается, если включенное
в цепочку основание находится в форме
дидезоксинулеотида вместо дезоксинулеотида.
В дидезокси-форме нуклеотида отсутствует
гидроксильная группа в определяющей
позиции (3′-позиция)

Поэтому, если вы снабдите синтезирующуюся молекулу ДНК, к примеру, дидезоксиаденозином (ддАТФ) в смеси с дезоксиаденозином (дАТФ) и другими тремя дезоксинуклеотидами, то синтез второй цепочки остановится там, где в цепочку встроится дидезоксиаденозин вместо дезоксиаденозина. По теории вероятности в части синтезируемых ДНК репликация прервется в каждой точке, где необходим аденозин.
 Метод
Сэнджера использует дидезоксинуклеотиды
для всех четырех нуклеотидов. Есть
четыре набора реагентов, каждый из
которых содержит все четыре нуклеотида
в нормальной дезокси-форме и один из
нуклеотидов в дидезокси-форме. Копии
одной и той же одноцепочечной ДНК
инкубируют в каждом наборе. В каждом из
четырех наборов синтез ДНК останавливается
по всем соотвествующим сайтам фрагмента
ДНК. Электрофорез проводится во всех
четырех наборах раздельно. Поскольку
длина пути передвижения в геле при
электрофорезе зависит от размера
молекулы, фрагменты ДНК будут распределяться
линейно в соответствии со своим размером.
Если взять, например, набор с ддАТФ, то
мы увидим, что в образце будут присутствовать
фрагменты ДНК, укороченные по каждой
из позиций, где в синтезируемой цепи
находился аденозин. Некоторые фрагменты,
в цепи которых аденозин появляется
рано, будут короткими. Другие (аденозин
появляется позже в последовательности
ДНК) — длиннее. Вы можете определить
локализацию аденозина по длине этих
фрагментов. Затем можно сравнить данные,
полученные после электрофореза в каждом
наборе. Так вы определите локализацию
каждого нуклеотида в исследуемой
последовательности ДНК
Метод
Сэнджера использует дидезоксинуклеотиды
для всех четырех нуклеотидов. Есть
четыре набора реагентов, каждый из
которых содержит все четыре нуклеотида
в нормальной дезокси-форме и один из
нуклеотидов в дидезокси-форме. Копии
одной и той же одноцепочечной ДНК
инкубируют в каждом наборе. В каждом из
четырех наборов синтез ДНК останавливается
по всем соотвествующим сайтам фрагмента
ДНК. Электрофорез проводится во всех
четырех наборах раздельно. Поскольку
длина пути передвижения в геле при
электрофорезе зависит от размера
молекулы, фрагменты ДНК будут распределяться
линейно в соответствии со своим размером.
Если взять, например, набор с ддАТФ, то
мы увидим, что в образце будут присутствовать
фрагменты ДНК, укороченные по каждой
из позиций, где в синтезируемой цепи
находился аденозин. Некоторые фрагменты,
в цепи которых аденозин появляется
рано, будут короткими. Другие (аденозин
появляется позже в последовательности
ДНК) — длиннее. Вы можете определить
локализацию аденозина по длине этих
фрагментов. Затем можно сравнить данные,
полученные после электрофореза в каждом
наборе. Так вы определите локализацию
каждого нуклеотида в исследуемой
последовательности ДНК
35. РНК. Типы РНК – рибосомальная, матричная, транспортная. Функциональная роль разных типов РНК
РНК – одна из трех основных макромолекул, которые содержатся в клетках всех живых организмов.
РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию.
Типы РНК:
-
Рибосомальные РНК: 75-80% от всех РНК, составляет основу рибосомы, основное назначение – осуществление трансляции (считывание информации с мРНК)
-
Транспортные РНК: являются переносчиками аминокислот к месту синтеза белка, для каждой аминокислоты существует своя тРНК.
-
Матричные РНК (информационная): 1-10% от всех РНК, основная функция – перенос генетической информации, мало живет.
36. Первичная структура РНК. Определение нуклеотидной последовательности, расщепление специфическими рибонуклеазами
Первичная
структура РНК
– порядок чередования рибонуклеозидмонофосфатов
в полинуклеотидной цепи. В РНК, как и в
ДНК, нуклеотиды связаны между собой
3',5'-фосфодиэфирными связями. Концы
полинуклеотидных цепей РНК неодинаковы.
На одном конце находится фосфорилированная
ОН-группа 5'-углеродного атома, на другом
конце – ОН-группа 3'-углеродного атома
рибозы, поэтому концы называют 5'- и
3'-концами цепи РНК.
Для определения нуклеотидной последовательности РНК часто используют метод переведения РНК в ДНК (обратная транскрипция) и анализ уже молекулы ДНК.
Рибонуклеазы— ферменты-нуклеазы, катализирующие деградацию РНК. Рибонуклеазы классифицируют на эндорибонуклеазы и экзорибонуклеазы.
 Они
способны катализировать гидролиз
фосфоэфирных связей в одноцепочечных
фрагментах РНК и ДНК с образованием
олиго- и мононуклеотидов, имеющих на
5'-конце фосфатные группировки.
Неспецифические рибонуклеазы могут
действовать на двухцепочечные участки
РНК с образованием 5' или 3'-фосфорилированных
олигонуклеотидов.
Они
способны катализировать гидролиз
фосфоэфирных связей в одноцепочечных
фрагментах РНК и ДНК с образованием
олиго- и мононуклеотидов, имеющих на
5'-конце фосфатные группировки.
Неспецифические рибонуклеазы могут
действовать на двухцепочечные участки
РНК с образованием 5' или 3'-фосфорилированных
олигонуклеотидов.
Среди специфических дезоксирибонуклеаз наиболее хорошо изучены рестриктазы, которые рапознают в молекулах ДНК специфические последовательности из 4-6 нуклеотидных остатков. Они расщепляют двухцепочечные молекулы ДНК на строго определённые фрагменты.
37. Макроструктура т-РНК, модель клеверного листа
Вторичная структура РНК
Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли – «шпильки», за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Компактные за счет самокомплементарных участков. Наиболее изучены тРНК.
Вторичная структура тРНК – модель клеверного листа (75-90 нуклеотидов).

Третичная структура РНК
Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибозы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями.
