
Практикум ФизХим Кинетика. Катализ Михаленко 2018
.pdf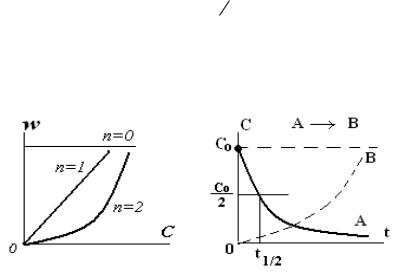
Время, за которое концентрация исходного вещества уменьшилась в 2 раза, т.е. C 12 C0 , называется периодом
полупревращения t1/2 , который является важной характеристикой процесса, поскольку он связан с константой скорости k.
а б
Рис. 1.1. а. – Влияние концентрации А на скорость реакции; б. – Кинетические кривые для исходного вещества и продукта
Приведем вывод уравнений кинетики односторонних простых реакций, определим вид кинетической зависимости и значение периода полупревращения для целочисленных порядков 0, 1 и 2. Решение используемых табличных интегралов можно посмотреть в Приложении.
Нулевой порядок (n = 0). |
|
Поскольку значение концентрации вещества |
в |
нулевой степени равно единице (х0 1 математическое тождество, если х > 0), то скорость реакции не зависит от концентрации исходного вещества и равна константе скорости реакции. В дифференциальном уравнении 1.4 разделим переменные и проведем интегрирование с пределами по концентрации А от начальной С0 при t=0 до текущей С при времени реакции t. Константу k можно вынести за знак интеграла.
13

C |
C0 |
t |
|
|
|
|
|
dC dC k dt |
|
C0 C kt |
|||||
Co |
C |
0 |
|
|
|
|
|
|
|
|
|
|
t1/ 2 |
C0 |
|
C C0 |
kt |
(1.5) |
и |
|
(1.5`) |
||
|
2 k |
||||||
|
|
|
|
|
|
|
|
Уберем знак минус перед левым интегралом, поменяв пределы интегрирования. Из полученного уравнения 1.5 видно, что концентрация исходного вещества линейно уменьшается во времени, а тангенс угла наклона прямой
С t |
равен |
константе скорости k. После подстановки |
C 1 |
C |
получим уравнение 1.5` для периода |
2 |
0 |
|
полупревращения t1/2. С ростом начальной концентрации С0 взятого для реакции вещества t1/2 линейно увеличивается.
Реакция протекает по нулевому порядку, если исходное вещество находится в избытке. Пример такой реакции – омыление эфира в слое малорастворимого в воде эфира, который постоянно пополняется из этого слоя в ходе взаимодействия эфира с растворенной в воде щелочью. Если эфир хорошо растворяется в водном растворе щелочи, то омыление эфира, является реакцией второго порядка.
Первый порядок реакции (n = 1).
Аналогические математические решения проведем для дифференциального уравнения закона действия масс простой реакции А → продукт(ы).
C |
dC |
|
|
C0 |
|
dC |
|
t |
и ln C0 ln C kt |
|
||||||||
|
|
|
k dt |
|
||||||||||||||
C |
C |
|
||||||||||||||||
C |
|
|
C |
|
0 |
|
|
|
|
|
|
|
|
|
||||
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
0 |
|
kt |
|
|
|
|
ln C ln C0 kt |
|
||||||||
ln |
|
|
|
|
или |
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||||
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
C C e kt |
|
(1.6) |
|
|
t |
|
ln 2 |
|
0,693 |
|
(1.6`) |
|||||||
|
|
|
|
|||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
1/ 2 |
|
k |
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
14
Из уравнений 1.6 видно, что концентрация исходного вещества С уменьшается во времени по экспоненциальному закону (1.6), а период полупревращения реакции первого порядка не зависит от его начальной концентрации С0.
Для нелинейных кинетических уравнений могут быть получены координаты линейной формы этих уравнений (координаты спрямления). Кинетическая зависимость реакции 1-го имеет линейный вид в полулогарифмических координатах ln С t, а тангенс угла наклона прямой равен константе скорости реакции k.
Необратимые реакции 1-го порядка являются очень распространенными (диссоциация и разложение вещества, изомеризация, радиоактивный распад).
Второй порядок (n = 2).
Для реакции 2А → продукт(ы) результатом интегрирования является гиперболическое кинетическое уравнение (1.7) и уменьшение периода полупревращения с увеличением начальной концентрации А (см.1.7`).
|
|
C |
dC |
|
t |
и |
1 |
1 |
|
|
C C |
kt |
|||||||
|
|
C 2 |
k dt |
C |
C |
|
|
C C |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
C |
o |
|
0 |
|
|
|
|
0 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
(1.7) |
и |
|
|
t1/ 2 |
|
|
|
1 |
|
(1.7`) |
. |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
k C0 |
|||||||||||
1 |
C0 kt |
|
|
|
|
|
|
|
|
|
|
||||||||
Для определения константы скорости надо построить график зависимости обратной концентрации от времени реакции 1/С t (линейная анаморфоза). Тангенс угла наклона прямой равен константе скорости k, а отрезок, отсекаемый по оси ординат равен обратной концентрации 1/С0.
Третий порядок (n = 3). Реакций третьего порядка известно мало. Реакция 2NO+Cl2 2NOCl относится к типу
2A+B продукт(ы). Простейшая схема 3A продукт(ы).
Полученные нами результаты сведены в таблицу 1.1.
15

Таблица 1.1. Кинетические уравнения реакций первого, второго и третьего порядков
|
Закон |
|
|
|
|
|
Константа |
|
|
|
|
|
Размерность |
Период полу- |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
превращения |
|||||||||||||||||||||||||||||||||||||||
n |
действия |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
скорости реакции |
|
|
|
|
k |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
t1/2 |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
масс |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
k |
|
|
|
|
|
C0 C |
|
|
|
|
|
|
моль |
|
t1/ 2 |
|
C0 |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
w k |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
л |
мин. |
|
|
|
|
|
2k0 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
w kC |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
C |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
0,693 |
|
|||||||||||||||||
1 |
|
|
k |
|
|
|
ln |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
t1/ 2 |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
C |
|
|
|
|
мин |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
||||
|
w kC2 |
k |
|
|
1 |
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
t1/ 2 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
k2 |
C0 |
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
2 |
|
|
|
|
2 |
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
моль |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
Ct |
|
|
|
C0 |
|
мин |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
w kC |
3 |
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
л2 |
|
|
|
|
|
3 |
|
|
|
|
|
1 |
|
|
|
|||||||||
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t1 / 2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
3 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 C |
|
2 |
k |
|
|
||||||||||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
C0 |
2 |
|
моль |
мин |
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Ct |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
3 |
|
|||||||||
С помощью экспериментальных кинетических зависимостей определяется порядок реакции, рассчитываются константы скорости реакции (тангенс угла наклона) и период полупревращения t1/2.
Три вида линейных кинетических зависимостей, показанных на рис.1.2 показыают графический метод определения константы скорости реакции для n = 0,1,2
n = 0 |
n = 1 |
n = 2 |
Рис. 1.2. Линейные анаморфозы реакций целых порядков
16

Рассмотренные выше уравнения справедливы и для элементарных стадий сложных реакций. Исследование кинетики таких реакций позволяет установить детальный механизм химического процесса, знание которого необходимо для выбора оптимальных условий реакции. Элементарная реакция (стадия) – это единичный акт разрыва и образования химических связей при непосредственном одновременном взаимодействии реагирующих частиц, т.е. без образования промежуточного вещества (интермедиата).
Определение порядка реакций проводится на основании зависимости концентрации вещества от времени или же зависимости периода полупревращения или начальной скорости реакции от начальной концентрации.
1.Метод подбора кинетического уравнения. Данные зависимости С время подставляют в уравнения для k (табл.1.1) и сравнивают их значения (k должны быть одинаковыми в пределах ошибок опыта).
2.Графический метод. Строят графики в различных линейных координатах (рис.1.2) и выбирают функцию с наилучшим спрямлением. В случае сложного необратимого процесса с нецелочисленным порядком n используют уравнения
w kCn |
|
1 |
|
|
1 |
|
1 |
|
kt . |
|
|
|
|
|
|
|
|
||
|
|
|
|
C0,n A1 |
|||||
|
n 1 |
CAn 1 |
|
|
|
||||
3. Метод Оствальда-Нойеса. Определяют время, за которое исходная концентрация реактанта уменьшается в определенное число раз. Частным случаем этого метода является определение порядка реакции по периоду полупревращения, используя логарифмическое уравнение
|
|
12 n 1 |
1 |
|
n 1 ln C |
|
|
|
ln t ln |
|
|
|
|
|
(1.8`) , где C0 – исходная |
||
|
|
|
|
|||||
1/ 2 |
k n 1 |
|
|
0 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17 |
|
|

концентрация исходного вещества. Тангенс угла наклона прямой ln t1/2 ln C0 равен (n 1).
4.Способ Вант-Гоффа. Используется степенное уравнение
зависимости скорости реакции от концентрации w kCn или в логарифмическом виде (десятичный или натуральный логарифм), например,  ln w ln k nln C (1.8)
ln w ln k nln C (1.8)  . Тангенс угла наклона
. Тангенс угла наклона
прямой в билогарифмических координатах равен порядку реакции n, а отрезок, отсекаемый по оси ординат, равен логарифму константы скорости k. Само значение константы находим потенцированием еlnk. Удобнее определять n и k, варьируя начальную концентрацию исходного вещества.
Два первых метода применимы для нахождения целочисленных порядков, а два последних и для любых значений n, что дает возможность определить порядки сложных реакций.
Сложные реакции
Обратимые реакции протекают в прямом и обратном направлении. Уравнение скорости обратимой реакции (закон действующих масс) включает константы скорости прямой (w1) и обратной (w2) реакции. При равновесии w1 = w2 и с учетом закона действия масс получаем выражение для константы равновесия K как отношение констант прямой (k1) и обратной (k2) реакций.
|
|
|
|
|
K |
|
|
|
|
qE константа |
||
Для реакции nA mB pD |
||||||||||||
|
|
|
k |
|
C |
|
p C |
|
q |
|
||
|
K |
|
D |
E |
|
|
||||||
равновесия имеет вид |
1 |
|
|
|
|
(1.9) . |
||||||
k2 |
CA n CB m |
|||||||||||
|
|
|
|
|
||||||||
Параллельные реакции это реакции, в которых исходное вещество или вещества претерпевают превращение по крайней мере по двум направлениям. Так, при нитровании фенола азотной кислотой продуктами реакции являются вещества с различным положением NO2- группы (орто-нитрофенол и пара-нитрофенол).
18
Последовательные реакции протекают через несколько последовательных элементарных стадий,
(мономолекулярная) или
(бимолекулярная реакция). Суммарная скорость реакции определяется самой медленной стадией, которая называется лимитирующей. Если k2 << k1, т.е. вторая стадия лимитирующая, то вещество D накапливается, и скорость равна w = dСD / dt.
Стационарное состояние – это постоянство концентрации промежуточного вещества в последовательных реакциях. Для приведенной выше схемы мономолекулярной реакции СВ =const, т.е. dСВ / dt = 0 , для бимолекулярной реакции СD =const или dСD / dt = 0.
Последовательные реакции могут включать и обратимые стадии, например, A B K D k2 E . Условие стационарности будет аналогичным dСD / dt = 0.
Сопряженные реакции – особый тип реакций, в
котором одна реакция инициирует другую. Простая схема сопряженных реакций приведена ниже. В ней две реакции, одна из которых протекает самопроизвольно. Вторая реакция невозможна без первой, поэтому вещество В называется индуктором, участвующее в двух реакциях вещество А – актором, вещество С акцептором.
Возможность существования таких реакций расширяет список формально тримолекулярных реакций.
Реакция 1 |
А + В M |
самопроизвольная |
Реакция 2 |
A + C N |
без реакции 1 не идет |
|
|
|
Суммарная |
A + B + С M + N |
|
Сопряженные реакции играют важную роль в биологических системах для получения энергии, необходимой в синтезе белков и нуклеиновых кислот.
19

Примером сопряженной реакции является синтез сахарозы из глюкозы и фруктозы, который самопроизвольно протекать не может, но идет при сопряжении с реакцией гидролиза аденозинтрифосфата (АТФ) с образованием аденозиндифосфата (АДФ) и фосфорной кислоты (Ф).
1 |
АТФ + Н2О АДФ + Ф |
( G1 |
< 0) |
2 |
глюкоза + фруктоза сахароза + Н2О |
( G2 |
> 0) |
АТФ + глюкоза + фруктоза сахароза + АДФ + Ф
Сопряжение осуществляется путем образования в качестве промежуточного вещества глюкозо-1-фосфата: Для суммарной реакции G = G1 + G2 < 0 и она термодинамически возможна. Скорость реакции резко увеличивается в присутствии катализаторов (ферментов).
Заметим, что в основе исследовании кинетики сложных реакций лежит второй постулат химической кинетики – принцип независимости еѐ отдельных стадий.
Каталитические реакции также сложные реакции.
Вещество, принимающие участие, но не расходующееся в процессе реакции, называется катализатором. В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном и гетерогенном катализе. Подробно рассмотрим каталитические реакции и их механизмы ниже.
Автокаталитические реакции – это реакции,
которые ускоряются одним из продуктов реакции. Автокатализ также может быть гомогенным и гетерогенным. Схему простой гомогенной автокаталитической реакции можно записать в виде A+ B + (D) D + E. Кинетическая зависимость имеет период индукции (реакция до определенного времени не идет), а затем вид вогнутой линии, т.к. в начале концентрация катализатора D мала.
20
Влияние температуры на скорость реакции
Скорость и прямо пропорциональная ей константа скорости реакции, увеличиваются с ростом температуры.
Правило Вант-Гоффа. Для большинства реакций это увеличение составляет 2 4 раза при повышении температуры на каждые 100. Значения коэффициентов ВантГоффа ( ) приводятся в справочниках с указанием интервала температур Т = Т2 Т1 = 10о .
kT 10 |
|
|
k2 |
|
w2 |
|
T2 T1 |
|
|
|
2 4 или |
|
|
10 |
(1.10) |
. |
|||||
k1 |
w1 |
|||||||||
kT |
||||||||||
|
|
|
|
|
|
|
||||
В общем виде для узкого интервала температур Т1 и Т2 отношения w или k рассчитывают по уравнению 1.10. Правило Вант-Гоффа дает полуколичественную (приближенную) характеристику влияния температуры. Оно выполняется для газофазных реакций и реакций в растворах, протекающих при низких температурах.
Уравнение Аррениуса. Теории химической кинетики позволяют обосновать экспоненциальную зависимость константы скорости реакции от температуры (1.11). Аррениусом опытным путем была получена формула (1.11`)
k k0 e |
Ea |
|
|
|
А |
|
|
RT |
(1.11) |
или |
ln k |
В (1.11`) . |
|||
T |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
Логарифмируя 1.11, переходим к линейной форме
уравнения Аррениуса |
ln k |
Еа |
ln k0 |
(1.12) |
, здесь |
|
RT |
||||||
|
|
|
|
|
||
R газовая постоянная, Т |
– абсолютная |
температура. |
||||
Сравнивая 1.11` и 1.12 раскрываем смысл опытных
констант A = Ea/R и |
B= lnk0, где Еа – энергия активации |
|
реакции, k0 |
|
предэкспоненциальный множитель, |
показывающий |
число столкновений активных молекул, |
|
21

приводящих к образованию продукта(ов) реакции. Ослабление и разрыв химических связей реагентов и образования новых связей зависит от эффективности соударений. Для сложных молекул необходима их соответствующая ориентация в пространстве в момент столкновения, что учитывает фактор вероятности P < 1, входящий в предэкспоненту k0.
Значение Еа можно определить опытным путем. Согласно уравнению 1.12`, логарифм константы скорости (или логарифм скорости реакции) линейно зависит от обратной температуры (рис.1.3). Тангенс угла прямой в координатах lnk 1/T равен Еа / R. Отрезок, отсекаемый по оси ординат равен lnk0. Если известны значения констант при двух температурах, то можно рассчитать Еа (1.13)
k |
2 |
|
|
E |
a |
|
ln |
|
|
|
|
||
|
|
|
|
|||
|
|
|
|
R |
||
k1 |
|
|
||||
T2 |
T1 |
|
|
|
k |
|
|
|
T T |
|
|
||||
|
|
|
|
(1.13) , |
Ea |
ln |
|
2 |
|
|
1 |
2 |
|
R (1.13`) . |
|
T |
T |
||||||||||||||
|
|
|
|
||||||||||||
|
|
|
|
k |
|
|
T T |
|
|
||||||
|
2 |
1 |
|
|
|
|
1 |
|
2 |
1 |
|
|
|||
Энергия активации реакции очень важная характеристика каждой реакции. В химическом превращении участвуют не все, а только активные
Ea
(возбужденные) молекулы. Экспонента e RT в уравнении 1.11 это доля активных молекул. Активные молекулы обладают избыточной энергией, необходимой для того, чтобы столкновение молекул привело к химической реакции. Мономолекулярную реакцию А В можно записать следующим образом А + (Еа) Аакт В. Исходя из этого, Аррениус обосновал своѐ уравнение теоретически, сравнив с уравнениями изобары и изохоры Вант-Гоффа (1.14`) для зависимости константы равновесия от температуры
d ln K |
|
Q |
(1.14`) и |
d ln k |
|
Ea |
(1.14) . |
dt |
RT 2 |
dt |
RT 2 |
22
