
Практикум ФизХим Кинетика. Катализ Михаленко 2018
.pdf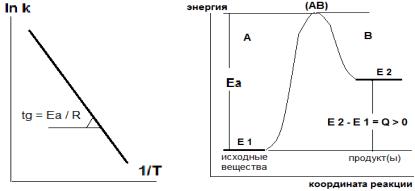
Рис. 1.3. |
Рис. 1.4. |
Графическое определение Еа |
Энергетическая диаграмма |
Действительно, уравнение 1.14 – это дифференциальная форма уравнения Аррениуса, из которой можно получить формулы 1.11 и 1.12. Для экзотермической реакции теплота (отрицательные значения изменения энергий U или Н, равные термодинамической теплоте Q) не успевает отводиться, реакционная смесь нагревается, число активных молекул и, следовательно, скорость реакции увеличивается. Для эндотермической реакции (U и Н положительные) и надо подводить теплоту, чтобы скорость не снижалась. Сказанное иллюстрирует энергетическая диаграмма, показанная на рис.1.4 для случая эндотермической реакции.
Для бимолекулярных реакций была разработана теории активных соударений. При столкновениях молекул реагируют только те, которые обладают избыточной (повышенной) энергией по сравнению со средним значением Е. Источником получения избыточной энергии является температура, поэтому здесь мы рассматриваем только реакции с термической активацией. Предэкпоненциальный множитель k0 связан с общим числом двойных соударений Z и вероятностью протекания реакции при
23
активных соударениях Р (называется стерическим фактором), т.е. k0 = Р Z. Значения Р лежат от 1 до 10 8.
Расчетным методом можно получить значения не только P и k0, но и Еа, используя теорию активированного комплекса (переходного состояния). Согласно этой теории зависимость потенциальной энергии реактантов бимолекулярной реакции Х + YZ XYZ XY + Z от пути (координаты) реакции проходит через максимум. Максимуму энергии Е соответствует промежуточное состояние системы образование из Х, Y, Z активированного комплекса XYZ. Постулат теории равновесие между исходными веществами X и YZ и комплексом. Константа равновесия К входит в константу
скорости |
реакции k |
и |
закон |
действия |
масс |
имеет вил |
|||||||
|
|
|
|
|
kБТ |
|
|
|
|
|
K e |
U 0 |
S 0 |
w k C |
|
C |
|
|
K |
C |
|
C |
(1.15) , где |
RT |
e R |
||
X |
YZ |
|
X |
||||||||||
|
|
|
h |
|
YZ |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
здесь kБ |
константа Больцмана (kБ =R/NA, NA – число |
||||||||||||
Авогадро), h постоянная Планка (6,62 10 34 Дж с). |
|
||||||||||||
Теория позволяет рассчитать константу скорости и связать еѐ с изменением термодинамических функций состояния комплекса – стандартным изменением внутренней энергииU0 и энтропии S0 . Последняя раскрывает термодинамический смысл стерического множителя P = exp( S0 /R) и объясняет протекание быстрых реакций с большими величинами Еа (денатурация протеинов).
Уравнение Аррениуса выполняется и для сложных реакций, но энергия активации не имеет простого физического смысла и является некоторой функцией энергий активации отдельных стадий. Поэтому Еа называют эффективной.
Можно рассчитать при каких значениях Еа
выполняется эмпирическое правило Вант-Гоффа. |
|
||
С учетом уравнений 1.10 и 1.11 Е |
RT (T 10) |
|
ln , тогда |
а |
10 |
|
|
|
|
|
|
при температурах, близких к комнатной (300 К), получим
24
значения Еа=50 и Еа=100 кДж/моль соответственно для =2 и =4. Величины для некоторых реакций приведены ниже.
Реакция |
Фаза |
Порядок |
Интервал 0С |
|
|
Н2 + I2 |
газ |
2 |
283 |
293 |
2,5 |
С12H22О11 + Н2О |
раствор |
1 |
25 |
55 |
3,6 |
Спиртовое брожение |
раствор |
|
30 |
– 70 |
2,0 |
Применение |
уравнений |
химической |
кинетики |
|
в фармации. |
Уравнение Вант-Гоффа |
используется для |
||
определения |
срока годности |
и |
условий |
хранения |
лекарственных средств (температуры) при заданном сроке хранения. Под сроком годности понимают период полуразложения действующего вещества, находящегося при
комнатной температуре. В уравнении |
1.16 значение T1 = |
|||
250С. |
Формула |
1.16 |
получена |
преобразованием |
соотношения 1.10 с учетом того, что разложение реакция первого порядка и константа скорости обратно пропорциональна периоду полупревращения вещества t1/2
|
|
|
|
T2 T1 |
|
|
t |
(T ) t |
(T ) 10 |
(1.16) |
. |
||
1/ 2 |
1 |
1/ 2 |
2 |
|
|
|
Значение Т2 – это более высокая, чем Т1, температура для ускоренного разложения вещества. При оценке срока годности необходимо знать значение коэффициента .
При использовании уравнения 1.16 может быть решена и другая задача – определение температуры, рекомендуемой для хранения препарата с увеличенным сроком годности.
Элементы фармакокинетики.
Уравнения формальной кинетики лежат в основе фармакокинетики, являющейся разделом фармакологии и изучающей закономерности всасывания, распределения, метаболизма и выведения лекарства из организма.
Так, последовательная мономолекулярная реакция моделирует перемещение лекарственного вещества в
организме. В схеме A k1 B k2 C обозначим A
25

– вещество в желудке, B – в крови, C – вещество или продукты его метаболизма в моче.
|
|
Для B |
|
закон |
действия масс |
имеет |
вид |
|||||||
w |
|
|
dB |
k C |
|
k |
C |
|
k C |
e k1t k |
C |
|
(1.17) , |
где |
|
|
A |
B |
B |
||||||||||
B |
|
dt |
1 |
2 |
|
1 0, A |
2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
B |
F e k2t |
с функцией F, которую можно получить в |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
явном виде. Окончательно выражение зависимости концентрации вещества в крови СВ от времени t имеет вид 1.17`. Для вещества В временная зависимость проходит через максимум, положение которого можно определить по формулам 1.17``. Их получают из условия максимума, приравнивая к нулю производную dСB/dt = 0.
|
СB |
|
|
k1 |
|
C0, A e k1t e k2t |
|
(1.17`) , |
||||||||||
|
k2 k1 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
1 |
k1 |
|
|
|
|
|
|
1 |
|
ln |
k |
2 |
|
|
|
|
|
k2 |
|
|||
tmax |
|
|
|
|
|
|
и С |
|
С |
|
|
|
2 |
|
(1.17``) . |
|||
k |
|
k |
k |
|
|
|||||||||||||
|
|
|
|
|
||||||||||||||
|
|
2 |
|
|
В max |
|
0, А |
k |
|
|
||||||||
|
|
|
1 |
|
|
1 |
|
|
|
|
|
1 |
|
|
||||
Время достижения максимума СВ зависит от численных значений констант скоростей первой и второй стадии. Уменьшение разности k2 k1 приводит к растягиванию максимума и установлению стационарной концентрация B.
Рис. 1.5.
Изменение
концентрации веществ А, B, С во времени для двух последовательных реакций 1гопорядка
A B C
26

По значению максимальной концентрации рассчитываются минимальная терапевтическая и предельно допустимая (токсичная) концентрации активного вещества.
Случай k1 >> k2 малоинтересен, т.к. он соответствует практически отсутствию второй реакции. Если k2 >> k1 получаем кинетические кривые, показанные на рис.1.5.
Фотохимические и цепные реакции относятся к сложным реакциям с нетермической активацией.
Фотохимичесие реакции объединяют большую группу реакций, включающих фоторазложение веществ, фотополимеризацию, фотосинтез и процессы в атмосфере. Различают три группы фотохимических реакций: реакции с участием фотовозбужденных молекул, реакции с участием образующихся при фотодиссоциации, фотоионизации активных частиц, и фотосенсибилизированные реакции.
Активация одного из реагирующих веществ осуществляется в результате поглощения кванта света. В основе жизни на Земле лежит реакция фотосинтеза углеводов 6 СО2 + 6 Н2О С6Н12О6 + 6О2 ( G0 = +2860 кДж/моль, S0<0), протекающая за счет энергии Солнца с участием хлорофилла. Хлорофилл поглощает кванты света и передает их молекулам, то есть выступает в роли сенсибилизатора, который сам в реакции не участвует. Важное значение имеют реакции фоторазложения веществ, например, красителей, солей серебра, Н2О2.
Фотохимическую реакцию можно записать как двухстадийный процесс  A h k1 А* k2 Р
A h k1 А* k2 Р  . Молекула А поглощает квант света (фотон) и переходит в возбужденное состояние А*, которое длится 10 8 с. Если за это время превращение нет, то происходит дезактивация А*.
. Молекула А поглощает квант света (фотон) и переходит в возбужденное состояние А*, которое длится 10 8 с. Если за это время превращение нет, то происходит дезактивация А*.
В фотохимии два основных закона. Первый говорит о том, что только поглощенное системой излучение может привести к еѐ химическому превращению. Количество,
прореагировавшего в фотохимической реакции вещества
27

пропорционально интенсивности излучения I и времени освещения t. По закону квантовой эквивалентности А.Эйнштейна один поглощенный квант света способен активировать только одну молекулу.
Вант-Гофф экспериментально доказал прямо пропорциональную связь между уменьшением концентрации превращенного вещества A и количеством поглощенной световой энергии QI, поэтому скорость
фотохимической реакции равна dCA / dt k QI .
Значение QI связано с интенсивность света I0 , когда x=0 и Ix , где х – толщина слоя с веществом, через который проходит свет. За единицу времени слой поглощает
световой энергии в количестве |
Q |
I |
0 |
I |
x |
I |
0 |
I |
0 |
e kCx |
, |
|
I |
|
|
|
|
|
|
||||
тогда скорость фотохимической реакции равна |
|
|
|
|
|
||||||
dC / dt k I0 1 e kCx |
|
(1.18) . |
|
|
|
|
|
||||
Возможны два предельных случая – скорость реакции прямо пропорциональна концентрации вещества (первый порядок) и не зависит от концентрации (нулевой порядок).
Первый случай dC / dt k` C мы получим, при
условии, что произведение kCx мало, тогда экспоненту можно разложить в ряд, ограничиваясь двумя первыми членами ряда. Второй случай больших величин произведения kCx (высокая концентрация С, большая толщина слоя реакционной смеси, большая k`, т.е. коэффициент поглощения реагента).
Эффективность использования световой энергии характеризуется квантовым выходом . Это отношение числа прореагировавших молекул к числу поглощенных квантов. По второму закону фотохимии =1. Но величины составляют от долей сотых единицы до нескольких тысяч. Это не означает, что закон эквивалентности не выполняется, но показывает, что механизм процесса сложный. Если < 1
28

– значительная часть молекул А* дезактивируется, если > 1 процесс идет по цепному механизму с участием высокоактивных частиц – радикалов.
В видимой части спектра наиболее активны фиолетовые лучи (их длина волны 400 нм), а наименее активны красные лучи (750 нм). Вот почему для дезинфекции помещений использую ультрафиолетовые лампы, а фотографии проявляли раньше при красном свете.
Энергию, которая поглощается одним молем вещества можно рассчитать по формуле, полученной из 2-го закона фотохимии (h – постоянная Планка, с – скорость света)
EM |
N A |
h |
6,02 1023 |
hc |
(1.19) . |
|
|
|
|
||||
|
|
|
|
|
|
|
Для |
приведенной выше схемы |
с обратимой первой |
||||
стадией A h А* k2 Р с константами прямой k1 и обратной k 1 реакций запишем условие стационарности процесса dC * / dt k1C k 1C * k2C* 0 и с учетом w2 k2 C * получим связь квантового выхода и констант
скорости w2 / w0 |
|
|
k2 |
, где k 1 |
константа скорости |
|
k2 |
k 1 |
|||||
|
|
|
|
стадии дезактивация А* с излучением. Отметим, что в этом анализе не учитывается дезактивация А* с превращением энергии в теплоту (безизлучательный переход).
Фототерапия объединяет применение в медицине разных типов излучений (лазерное, ультрафиолетовое и инфракрасное). Специфические свойства лазерного излучения (высокая плотность энергии, монохроматичность, когерентность, поляризация) открывает широкие возможности применения в онкологии, косметологии и др..
Радикальные реакции характеризуются низкими значениями энергии активации реакции ( 0 5 кДж/моль) и большими значениями предэкпоненциального множителя
29
уравнения Аррениуса. Свободным радикалом (R ) называется неустойчивая частица, образующаяся из молекулы при разрыве одной или нескольких химических связей. В этом случае у частицы появляется неспаренный электрон, из-за чего она обладает высокой активностью. Точку ставят над или рядом с символом атома, обладающего неспаренным электроном. Радикалами могут
быть атомы (H , Cl ) и фрагменты молекул СН3, NH2, NO , СОСН3, ОН. Радикалы образуются под действием света, рентгеновских лучей, ультразвука, при термической активации и в электрических разрядах. Метильный радикал «живет» 0,01с, а радикал трифенилметила C(C6H5)3 секунды.
С образованием радикалов и их реакциями связано биологическое действие излучений. При активации воды в клетках образуются H , OH, которые взаимодействуют с белками и ферментами и это нарушает функции организма.
Радикалы являются участниками цепных процессов. Цепными называются химические реакции, в которых
появление активной частицы вызывает превращение большого числа неактивных частиц. Такие реакции бывают неразветвленные и разветвленные. Результатом последней является взрывной характер процесса.
Реакция начинается с образованием свободных радикалов (зарождение цепи), например при крекинге этана образуются два метильных радикала С2Н6 2 СН3 . Реакция зарождения цепи является элементарной. После зарождения цепи происходит еѐ развитие, что характеризуется длиной цепи. В результате столкновения активных частиц со стенкой сосуда (М) и друг с другом происходит обрыв цепи, например, Cl + Cl +M Cl2 + М.
Примером цепной реакции полимеризации может служить получение поливинилхлорида из газообразного хлористого винила СН2=СHCl. Реакции с разветвленными цепями (взрыв или воспламенением) характерны для Н2+О2 смесей.
30

КАТАЛИЗ
Катализ (разрушение от греч. «katalysis») явление увеличения скорости реакции в присутствии веществ – катализаторов (положительный катализ), которые, участвуя в превращениях, не входят в состав конечных продуктов. Если скорость реакции уменьшается, то такие вещества называются ингибиторами, а катализ отрицательным. Катализаторы и ингибиторы не влияют на состояние равновесия, а лишь ускоряют или замедляют его. В случае гомогенно-каталитических реакций катализаторы остаются химически неизменными, но в гетерогенных процессах катализаторы изменяют свои свойства под действием реакционной среды, например, происходит дезактивация их поверхности вследствие углеотложения.
Увеличение скорости реакции под влиянием катализатора связано с уменьшением энергии активации реакции. Используя уравнения Аррениуса для некаталитической и каталитической реакции с энергиями
активации Еа.кат, Еа,.безкат, можно рассчитать это увеличение скорости (константы скорости) реакции при Т=const.
k |
кат |
|
|
Е |
(1.20) , где Еа Еа,безкат Еа,кат |
|
ln |
|
|
|
а |
||
|
|
RT |
||||
k |
|
|
|
|
||
|
,без |
|
|
|
||
Взаимодействие катализатора К с реактантами принято сводить к двум схемам, приведенным ниже для бимолекулярной реакции A+B +K AB +K.
|
. Слитно |
|
. Раздельно |
1. |
A+B +K (ABK) |
1. |
A + K (AK) |
2. |
(ABK) AВ + K |
2. |
(AK) + B (ABК) |
|
|
3. |
(ABК) AB + K |
В слитном (синхронном) механизме происходит одновременное взаимодействие всех исходных веществ с катализатором с образованием активированного комплекса (ABK) , распад которого даѐт продукт АВ.
31

В стадийном (раздельном) механизме образуется два комплекса с катализатором – сначала (AK) , потом (ABК) . Изменение энергии системы для II показано на рис. 1.16.
Рис. 1.6.
Энергетическая
диаграмма
каталитической
реакции с раздельным
механизмом
Разделение реакции на несколько стадий уменьшает число и суммарную энергию разрыва химических связей в каждой стадии. Значения предэкспоненциальных множителей увеличиваются, так как уменьшается молекулярность стадий, а активированные комплексы имеют простое строение. Раздельный механизм осуществляется при высоких температурах (600-800 оК), а слитный при более низких (300-400 оК).
Слитный механизм характерен для гомогенного и ферментативного катализа, а стадийный для гетерогенных каталитических реакций, протекающих при
более высоких температурах. |
|
|
|
Гетерогенным |
называется |
катализ, |
когда |
реагирующие вещества и катализатор находятся в разных фазах, а гомогенным в одной фазе (жидкой или газовой).
По механизму процесса различают |
окислительно- |
восстановительный, кислотно-основной, |
ферментативный |
и стереоселективный катализ (энантиокатализ). Три последних наиболее важны для биологических систем.
32
