
ФЕНОЛЫ
Фенолы - ароматические соединения общей формулы Ar(OH), в которых ароматическое ядро непосредственно связано с гидроксильной группой (Arарены).
По количеству гидроксильных групп различают одноатóмные и многоатόмные (двух-, трехатомные́ и т.д.) фенолы.
OH |
|
OH |
OH |
|
OH |
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
о-,м-,п-метилфенолы, |
о-оксифенол, м-оксифенол, |
|
|
|
|
||||||||||
фенол |
о-,м-,п-крезолы |
пирокатехин |
резорцин |
п-оксифенол |
||||||||||||||
(карболовая |
|
|
|
|
|
|
|
|
|
|
|
|
гидрохинон |
|||||
кислота) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
одноатомные фенолы |
|
|
|
двухатомные фенолы |
||||||||||||||
OH |
OH |
OH |
OH |
 OH
OH 
 2,3-диоксифенол, пирогаллол α-нафтол β-нафтол трехатомный фенол
2,3-диоксифенол, пирогаллол α-нафтол β-нафтол трехатомный фенол
одноатомные фенолы нафталинового ряда
Все фенолы являются антисептиками, пирокатехин и пирогаллол получены при нагревании из природных соединений. Сам фенол использовался некоторое время в качестве антисептика в медицине, затем были обнаружены его канцерогенные свойства. Канцерогенность другого соединения – бензола является следствием его превращения в фенол в нашем организме в процессе метаболизма.
230

Методы получения фенолов (одно- и двухатомных́ ), нафтолов
Cl |
|
OK (Na) |
NaOH |
|
|
|
|
SO3Na |
||||
|
|
|
||||||||||
|
|
|
KOH (раствор) |
|
|
|
|
|
|
|||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
200°C |
|
|
|
|
|
|
|
|
360°C, 315 атм. |
|
|
|
|
|
|
|||
|
|
|
фенолят K (Na) |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
HCl (или H2SO4)
OH
+ KCl (или NaCl) K2SO4 (или Na2SO4)
фенол - белое кристалическое вещество, темнеющее при стоянии
|
SO3Na |
1) NaOH |
OH |
|
|
200°C |
+ Na2SO3 |
|
|
2) HCl |
|
|
|
OH |
β-нафтол |
OH |
|
|
|
Cl |
NaOH |
OH |
+ NaCI |
|
|
|
|
|
сплавление |
|
|
о-хлорфенол |
|
пирокатехин |
|
SO3H |
|
OH |
|
|
2NaOH |
|
+ 2Na2SO3 |
|
сплавление |
||
SO3H |
OH |
||
м-бензолсульфокислота |
резорцин |
|
|
231
OH |
|
OH |
|
NaOH |
+ Na2SO3 |
|
сплавление |
|
|
|
|
SO3H |
|
OH |
п-фенолсульфокислота гидрохинон
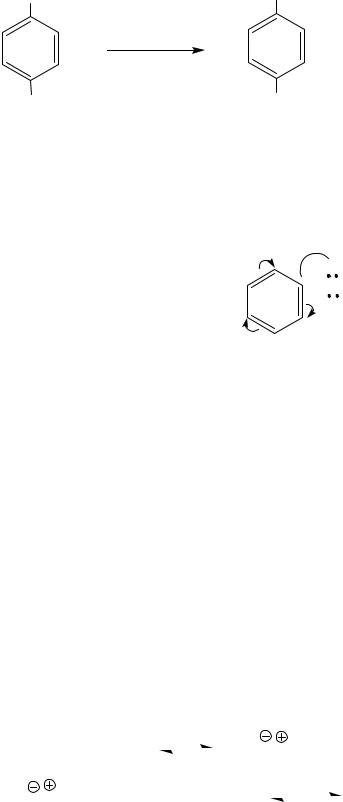
Реакционная способность фенолов и нафтолов
-δ
 O
O H
H
-δ |
-δ |
Для фенола характерны реакции по ОН-группе и ароматическому ядру (SEArH, орто-, пара-ориентация). Связь С-О носит характер двоесвязанности за счет р,π-сопряжения НПЭ атома кислорода и р-электронов ароматического ядра, поэтому реакции замещения гидроксильной группы на галоген и
реакция этерификации карбоновыми кислотами практически не идут
(сравните с алифатическими спиртами).
I. Реакции по гидроксильной группе
1. ОН-кислотность
Фенолы – слабые ОН-кислоты, рКа фенола составляет 9,98. Тем не менее фенолы более сильные кислоты, чем одноатомные и многоатомные спирты, но слабее ~ в 3000 раз угольной кислоты, что подверждается ниже приведенными реакциями:
C6H5OH |
+ NaOH |
|
|
|
|
C6H5O Na |
+ |
H2O |
|
||
|
|
|
|
||||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
фенолят натрия |
|
|
|||
C6H5O Na |
+ |
CO2 + H2O |
|
|
|
C6H5OH + |
NaHCO3 |
||||
|
|
|
|||||||||
|
|
|
|||||||||
Кислотность фенолов зависит от природы заместителя (донор или акцептор электронов), его положения относительно ОН-группы и количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры электронов уменьшают кислые свойства фенолов, акцепторы электронов их
232

увеличивают, что коррелируется со значениями рКа производных фенолов в следующем ряду.
OH |
|
OH |
OH |
|
OH |
|
|
NO2 |
NO2 |
||
|
|
OH |
NO2 |
||
|
|
|
|
||
< |
|
< |
< |
< |
|
CH3 |
NO2 |
|
NO2 |
|
NO2 |
pKa 10,18 |
8,30 |
7,22 |
7,16 |
|
0,2 |
2,4,6-тринитрофенол, пикриновая кислота
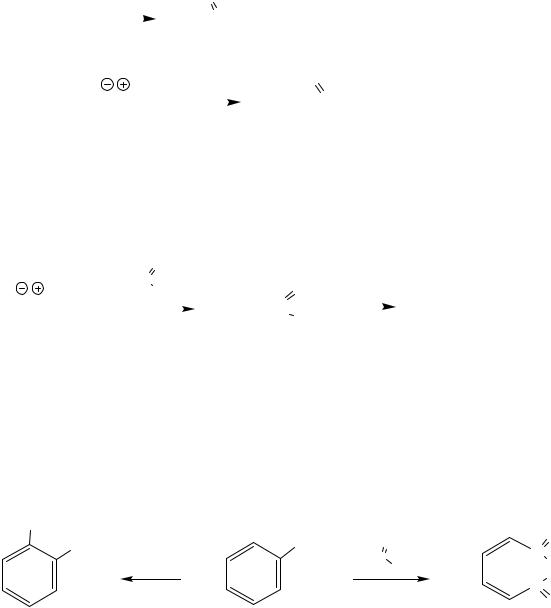
2. Алкилирование и ацилирование фенолов (образование простых и сложных эфиров)
Эти реакции относятся к реакциям нуклеофильного замещения SN, при этом фенолы проявляют свойства нуклеофилов. Их нуклеофильные свойства ниже, чем у спиртов, что является следствием р,π-сопряжения неподеленной пары электронов кислорода в ОН-группе с р-электронами ароматического ядра.
ArOH < ROH ; ArO < RO |
как Nu |
а) Алкилирование
Простые эфиры фенолов образуются только из фенолятов, получить их аналагично алифатическим спиртам в присутствии серной кислоты или оксида алюминия невозможно. Феноляты получают действием щелочи, этилата натрия, далее действуют галогенидом или диметилсульфатом (сложный эфир серной кислоты и метанола).
|
|
|
C2H5ONa |
|
R-Hal |
|
|
|
|
|
|
|
|||||||||||
ArOH |
|
|
|
ArO Na |
|
|
|
|
ArOR |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
- NaHal |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
ONa |
|
|
|
|
|
|
|
|
OCH3 |
|||||
|
|
|
|
(CH3O)2SO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Na2SO4 |
|
|
|
|
|
|
|
|
|
|
|
NaOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
анизол |
|||
233
б) Ацилирование
Сложные эфиры фенолов получают ацилированием с помощью сильных ацилирующих агентов – ангидридов (в присутствии фосфорной кислоты) и хлорангидридов (используют феноляты), этерификация под действием карбоновых кислот не происходит.
(CH3CO)2O |
|
O |
|
||
|
Ar-O-C-CH3 |
+ CH COOH |
|||
ArOH |
|
|
|||
|
|||||
|
H3PO4 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
арилацетат |
O |
|
|
|
|
RCOCl |
||
ArOH (или ArONa) |
|
Ar-O-C-R |
|||
|
|
|
|||
|
- HCl |
||||
|
|
|
|
||
в) Образование арилоксиуксусных кислот
Реакцию используют для идентификации фенолов (температуры плавления этих производных приведены в таблицах).
|
O |
|
|
|
|
|
Cl-CH2-C ONa |
|
O |
H3O+ |
|
ArONa |
|
ArO-CH2-C |
ONa |
|
ArO-CH2-COOH |
|
|
|
|||
-NaCl |
|
арилоксиуксусные кислоты |
|||
|
|
|
|||
|
|
|
|
||
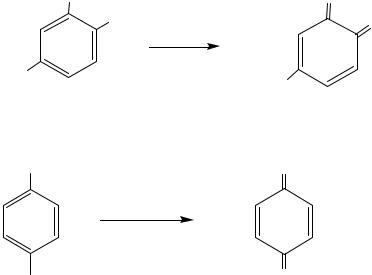
II. Реакции окисления фенолов
Фенолы легко окисляются, в том числе и при стоянии на воздухе. Ниже приведены варианты окисления фенолов, относящиеся к препаративным синтезам.
OH |
|
|
O |
O |
||
OH |
|
OH |
||||
H2O2 |
C OH |
|||||
|
|
R-C |
OOH |
|||
|
|
|
|
C OH |
||
|
Fe+3 |
|
CH3COOH |
|||
|
|
O |
||||
-H2O
(Z,Z)-2,4-гексадиен-1,5-диовая кислота, муконовая кислота
234
HO |
|
O |
OH |
Ag2O |
O |
|
|
+ Ag
CH3 |
эфир |
CH3 |
|
|
или Ag(NH3)2OH |
|
4-метил-о-бензохинон |
OH |
O |
KBrO3/H2SO4
или Ag(NH3)2OH -Ag
OH |
O |
|
п-бензохинон
III. Реакции электрофильного замещения
Реакции электорофильного замещения для фенола идут легко и в мягких условиях в о- и п-положения ароматического ядра. Условия и состав реагентов обычно специальные и отличаются от таковых для бензола и его гомологов.
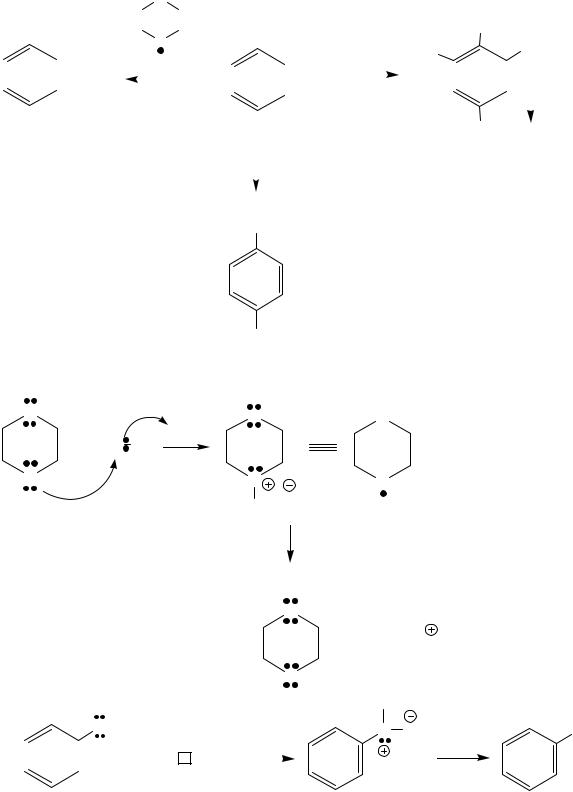
1. Галоидирование
Моногалоидирование возможно при использовании диоксан бромида или хлористого сульфурила, реакция с бромной водой приводит к образованию 2,4,6-трибромфенола (качественная реакция). Галоидирование галогеном в присутствии кислоты Льюиса (хлорид алюминия) не реализуется. Фенол является основанием Льюиса и образует соли с кислотами Льюиса, далее эта соль выводится из реакции.
235
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||
|
OH |
|
|
|
OH |
|
OH |
|||||||||||
|
|
|
|
|
|
O |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
3Br2 |
Br |
|
|
Br |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
Br |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
+ 3HBr |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- HBr |
|
|
|
|
H2O,20° |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|||
|
Br |
|
SO2Cl2 |
|
||||||||||||||
п-бромфенол |
|
|
2,4,6-трибромфенол |
|||||||||||||||
|
хлористый |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
сульфурил |
(белый осадок, качественная реакция) |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
OH
+ SO2 + HCl
Cl
|
п-хлорфенол |
O |
O |
+ |
Br Br |
O |
O |
|
Br Br |
O
O
|
|
|
OH |
|
|
|
|
|
+ |
AlCl3 |
|
|
|
|
|
||
основание Льюиса |
кислота Льюиса |
||||
O
диоксан бромид - мягкий бромирующий агент
O
Br2
+Br (E+)
H
O AlCl3 |
OAlCl2 |
- HCl
236
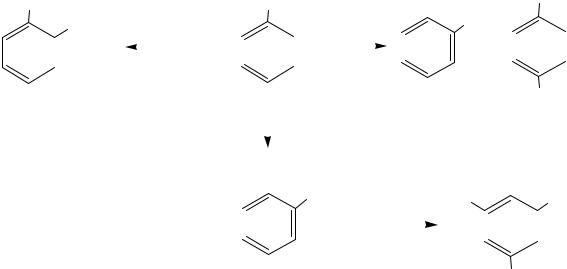
2. Нитрование |
|
Для нитрования используются мягкие условия - |
разбавленная или |
концентрированная азотная кислота в присутствии |
уксусной кислоты. |
Применение нитрующей смеси приводит к полному осмолению фенола. С помощью диоксида азота можно ввести две нитро-группы и далее получить 2,4,6-тринитрофенол (пикриновую кислоту).
OH |
HNO3 /( H2SO4 |
|
OH |
|
|
|
|
OH |
|
|
OH |
||||||||||||
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
||||||||||
|
|
NO2 |
каталитическое |
|
|
|
|
|
разб. HNO |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
количество) |
|
|
|
|
|
|
3 |
|
|
|
+ |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
CH3COOH |
|
|
|
|
|
0° C |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
- H2O |
|
|
|
|
|
-H |
O |
|
|
|
|
|
|
|
|
|
|
|
||
70-75% |
|
2 |
|
|
|
|
|
|
|
|
|
NO2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
N2O4 |
|
|
|
|
о-нитрофенол |
|
п-нитрофенол |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(немного) |
||
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||||
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
NO |
|
|
|
NO2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
HNO3 |
|
дым. |
2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
NO2 |
||||||
|
|
|
|
|
NO2 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
2,4-динитрофенол |
|
|
|
|
|
|
2,4,6-тринитрофенол |
|||||||||||||
3. Сульфирование
Сульфирование фенола проводится как и для других аренов концентрированной серной кислотой, при этом всегда образуются два соединения – о- и п-фенолсульфокислоты. При низкой температуре основным продуктом является о-фенолсульфокислота, при высокой - п- фенолсульфокислота.
237

|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
OH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
OH |
15-20°C |
|
|
|
|
|
SO3H |
+ |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
- H2O |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
к.H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
о-фенолсульфокислота |
|
|
|
|
HO3S |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
(главный продукт) |
|
|
|
|
|
|
|
п-фенолсульфокислота |
|||||
|
|
|
|
100°C |
|
|
HO |
|
|
OH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO3H |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
-H2O |
|
|
|
|
+ |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о-фенолсульфокислота
HO3S
п-фенолсульфокислота (главный продукт)
4. Алкилирование |
|
Фенолы не алкилируются по Фриделю-Крафтсу, так как |
будучи |
основаниями Льюиса образуют соли с AlCl3. Алкилирование |
проводят |
галогенидами в специальных условиях, или алкенами с использованием ионообменных смол.
|
|
OH |
|
|
|
OH |
|
|
|
OH |
|
|
OH |
|||||||||
|
|
|
|
|
(CH3)3C-Cl |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
CH |
=CH |
|
|
|
+ |
|
|
|
CH2CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HF |
|
|
|
|
или CH3CH2OH |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
-HCl |
|
|
|
|
ионнобменные |
|
|
|
|
|
|
|
|
|||
|
C(CH ) |
|
|
|
CH2CH3 |
|||||||||||||||||
|
3 |
|
|
|
|
|
|
смолы |
||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
п-третбутилфенол |
|
|
|
|
|
|
|
|
п-и о-этилфенолы |
|||||||||||||
5. Ацилирование
Ацетилирование фенолов по Фриделю-Крафтсу затруднено из-за связывания фенола с катализатором, поэтому для введения ацетильной группы в ароматическое ядро используют перегруппировку Фриса О-ацетильного производного фенола (фенилацетата).
238
OH |
|
|
|
O |
|
|
|
OH |
||||||
|
|
|
O-C-CH3 |
|
|
|
|
|
|
|
|
|||
(CH3CO)2O |
|
|
|
AlCl3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-CH3COOH |
|
|
|
|
нитробензол |
|
|
|
|
|
|
|||
|
HClO4 |
|
|
|
|
|
|
|||||||
|
|
AlCl3 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
COCH3 |
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
п-ацетилфенол |
||||||||
|
|
|
OH |
|
||||||||||
|
|
|
|
|
|
COCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о-ацетилфенол
6. Карбоксилирование (только для фенолов)
Карбоксилирование возможно провести только с использованием фенолята натрия или калия при нагревании и повышенном давлении. Оксид угольной кислоты в реакции выступает в роли электрофила из-за значительного дефицита электронной плотности на атоме С, вступление электрофила в орто- или пара-положение зависит от природы металла (см. реакцию). С помощью этой реакции из фенолята натрия получают салицилат натрия (о- оксибензоат), а затем салициловую кислоту. Из фенолята калия образуется соль п-оксибензойной кислоты.
ONa |
OH |
O |
|
OH |
|
C |
|
COOH |
|||
ONa |
HCl |
||||
|
CO2 |
|
|||
|
125°C , P |
|
-NaCl |
|
о-оксибензойная кислота салициловая кислота (промышленный метод получения)
|
|
|
OH |
|
|
|
OH |
|||||||
OK |
|
|
|
|
|
|
|
|
|
|||||
|
CO2 |
|
|
|
|
HCl |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
200°C , P |
|
|
|
|
-KCl |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
C |
|
|
|
COOH |
|||||||
|
|
|
|
OK |
|
|
|
|
|
|
|
|
||
п-оксибензойная кислота
239
