- •Основные науки о природе (физика, химия, биология), их общность и отличия.
- •Естественнонаучный метод познания и его составляющие: наблюдение, измерение, эксперимент, гипотеза, модель, теория.
- •Микромир, макромир, мегамир, их пространственно-временные характеристики.
- •История атомистических учений.
- •Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества. Объяснение свойств агрегатных состояний вещества на основе атомно-молекулярных представлений.
- •Строение атома (планетарная модель) и атомного ядра. Электрон, протон, нейтрон.
- •Энергия связи (фундаментальные взаимодействия).
- •Ядерная энергетика. Радиоактивные излучения и их воздействие на организм человека.
- •Взаимодействие тел на расстоянии. Гравитационное поле.
- •Взаимодействие заряженных тел и электрическое поле.
- •Электромагнитные волны. Использование электромагнитных волн различного диапазона в технических средствах связи, медицине, при изучении свойств вещества.
- •Концепция Большого взрыва. Возможные сценарии эволюции Вселенной.
- •Состав и строение Солнечной системы.
- •Классы органических соединений.
- •Белки, жиры, углеводы как важнейшие природные полимеры.
- •Наиболее распространенные синтетические полимерные материалы: пластмассы, каучуки, волокна, лаки, клеи.
Классы органических соединений.
Неорганические и органические соединения. Связь между строением молекул и свойствами веществ. Классы органических соединений.
Органическая химия – это раздел химической науки, в котором изучают соединения углерода – их строение, свойства, способы получения и практического использования.
Соединения, в состав которых входит углерод, называют органическими.
Органические соединения, кроме углерода, почти всегда содержат водород, довольно часто – кислород, азот и галогены, реже – фосфор, серу и другие элементы. Однако сам углерод и некоторые простейшие его соединения, такие, как оксид углерода(II), оксид углерода(IV), угольная кислота, карбонаты, карбиды и т. п., по характеру свойств относят к неорганическим соединениям. Поэтому часто используют и другое определение.
Органические соединения – это углеводороды (соединения углерода с водородом) и их производные.
Благодаря особым свойствам элемента углерода органические соединения очень многочисленны. Сейчас известно свыше 10 млн синтетических и природных органических веществ, и их число постоянно возрастает.
Причина такого многообразия состоит в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения: открытые (неразветвленные, разветвленные) и замкнутые;
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
H3C–CH3, H2C=CH2, HCCH;
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняют сочетанием двух факторов:
– наличием на внешнем энергетическом уровне (2s и 2р) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
– малым размером атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи и проявляет валентность, равную IV.
Органические соединения отличаются от неорганических рядом характерных особенностей:
почти все органические вещества горят или легко разрушаются при нагревании с окислителями, выделяя СО2 (по этому признаку можно установить принадлежность исследуемого вещества к органическим соединениям);
в молекулах органических соединений углерод может быть соединен почти с любым элементом периодической системы;
органические молекулы могут содержать последовательность атомов углерода, соединенных в цепи (открытые или замкнутые);
реакции органических соединений протекают значительно медленнее реакций неорганических веществ и в большинстве случаев не доходят до конца;
среди органических соединений широко распространено явление изомерии;
органические вещества имеют более низкие температуры фазовых переходов (tкип и tпл).
Основные положения теории химического строения А.М.Бутлерова
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называют химическим строением и представляют структурной формулой (формулой строения).
Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы.)
Свойства веществ зависят от их химического строения.
По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Структурная формула (формула строения) описывает порядок соединения атомов в молекуле, т. е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывают (такие формулы называют сокращенными структурными).
Примеры
структурных формул некоторых
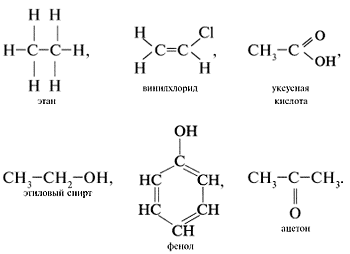
органических соединений:
Молекулярные формулы показывают только, какие элементы и в каком соотношении входят в состав вещества (т. е. качественный и количественный элементный состав). Они в отличие от структурных формул не отражают порядка связывания атомов.
Изомерия
Еще до создания теории строения были известны вещества одинакового элементного состава, но с разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией. В основе изомерии, как показал А.М.Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов.
Изомерия – это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и разные свойства. Например, н-бутан и изобутан имеют одну молекулярную формулу С4H10, но разную последовательность связей и, следовательно, различные физические свойства.
Изомеры состава С4Н10:
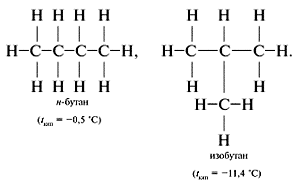
Таким образом, различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами.
В зависимости от того, с каким числом других атомов углерода соединен данный атом углерода, его называют первичным, вторичным, третичным или четвертичным.
Классификация органических соединений
Органические соединения отличаются своей многочисленностью и разнообразием. Поэтому необходима их систематизация. Органические соединения классифицируют, учитывая два основных структурных признака:
а) строение углеродной цепи (углеродного скелета);
б) наличие и строение функциональных групп.
Углеродный скелет (углеродная цепь) – это последовательность всех химически связанных между собой атомов углерода.
Функциональная группа – атом или группа атомов, определяющая принадлежность соединения к данному классу и ответственная за его химические свойства.
Углеводороды
Углеводороды – органические соединения, в состав которых входят только два элемента: углерод и водород. Например, углеводороды – СН4, С2Н6, С3Н6, С6Н6, С8Н10 и т. п. В общем виде – СхНу.
Углеводороды имеют важное научное и практическое значение. Во-первых, представления о строении и свойствах этих веществ служат основой для изучения органических соединений других классов, т. к. молекулы любых органических веществ содержат углеводородные фрагменты. Во-вторых, знание свойств углеводородов позволяет понять исключительную ценность этих соединений как исходного сырья для синтеза самых разнообразных органических веществ, широко используемых человеком.
Углеводороды содержатся в земной коре в составе нефти, каменного и бурого углей, природного и попутного газов, сланцев и торфа. Запасы этих полезных ископаемых на Земле не безграничны. Однако до настоящего времени они расходуются главным образом в качестве топлива (двигатели внутреннего сгорания, тепловые электростанции, котельные) и лишь незначительная часть используется как сырье в химической отрасли промышленности. Поэтому важнейшей задачей является поиск и paзработка альтернативных источников энергии, которые позволят более рационально использовать углеводородное сырье.
Многообразие углеводородов
В силу особенностей строения и свойств углерода его соединения с водородом весьма многочисленны и разнообразны.
Атомы углерода способны соединяться между собой в цепи различного строения:
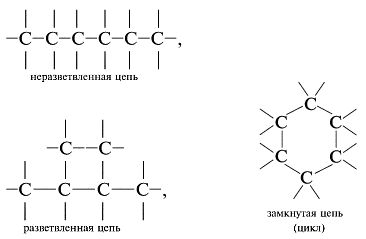
Даже при одинаковом количестве атомов углерода в молекулах углеводороды могут отличаться числом атомов водорода, например: С6Н14, С6Н12, С6Н10, С6Н8, С6Н6. Другой пример – молекулы с четырьмя атомами углерода могут содержать от двух до десяти атомов водорода:Н3С–СH2–CH2–CH3, С4Н10;
Н2С=СH–CH2–CH3, С4Н8;
Н2С=СH–CH=CH2, С4Н6;
НСС–CCH, С4Н2.
Одному и тому же элементному составу молекул (одной молекулярной формуле) может соответствовать несколько различных веществ – изомеров.
Структурные изомеры С4Н8:
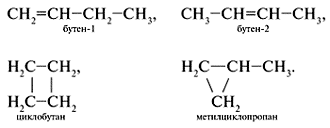
Гомологический ряд алканов
(предельных углеводородов)
Углеводороды, содержащие только -связи (одинарные связи), называют предельными углеводородами.
Предельные углеводороды с незамкнутой углеродной цепью – это алканы, или парафины. Все они являются гомологами простейшего углеводорода – метана – и имеют общую формулу CnH2n+2. Гомологи отличаются друг от друга группой атомов СН2.
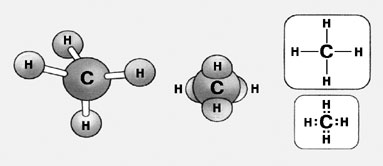
Модели молекулы и формулы метана
Последовательность соединений, в которой каждый последующий член отличается от предыдущего на постоянную группу атомов –СН2–, называется гомологическим рядом (от греч. homolog – «сходный»). Отдельные члены этого ряда – гомологи, а группа атомов, на которую различаются соседние гомологи, – гомологическая разность.
Гомологический ряд алканов неразветвленного строения

Ненасыщенные углеводороды
Углеводороды, в которых между атомами углерода имеются кратные (не одинарные) связи, называют ненасыщенными.
K ненасыщенным углеводородам относятся алкены, алкины, арены.
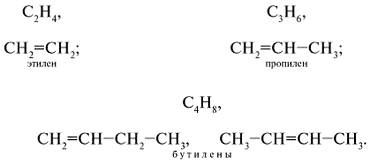
Алкены (этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула алкена – СnH2n.
Простейшие представители алкенов:
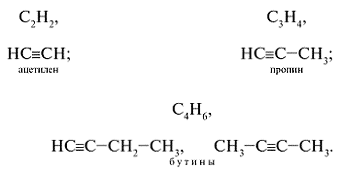
Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов – СnH2n–2.
Простейшие представители алкинов
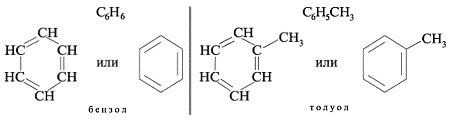
Арены, или ароматические углеводороды, – это соединения, молекулы которых содержат устойчивые циклические группы атомов – бензольные ядра – с особым характером химических связей.
Простейшие представители (одноядерные арены):
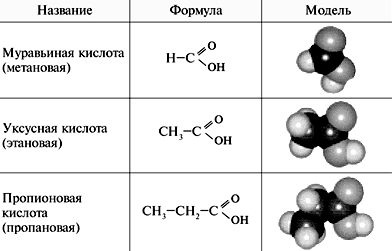
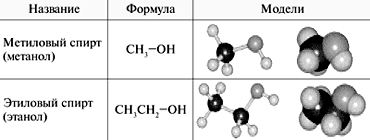
Спирты, карбоновые кислоты
Спирты – соединения алифатического ряда, содержащие одну или несколько гидроксильных групп. Общая формула спиртов с одной гидроксигруппой – R–ОН.
Карбоновые кислоты – органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Карбоксильная
группа содержит две функциональные
группы – карбонил
![]() и гидроксил –ОН, непосредственно
связанные друг с другом:
и гидроксил –ОН, непосредственно
связанные друг с другом: