
Ферменти, застосування в промисловості
Промислове отримання. Вживані нині ферменти отримують з сировини тварини рослинного або мікробного походження, причому останнє джерело є найбільш важливим і поширеним. Тваринні і рослинні ресурси часто обмежені і важкодоступні тоді як виробництво ферментів з мікробіологічних продуктів не обмежене нічим. Різні способи виробництва можуть розрізнятися в деталях, проте усі вони включають стадії екстракції, концентрації, очищення, стабілізації і стандартизації.
Застосування. Число галузей промисловості, в яких використовуються ферменти, постійно зростає, і приведений нижче перелік не можна вважати повним, хоча він охоплює найбільш важливі сфери застосування.
Амілази протеази і липоксидазы застосовуються в хлібопекарській промисловості в якості добавок, що надають пишноту хлібу і іншим виробам, що випікаються. Молоко містить велике число природних ферментів; у молочній промисловості для виробництва сиру застосовують липолитиче-ские і протеолітичні ферменти, ренин використовують для звурджування молока, лактазу-при заморожуванні молочних концентратів і в харчовій сироватці а глюкозооксидазу-для отримання яєчного альбуміну і яєчного порошку.
Ферменти широко використовуються для руйнування фруктової пульпи і освітлення соків і вин. Пектин, глюкозооксидазу, амілазу інвертазу і нарингиназу застосовують в різних процесах при переробці фруктів.
Протеолітичні ферменти, такі, як па-паин, що отримується з плодів азиміни, часто використовують при виробництві м'ясних продуктів для надання м'ясу ніжніших смакових якостей.
Новой але областю, що швидко розвивається, є широке застосування протеолітичних ферментів в якості добавки до миючих засобів для видалення з тканин плям від продуктів органічного походження.
Ферменти обов'язково використовують при освітленні спиртних напоїв отримуваних в основному з сирих крохмальвмісних продуктів, таких, як картопля, жито, пшениця, кукурудза і мал. Ячмінний і кукурудзяний солод, плісневі грибки і дріжджі забезпечують необхідну ферментативну дію. Наприклад, пиво, алкогольний напій отримують з різних ферментованих зернових висівок.
Ферменти іноді застосовують для відновлення смакових якостей і запаху, у виробництві кондитерських виробів, в текстильній промисловості, а також для дублення шкір. Є припущення що в недалекому майбутньому ферменти додаватимуть в корм твариною для полегшення і поліпшення засвоєння кормів.
У фармацевтичній промисловості робиться декілька видів травних ферментів для лікування деяких форм диспепсії і шлунково-кишкових розладів. Найчастіше застосовуються ферменти панкреатин, ренин, пепсин, трипсин, каталаза і ліпаза. Інший протеолітичний фермент, хімотрипсин, застосовують при запальних процесах, для прискорення загоєння хронічних виразок, а також при флебітах.
Муколітичний фермент гиалуронидаза сприяє абсорбції введених рідин і ресорбції транссудатів, наприклад речовин, що утворюються при травмах тканин, і так далі. Фермент лізоцим служить в якості антибактеріального і антивірусного засобу.
Стрептокіназу і стрептодорназу застосовують для прискорення розсмоктування тромбів і фибринозних або гнійних утворень, особливо при відсмоктуванні або дренажі. Папаїн застосовують в косметиці як засіб, що очищае шкіру.
Ферменти
Ферменти біологічні каталізатори білкової природи, реакції в організмі проходять з допомогою каталізаторів. Всі відомі каталізатори є білками.
Виявлено близько 2 тис. ферментів. В чистому вигляді одержано 200.
Ферменти називаються ензими. Назви зв`язані з функціон. дріжджів.
Ензими озн. “в дріжджах”. Ферменти - “бродіння”
В 1815 р. вчений Кірхгофф встановив, що крохмаль під дією пророщеного зерна перетворюється в глюкозу. Пізніше цю речовину було названо діастазою.
В 1836 р. вчений Барцеліус назвав прискорення перебігу реакції каталізом, а речовину, яка це викликає - каталізатором. Слово “фермент” означає “бродіння”. Багато ферментів спочатку вивчали у процесі бродіння.
Ферм. біол. речовини білкової природи, які виконують каталітичні функції в живих організмах.
Наука про ферменти називається ферментологія або ензімологія.
Швидкість реакцій визначається величиною енергії активації. Чим вона менше тим швидкість реакції більша, і навпаки.
Будова ферментів
Бувають простими (однокомпонентні) і складними (двокомпонентні).
Двокомпонентні ферменти називаються холоферментами.
білкова частина (апофермент) + небілкова частина кофермент або активна група або агон)
Білкова частина відповідає за специфічн. (спорідненість до субстрату) дії фермента, так як небілкова частина може входити до складу різних ферментів.
Наприклад: НАД - небілкова частина входить до складу алкогольдегідрогенази.
Небілкова частина ферменту відповідає за катал. активність фермента, тобто контакт субстрата і фермента, стабілізація акофермента.
Небілковою частиною двокомпонентних ферментів можуть виступати НАД, ФАД, флавінмононукл., КоА, АТФ, вітаміни, метоли (Fe, Co, Cu).
Фермент діє на субстрат не усією молекулою, а активним каталітичним центром.
Активний центр однокомпонентних ферментів це якісь функц. групи, СООН, ОН, СН.
Активний центр двокомпонентних ферментів виступають іони металів, вітаміни, функціональні групи.
Алостеричний центр- приєднання ефекторів, тобто активаторів і інгібіторів, які підвищують чи гальмують дію ферментів.
Кожен фермент має 4 рівні структурної організації.
Перший фермент (1963р) лізоцин і рибонуклеїда - відокр. первинна структура, більше 100 амінокислот. залишки, прості ферменти. Вторинна для ферментів характерна незначна спіралізація. Наприклад, альбумін крові, 50% спіралізовані; гемоглобін - 75%, спіралізовано; пепсин - 28% спірал., хімотрепсин - 8%.
Трет. більшисть ферментів мають глобулярну форму, інколи вигнута і не упорядочена.
Для багатьох ферментів характерна наявність четр. структури - складається з декількох субодиниць.
Алкогольдегідрогіназа (остання стадія спиртового бродіння) скла-дається з 2-х субодиниць.
Альдолаза - 4 субодиниці. Піруватдегідрогеноза складається з 3-х ферментів і всього 72 субодиниці.
Молекулярна маса ферментів від 12 тис.- млн. Лізоцим - Mm=14600, пепсин А - Mm=35000, анкогольдегідрогеназа - Mm=80000, альдолаза-Mm=120000 тис.
Лактатоегідрогеназа - є 5 ізоферментів в залежності від органу, каталізують одну і ту ж реакцію, можна розділити за допомогою електро-форезу.
Внутрішньоклітинне розподілення ферментів:
Ферменти локалізовані у всіх компартментах клітин
В мітохондріях діють ферменти енергетичного обміну
В апараті Гольджі - ферменти, які каталізують дозрівання білків
В ядрі - ферменти, які каталізують синтез інформаційних макромолекул, а також процеси їх дозрівання, функціонування і розпаду
В лізосомах — гідролітичні ферменти
В ендоплазматичному ретикулумі - ферменти, які захищають клітину від дії чужорідних хімічних речовин (ксенобіотиків)
Властивості ферментів
Ферменти за властивостями відрізняються від звичайних каталізаторів.
Фермент каталізує пряму і зворотню реакцію за винятком регуляторних ферментів.
Ферменти не утворюють побічні продукти
Для ферментів характерна чітка локалізація в клітині.
Ферменти можуть утворювать мультиферментні системи.
1. Всі ферменти представляють собою глобулярні білки (єдиним виключенням -рибозима, яка каталізує самосплайсінг);
2. Збільшують швидкість реакції, але самі в ній не витрачаються (зараз доведено, що деякі ферменти в кінці хімічної реакції піддаються модифікації і навіть розпаду, а не вивільняються у незмінному вигляді, як постулював Міхаеліс); звільнюючись, ферменти можуть знову реагувати з новими молекулами субстрату;
3. Їх присутність не впливає ні на природу, ні на властивості кінцевого продукту реакції;
4. Дуже мала кількість ферменту викликає перетворення великої кількості субстрату. Наприклад, одна молекула ферменту реніну, що міститься в слизовій оболонці шлунку теляти, створожує близько 106 молекул казеїногену молока за 10 хвилин при 370С;
Активність
Для ферментів характерна винятково висока активність, 108, 1020 разів.
Існують різні одиниці активності: є загальні (стандартні), промислові (спеціальні).
Загальна - стандартна - кількість фермента, який перетворює 1 мкмоль елемента за 1 хвилину.
Молярна активність (число обертів) - це число молей речовини, яке перетворюється 1 молем фермента за 1 хвилину.
Існує декілька міжнар. одиниць.
Е - активність - така кількість ферменту, яка каталітично перетворює 1 мкмоля субстрату (S) за 1 хв. Умови оптимальні.
Користуються таким поняттям - питома активність, якесь число ферментів в перерахунку на 1 мг загального білка. Питому активність використовують, коли очищують фермент або виділяють його з чогось.
Є поняття - число оборотів ферменту - число молекул субстрата перетвореного за 1 хв. Якщо субстратом є велика величина, то рахують число зв`язків, які атакуються ферментом.
Наприклад, - галактозидаза (лактаза) число обор. = 12500. Таке число мол. лактози буде прогідролізовано при оптимальних умовах.
Наприклад, - аміноза каталітичний гідроліз крахмалу. Ми рахує-мо кількість зв`язків в мол. крахмалю число обор. = 1100000.
Є одиниця - 1 катал: замість Е , щоб привести в с-му СІ. 1 катал - така кількість ферменту, яка здатна перетвор. 1 моль субстрата за 1с. Ця одониця дуже велика (нкатал, пкатал.).
В харчовій промисловості використовують свої одиниці активності, активність називають здатністю:
Мольтазна здатність (М3) - це кількість фермента, яка розщеплює 1 мг мальтози за 1 годину.
Амілазна здатність (АЗ) - це кількість фермента, яка розщеплює 1 г крохмалю до декстринів, які не забарвлюються йодом.
Інвертазна здатність - це кількість фермента, яка розкладає 1,25 г сахарози за 1 хвилину.
Протиолітична здатність (ПЗ) - це кількість фермента, яка утворює 1 мг амінного азоту за 1 годину.
6. Специфічність.
Ця властивість різко відрізняє їх від неорганічних каталізаторів. Так, платина та паладій можуть каталізувати відновлення десятків тисяч сполук. Ферменти ж мають дуже високу специфічність. В залежності від механізму дії розрізняють ферменти з абсолютною, груповою та стереохімічною специфічністю.
Абсолютна специфічність ферментів- діє на 1 субстрат і не діє на подібні. Наприклад, уреаза кат. гідроліз сечовини на вуглекислий газ і аміак.
Групова специфічність - може бути 2-х видів: абсолютна групова і відносна групова.
Абсолютно групова специфічність – здатність ферментів діяти на певний тип хімічного звязку, утворений певними радікалами (атомними групами). Так, пепсин гідролітично розщеплює пептидний звязок, утворений аміногрупами тирозину та фенілаланіну; карбоксипептидаза відщеплює в пептидах з С-кінця майже всі амінокислоти; мальтаза гідролізує всі субстрати, до складу яких входить –глікозидний звязок.
Відносно групова специфічність (специфічність за типом звязку) – здатність ферменту діяти на певний тип хімічного звязку, утворений радікалами будь-якої хімічної будови. До таких ферментів належать ліпази та естерази, що розщеплюють не тільки різні триацилгліцериди, а й ді- та моноацилгліцериди та інші складні ефіри.
Оптична або стереохімічна специфічність – здатність ферменту діяти лише на одину стереоізомерну форму субстрату. Так, -Д-глюкозооксидаза, діє лише на -Д-глюкозу.
При наявності стереоізомерів, фермент діє тільки на 1 стереоізомер.
7. Лабільність - залежність активності ферментів від температури, рН, концентрації субстрату і ферменту, вологості, окисно-відновного потенціалу, наявності активаторів та інгібіторів.
– вплив умов середовища на дію ферментів.

Фактори, що впливають
на активність ферментів



Активатори та інгібітори
Температура середовища

рН
Саморегуляція дії ферментів.
Живі організми здатні до саморегуляції активності ферментів в залежності від зміни умов зовнішнього середовища. Це саморегулювання відбувається двома шляхами: 1. Синтез ферментів. 2. Регуляція активності ферментів.
Важливими факторами, які впливають на активність ферментів є водневий, газовий, світловий, температурний, кислотний режими середовища. На активність ферментів також впливають концентрації субстратів і різні кофактори, які необхідні для дії ферментів, також наявність активаторів та інгібіторів.
Оборотність дії ферментів.
Якщо фермент каталізує хімічну реакцію, яка є оборотною, то він прискорює як пряму, так і зворотну реакції. Напрямок процесу визначається концентрацією вихідних і кінцевих продуктів.
Теорія ферментативного каталізу
Біологічне призначення ферментів полягає в направленні підвищення швидкості біохімічних реакцій.
Ферменти – це біокаталізатори. Обмін речовин визначається певним набором ферментів. Всі ферментативні реакції в організмі проходять при нормальній температурі, тиску і відбувається в нейтральному, слабокислому і слаболужному середовищах.
1814 рік – були відкриті ферменти (Кіргоф). Він знайшов речовини, які при дії на крохмаль перетворювали його в цукор. Пізніше цю речовину було названо діастазою. Зараз вона називається амілаза. Наука про ферменти називається ферментологія або ензімологія.
Для того щоб пройшла реакція між речовинами вони повинні бути в активному стані, і повинні мати запас кінетичної енергії. Енергію, необхідну для досягнення активованого стану, або той надлишок енергії порівняно з середньою енергією молекул при даній температурі, яку вони повинні мати, щоб вступити в реакцію називається енергією активації.
Швидкість реакцій визначається величиною енергії активації. Чим вона менше тим швидкість реакції більша, і навпаки.

Теорія ферментативного каталізу заключається в тому, що ферменти знижують енергію активації (Е), утворюючи із субстратом (речовина на яку дію фермент) один або декілька комплексів. Завдяки тому, що ферменти знижують енергію активації ферментативні реакції протікають з високою швидкістю при відносно низькій температурі. Ці реакції можуть бути багатостадійними і протікати не в один етап, а ступінчатою - через кілька проміжних реакцій. Активаційний бар’єр при цьому розбивається на кілька низьких бар’єрів кожної проміжної реакції, і ці бар’єри легше ніж один великий бар’єр.
Ферменти знижують енергію активації значно більше ніж неорганічні каталізатори.
Приклад: при гідролізі сахарози на глюкозу та фруктозу енергія активізації без каталізатора складає 134 кДж/моль, з іонами водню, в якості каталізатора Е=105 кДж/моль, а з ферментом бета – фруктофуранозидазою Е=39,5 кДж/моль.
Механізм дії ферментів.
Ведучу роль в механізмі ферментативного каталізу відіграє утворення ферментсубстрактного комплексу.
Воно відбувається поетапно:
1 етап: субстрат з’єднується з ферментом
2 етап: активація і видозмінення субстрату з утворення одного або декількох активованих комплексів.
3 етап: відділення продуктів реакції від ферменту.
E+S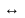 ESES*E+P
ESES*E+P
1 етап – проходить найшвидше (енергія активації – найменше). Це свідчить про те, що фермент і субстрат зв’язані слабкими типами зв’язків.
2 етап – відбувається розрив і утворення ковалентних міцних зв’язків. На цьому етапі фермент змінює субстрат, зменшується енергія активації, зменшується міцність хімічних зв’язків і реакція набуває великої швидкості.
В утворенні ES приймають участь водневі, іонні і гідрофобні зв’язки. Існування ES становить соті долі секунди.
Кінетика ферментативних реакцій.
Швидкість ферментативних реакцій, як і всіх інших реакцій залежить від різних факторів.
Швидкість визначається кількістю речовин, які прореагували за одиницю часу при заданих умовах.
Швидкість залежить від активності ферменту. Активні ферменти виражаються в різних одиницях. Часто активність ферменту визначають по кількості субстрату, який перетворився за одиницю часу. Згідно останнього міжнародного узгодження активність ферментів виражається в “каталах” (кат). Це така активність ферменту, при якій 1 моль субстрату перетворюється за 1 сек. Бувають мікрокатали і мілікатали.
Число одиниць активності ферменту, що припадає на 1 мгр. білка ферментативного препарату називається питомою активністю.
Кількість молекул субстрату, яка перетворилася на 1 хвилину однією молекулою ферменту називається молекулярною активністю.
Основні кінетичні залежності:
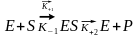 ;
; 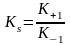
К+1 –константа щвидкості прямої реакції утворення ES кмплексу
К-1 –константа швидкості зворотнььї реакції утворення ES кмплексу
К+2 – константа швидкості розпаду ES комплексу
Міхаеліс та Ментен, використовуючи закон діючих мас описали залежність початкової швидкості реакції від концентрації субстрату.
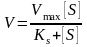
З
цього рівняння слідує, якщо концентрація
S
велика порівняно з Кs,
то V=Vmax.
Оскільки Кs
практично не змінить її значень. Якщо
концентрація S
мала, то
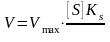 (1)
(1)
Рівняння Міхаеліса враховує тільки 1 стадію (етап) утворення ферменту субстратного комплексу (ES)/
Вчені Холдейн і Брігс запропонували рівняння, яке враховує взаємодію продукту та швидкість реакції.
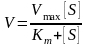 (2),
де Кm
– константа Міхаеліса
(2),
де Кm
– константа Міхаеліса
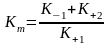 ;
; 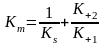
З
рівняння (2) витікає, що якщо концентрація
S=Km,
тоді


При збільшенні концентрації субстрату V збільшується до тих пір, поки не пройшло насичення ферменту субстратом
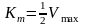
Фізичний
зміст: константа Міхаеліса Кm
дорівнює такій концентрації S,
при якій
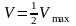
Метод Лайнецевкера-Берка – це метод подвійних зворотніх величин.

ЕФЕКТОРИ
Активатори та інгібітори ферментів.
Активатори - речовини які підвищують активність ферментів. Вони є складовою частиною ферментного центру і сприяють утворенню фермент субстратного комплексу. Активність амілази підвищується в присутності йоду, брому і хлоридів. До них належать катіони металів і деякі аніони (Мg2+, Са2+, Сu2+, Мn2+, Мо2+, Fе2+, СІ-та ін.), мінеральні кислоти (НСl), жовчні кислоти, деякі сполуки з функціональними і рупами (цистеїн, глутатіон), ферменти (ентерокіназа, трипсин
Інгібітори
Інгібітори – речовини, які гальмують ферментативні процеси. (білкові осаджувачі — ССl3СООН, танін, концентровані кислоти, солі важких металів та ін.).
Інгібірування буває оборотним і необоротним.
Оборотне – це коли інгібітор утворює з ферментом слабкий комплекс, який може розпадатись, при цьому фермент звільняється і набуває своєї каталітичної дії. Методом діалізу можна виділити інгібітор з середовища.
Необоротне інгібірування – інгібітор міцно зв’язаний з ферментом. Комплекс, який при цьому утворюється не розпадається. Деякі ферменти повністю інгібуються дуже малими концентраціями іонів важких металів (ртуть, срібло, миш’як, іодоцтова кислота). Вони необоротно з’єднуються з сульфгідрильними групами і викликають осадження білку.
Оборотне інгібірування поділяють ще (за спорідненістю до субстрату) – конкурентне, неконкурентне.
Конкурентне – це коли інгібітор має структуру подібну до структури субстрату, тому між ними виникає конкуренція за взаємодією з ферментом. Конкурентне інгібування спостерігається тоді, коли речовина, близька по структурі до звичайного субстрату ферменту, з’єднується з активним центром, але не може прореагувати з ним.
Так, для лікування інфекційних захворювань. що викликаються бактеріями, використовують сульфаніламідні препарати. Вони мають структурну схожість з параамінобензойною кислотою, яку бактерія використовує для синтезу фолієвої кислоти, що є складовою частиною ферментів бактерій. Завдяки структурній схожості сульфаніламід блокує дію ферменту шляхом витіснення параамінобензойної кислоти із комплексу з ферментом, що синтезує фолієву кислоту, що гальмує ріст бактерій. Це ж явище використовується в хіміотерапії, при якій знищуються хімічними препаратами збудники хвороби, і не пошкоджуються тканини організму-господаря.
Неконкурентне інгібірування – це коли інгібітори взаємодіє з важливими функціональними групами. Ферменти, які не відносяться до активного центру. Це міняє структуру активного центра ферменту. Існують активатори і інгібітори, які приєднані не до активного центру ферменту, а до якоїсь іншої ділянки. Ця ділянка ферменту називається алостеричний центр. Відбувається зміна структури всієї ділянки молекули ферменту і його активного центру. Неконкурентні ігібувітори - не схожі по структурі на субстрат тому в утворенні комплексу з інгібітором бере участь не активний центр, а інша частина його молекули. Утворення такого комплексу приводить до зміни глобулярної структури ферменту і, хоч справжній субстрат при цьому до ферменту приєднується, каталіз виявляється неможливим. Наприклад, цианід зв’язується з іонами металів, що виконують у ферментів роль простетичної групи, і пригнічує активність цих ферментів.
Такий тип гальмування каталітичної активності називається ще алостеричним.
Алостеричні ферменти - їх активність регулюється не їх субстратами, а іншими речовинами, що приєднуються до ферментів на особливих ділянках, віддалених від активного центру. Вони впливають на активність ферменту, викликаючи оборотні зміни в структурі його активно центру. Вони називаються алостеричними ефекторами. В залежності від характеру впливу, який вони спричиняють, збільшуючи чи зменшуючи спорідненість ферменту до субстрату, вони поділяються на алостеричні активатори та інгібітори.
Ділянка молекули ферменту, з якою зв’язуються ефектори, називається алостеричинм центром.
Прикладом алостеричного ферменту може бути фосфофруктокіназа, яка може бути алостерично інгібована АТФ при високій його концентрації. Інгібітором ферментів є фосфорорганічні речовини, серед яких зустрічаються дуже токсичні для деяких видів комах. Тому їх використовують для боротьби з шкідниками. Це хлорофос, дихлофос.
НОМЕНКЛАТУРА ТА КЛАСИФІКАЦІЯ ФЕРМЕНТІВ
НОМЕНКЛАТУРА
Спочатку ферменти називають “випадково”. Тривіальні назви - пепсин (від грецьк. «травлення»), папаїн - (від назви дерева, із соку якого одержували фермент).,
Наприкінці минулого століття було вирішено назвати ферменти по назві речовини, на яку вони діють. Раціональна номенклатура - ферменти називають за субстратом, на який вони діють з додаванням суфікса - аз(а). З'явились назви амілаза, ліпаза, уреаза та ін.{\ 898 р. Дюкло).
У 1962 р в Москві був Міжнародний з”їзд, де рішили називати ферменти так, що було видно до якого класу врни належать і було вирішено кожному ферменту давати шифр, який склад з чотирьох цифр: I цифра - номер класу; II цифра - номер підкласу; III цифра - номер пудпідкласу; IV цифра – індивідуальний номер фермента. Систематична або наукова номенклатура - назви ферментів складаються з двох частин. Перша частина вказує на назву субстрату, на який діє фермент, а друга - на природу хімічної реакції, яку він каталізує, з додаванням суфікса - аз(а). Наприклад, фермент, який каталізує реакцію гідролізу дипептиду гліцин - лейцину, має назву гліцин-L-лейцин-гідролаза. Якщо при ферментативному перетворенні субстрату відбувається перенесення будь-яких хімічних груп з однієї сполуки на іншу, то в номенклатурі ферменту називають обидві речовини, розділяючи їх двома крапками. Наприклад, лактатдегідрогеназа за науковою номенклатурою L-лактат: НАД-оксидоредуктаза.
Наприклад: О-оксидоредуктази - за хімічною групою, яка окислюється.
Гідролази - за типом зв’язку, який гідролізується.
Ліази - за типом зв’язку, що руйнується чи утворюється.
Ізомерази - за типом реакції ізомеризації.
Лігази - за типом зв’язку, який утворюється.
3 - підпідклас - це уточнення природи кожної хімічної реакції.
4 - це індивідуальний номер кожного фермента.
Приклад: КФ : 2, 1, 7, 4 - фосфофруктокіназа.
2 - ІІ клас - трансферази.
1 - підклас - перенесення залишку Р.
7 - підпідклас - уточнення хімічної реакції - перенесення залишку Р на спиртову групу.
4 - індивідуальний номер фермента.
Алкоголь: НАД - оксидоредуктоза (алкогольдегідрогеназа);
Лактат: НАД - ……………………..(лактатдегідрогеназа);
3.2.1.1. α - 1,4 - глюкан -4-глюкогідролаза (α-амілаза);
3.2.1.2. α - 1, 4 - глюкан - мальтогідролаза (β - амілаза).
укладке полипептидной цепи.
Технічна номенклатура (існує в межах СНД) - назва ферментів складається з трьох частин. У першій частині: наводять назву субстрату, що перетворюється, та назву мікроорганізму, який синтезує фермент; у другій - тип культивування мікроорганізму; у третій - ступінь очищення ферментного препарату. Наприклад, амілосубтилін Г10х.
Класифікація і номенклатура
Ферменти класифікують на 6 класів в залежності від типу реакції, які вони каталізують:
Класифікація ферментів
Усі ферменти залежно від реакцій, які вони каталізують, розподіляються на шість класів: оксидоредуктази, трансферази, гідролази, ліази, ізомерази, лігази (синтетази). Залежно від характеру дії, ферменти кожного класу ділять на підкласи, а останні - на підпідкласи.
До складу підпідкласів входять окремі представники ферментів. Кожному ферменту присвоюється шифр (чотиризначний номер), і цифри в якому вказують на приналежність ферменту до певного класу, підкласу, підпідкласу. У підпідкласі ферменту присвоюється порядковий номер. Так, ліпаза, що належить до гідролаз, має шифр: ДФ.3. 1.1.3. Нижче наведена характеристика класів ферментів.
Оксидоредуктази каталізують окисно-відновні реакції - анаеробні нікотинамідні) дегідрогенази, аеробні (флавінові) ферменти, оксидази, оксигенази, гідропероксидази, цитохроми та ін.).
Трансферази каталізують реакції перенесення різних груп від однієї молекули до іншої (розрізняють фосфо-, метил-, карбоксил-, аміно-, форміл-, глікозилтрансферази та ін.).
Гідролази каталізують реакції гідролітичного розщеплення (гідролізу) різних субстратів (розрізняють карбогідрази - амілаза, β-фруктофуранозидаза, α- глюкозидаза; естерази — ліпаза, хлорофілаза, геролестераза; протеази - протеїнази, пептидази та ін.; амідази -уреази, аргіназа тощо).
Ліази - каталізують реакції відщеплення або приєднання за місцем подвійного зв'язку або відщеплення різних груп негідролітичним способ (декарбоксилаза, альдолаза, гідратаза та ін.).
Ізомерази каталізують реакції ізомеризації (внутрішньомолекулярні оксидоредуктази, мутази, цис-транс-ізомерази).
Лігазн (синтетазн) - каталізують реакції синтезу складних сполук із простих за участю макроергічних сполук, зокрема АТФ (ацетил-КоА-синтетаза, карбоксилаза).
Міжнародна комісія по ферментах у 1961р. принцип класифікації ферментів за типом хімічної реакції поклала в основу їх упорядкування:
Клас ферментів |
Тип реакції |
Оксидоредуктази |
Окисно-відновні реакції усіх типів |
Трансферази |
Перенесення окремих атомів або груп атомів від донора до акцептора |
Гідролази |
Гідролітичне розщеплення хімічних зв'язків |
Ліази |
Негідролітичне розщеплення подвійних зв'язків або їх утворення |
Ізомерази |
Взаємоперетворення різноманітних ізомерів |
Лігази |
Утворення зв'язків при взаємодії двох або більше сполук (за допомогою енергії АТФ) |
!! Оксидоредуктази - найбільший клас ферментів. їх назви складають за формою: „донор: акцептор - оксидоредукта-за". Вони відіграють основну роль у процесах біологічного окиснення. Коферменте НАД+ або НАДФ+ є акцепторами водню; ферменти, що каталізують перенесення водню, називають дегідрогеназами, а ті, що каталізують перенесення кисню до субстрату - оксигеназами. Пероксидазами називають ферменти, котрі використовують як акцептори водню перекис водню (Н2О2). Оксидоредуктази поділяють на підкласи за критерієм окиснення тих чи інших хімічних груп, зокрема, від природи донорів водню.
Підклас 1.1. До нього входять ферменти, які діють на СН-ОН-групу донорів (малатдегідрогеназа, алкогольдегідрогеназа та ін.).
Підклас 1.2. До нього входять ферменти, які окиснюють альдегідні або кетонні групи.
Підклас 1.6. Ферменти цього класу відмінні тим, що донором водню для них є відновлені НАД або НАДФ.
Клас оксидоредуктаз містить всього 19 підкласів ферментів.
!! Трансферази здійснюють перенесення груп атомів. їх назви включають в себе такі поняття, як: „донор: акцептор - група, яка переноситься - трансфераза". Ці ферменти поділені на підкласи, які каталізують перенесення вуглеродних залишків.
Підклас 2.1. Ферменти цього підкласу переносять одно-вуглеродні метальні, формільні, карбоксильні та інші залишки (метилтрансфераза, формілтрансфераза).
Підклас 2.2. Ферменти цього підкласу здійснюють перенесення альдегідних та кетонних двох або трьох вуглеродних залишків (транскетолаза, трансальдолаза). Трансферази відіграють важливу роль у процесах взаємоперетворення багатьох речовин, а також в реакціях дезінтоксикації.
Клас трансфераз має всього 8 підкласів.
!! Гідролази - каталізують розщеплення внутрішньо-молекулярних зв'язків за допомогою молекул води. їх назви містять дві частини: субстрат - гідролаза.
Підклас 3.1. До нього входять ферменти, що мають широку специфічність. Вони каталізують гідроліз ефірних зв'язків великої кількості ефірів. Зокрема, тіолестераза каталізує гідроліз тіоефірних зв'язків, які відіграють велику роль в обміні ацильних груп.
Підклас 3.2. До нього входять ферменти, що гідролізують як справжні глікозиди, так і И- або 8-глікозидні сполуки.
Всього клас гідролаз розподіляють на 11 підкласів, які каталізують різноманітні реакції гідролізу.
!! Ліазн руйнують зв'язки С - С, С - N, С - О, С - S з утворенням подвійних зв'язків. Можлива і зворотна реакція, наприклад, приєднання молекул води або аміаку до подвійного зв'язку.
Підклас 4.1. З ферментів цього підкласу найбільш відомі альдолази, які каталізують реакції альдольної конденсації, в основі яких лежить розщеплення або утворення зв'язків С - С.
Підклас 4.2. До нього входять такі С – О - ліази, як фумарат-та аконітатгідратаза, які каталізують зворотне відщеплення молекули води від субстрату.
Всього до класу ліаз входить 7 підкласів ферментів, які беруть участь у процесах синтезу та розпаду проміжних
продуктів обміну речовин.
Ізомерази - каталізують найрізноманітніші процеси ізомеризації. їх систематичні назви враховують назву субстрату, а також тип ізомеризації.
Підклас 5.1. Ферменти цього підкласу - рацемази — каталізують перетворення, наприклад L-амінокислот у D-амінокислоти.
Підклас 5.2. Представниками є цис-транс-ізомерази або епімерази. Ці ферменти викликають взаємоперетворення цукрів, наприклад, галактоза > глюкоза.
Підклас 5.3. Ферменти цього підкласу - мутази — каталізують перенесення хімічних груп з однієї частини молекули до іншої.
Всього до класу ізомераз входить 6 підкласів.
Лігази (синтетазн) каталізують процеси конденсації двох молекул за рахунок енергії АТФ. їх назви включають обидві речовини, що з'єднуються, та фермент лігазу. Наприклад, аспартат: аміак-лігаза.
Підклас 6.1. Ферменти цього підкласу каталізують утворення зв'язків С - О. Цей тип зв'язку має місце, наприклад, при активації амінокислот перед процесом трансляції.
Підклас 6.2. Представниками цього підкласу є ферменти, що каталізують утворення С – S - зв'язків у процесі приєднання ацильних залишків до коензиму А.
Всього до класу лігаз входить 5 підкласів, які включають ферменти анаболічних стадій обміну речовин.
І клас. Оксидоредуктази.
Хар-ть ОВР, тобто перенесення водню.
Діють на слідуючі групи:
СН-СН; С=О; СН-СН; С ; СН-NH2; CH-NH; НАДН і НАДФН.
І клас - окседоредуктази
Окседоредуктази приймають участь у процесах окислення та відновлення речовин в організмі, беруть участь в біологічному окисленні. Біохімічне тому, що відбувається тільки в організмі. За межами організму інше окислення. Окислення дає енергію.
Шляхи окислення: приєднання кисню, відщеплення водню, перенесення електронів.
В організмі окислення відбувається тільки шляхом відщіплення водню та електронів шляхом приєднання кисню немає. Кисень бере участь, але ні до чого не приєднується. Кисень є акцептором електронів, які відщеплюються при біологічному окисленні. Ці електрони походять тільки від водню, що відщеплюється від речовин.
Ферменти цього класу - це в основному дегідрогенази і цитохроми. Вони здійснюють процес біологічного окислення.
Дегідрогенази відщеплюють водень, переносять його, а цитохроми відщеплюють електрони від цього водню.
Перший підклас ферментів.Сюди відносяться ферменти, які каталізують реакції перетворення груп СН, ОН в спиртах, оксикислотах, цукрах і утворюють альдегіди і кетони.
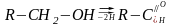
спирт альдпід

кетон
Акцепторами можуть бути коферменти НАД, НАДФ, цитохроми, кисень та інші сполуки.
По тривіальній номенклатурі ці ферменти називаються анаеробними піридиновими дегідрогеназами. Вони переносять водень не на кисень, а на інші органічні сполуки.
Другий підклас ферментів: оксидоредуктази, які діють на альдегідну групу та кетонну групу ефірів.
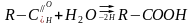
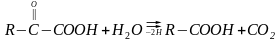
До цього підкласу відноситься фермент гліцераль дегідрогеназа, яка каталізує окислення трифосфогліцеринового альдегіду до 1,3 – дифосфогліцеринової кислоти ( при обміні речовин – гліколізі ).
Третій підклас ферментів: ферменти, які діють на групи донорів – СН2 – СН2- . Вони каталізують перенос водню від груп – СН2 – СН2 – з утворенням груп – СН=СН - .При цьому насичені сполуки перетворюються в ненасичені.
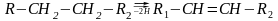
Четвертий підклас ферментів: ферменти, які діють на групи – СН – NH2 – групи донорів. Вони каталізують процеси окислювального дезамінування амінокислот і амінів.
П’ятий підклас ферментів: оксидоредуктази, які діють на відновлення НАД і НАДФ.
Активними групами цих ферментів є ФАД І ФМН. Тривальна назва цих ферментів – аеробні, або флавінові дегідрогенази. Вони можуть переносити водень на кисень.
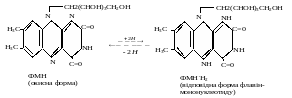
Шостий підклас ферментів: це оксидоредунтази, які діють на групи гендонорів. Цитохром С – оксидаза – відіграє велику роль в процесі дихання в організмі.За його допомогою проходить перенесення електронів від цитохрому А в дихальному ланцюгу до кисню.
Сьомий підклас ферментів: ферменти, які діють на дифеноли і близькі до них сполуки. Ці ферменти називаються оксидази ( процеси окислення фенолів). Поліфенол оксидаза зумовлює потемнення розрізаних половинок яблука, картоплі. Цей фермент відіграє важливу роль в диханні рослин.
Восьмий підклас ферментів: оксидоредуктази, які діють на пероксид водню у вигляді акцептора.
Пероксидаза ( окислення органічних сполук за участю перекису водню) активна група цих ферментів складається з 4 пірольних кілець з’єднаних атомом заліза.
Дев’ятий підклас ферментів: ферменти, які діють на окремі донори з виключенням з них молекули О2 (оксигенази). Ліпооксигеназа – окислює ненасичені жирні кислоти і при цьому утворюються окисні сполуки.
До класу оксидоредунтаз відносяться цитохромна система.
Флавінові дегідрогенази можуть віддавати водень та кисень через цитохромну систему. Цитохромна система складається з цитохромів та ферменту цитоксидази. Цитохроми переносять електрони і приймають участь в ОВР.
Цитохроми – це двох компонентні сполуки, які складаються з білка і простетичної групи. Ці сполуки переносять електрони завдяки зміні валентності заліза.
Дегідрогенази: всі ферменти цього класу є складними білками, їх поділяють на дві групи за структурою і функцією:
а) піридинові;
б) флавінові.
Небілковими частинами є динуклеотиди. Один з них завжди аденіловий, а другий - в першому випадку піридиновий, тому що азотною сполукою є піридинова похідна (вітамін В5); в другій групі - рибофлавін (В2). Тому вони називаються флавінові.
Вони відрізняються і по функції. Піридинові завжди стоять попереду - першими відщеплюють водень від субстрату. Субстрат може віддавати водень.
Флавінові стоять після перідинових. Вони приймають водень від піридинових дегідрогеназ.
Деякі автори поліляють дегідрогенази на аеробні та сенаеробні.
Піридинові дегідрогенази. Коферментами є нікотинамід аденін динуклеотид НАД.
Флавінові дегідрогенази
Кофермент – флавінаденіндинуклеотид
Цитохроми переносять електрони завдяки тому, що в їх складі є залізо, яке здатне змінювати валентність. Відомо біля 20-ти цитохром. Вони позначаються буквами а, в, с\, d\, … В процесі біологічного окислення беруть участь цитохроми а, в, с і а\. Будова цитохром теж двокомпонентні. Небіякова частина – залізопорфірини.
Цитохром С.
Важливими представниками оксидаз є полiфенол оксидази, які окислюють фенольні і поліфенольні сполуки: пірокатехін у відповідний фенол; дубильні речовини у катехіги.
До складу небілкової частини поліфенолоксидази входить мідь Cu.
Значення поліфенолоксидази має при виготовленні чорного чаю. При виготовленні зеленого чаю дія поліфенолоксидази зупиняється під дією випарювання.
Пероксидаза оксилює органічні сполуки за допомогою пероксиду кисню, який утворюється під дією оксидаз, тобто пероксид О є акцептором Н.
RH2 + H2O2 R + 2H2O
В той час пероксид кисню є отрутою для живих клітин, його розпад каталізує фермент каталаза.
2Н2О2 2Н2О+О2
Небілк. част. каталази і пероксидази близько по будові до гему гелю і утрим. Fe.
Ферменти ІІ класу - трансферази
XR + Y x + YR
Цей клас ділиться на підкласи в залежності від хімічної природи радикалу, який переноситься за допомогою цих ферментів. це ферменти, які каталізують реакцію перенесення функціональних груп є 8 груп.
амін-, акцило-, фосфо-, метил-, глікозил-трансферази.
Перший підклас: метилтрансферази – переносять одновуглецеві залишки СН2.
Кінази – фосфотрансферази
– переносять фосфатні залишки від АТФ за якусь речовину, а також фосфатні залишкі від якогось фосфату на АДФ для утворення АТФ. Кінази беруть участь у процесах, які потребують АТФ і які супроводжують утворенням АТФ.
Наприклад: розклад глюкози починається з переносу фосфату від АТФ на глюкозу під дією кілази.
Кінази мають різні назви. В даному випадку її називають глюкокіназа, в загальному – гексокіназа.
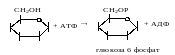
Цей шлях утворення АТФ називається субстратне фосфорелювання. Утворення АТФ будь-яким шляхом називається фосфорелювання.
Оксидоредуктази
Належать до складних ферментів і виявляють каталітичну активність лише при наявності коферментів або простетичних груп, які визначають силу ферментативної дії, білкова частина визначає специфічність ферменту.
Найважливішими представниками цього класу є дегідрогенази, що каталізують перенесення водню; цитохроми, що каталізують перенесення електронів.
Небілковою частиною дегідрогеназ є у більшості випадків динуклеотиди. Залежно від виду динуклеотиду дегідрогенази поділяються на піридинові та флавінові.
1. Піридинові дегірогенази – небілковою частиною є нікотинамідаденіндинуклеотидом (НАД) або нікотинамідаденінди-нуклеотидфосфатом (НАДФ).
Піридинові дегідрогенази переносять водень не на кисень, а на інші акцептори, тому їх називають анаеробними.
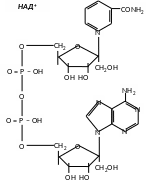
Коферменти НАД та НАДФ є динуклеотидами, в яких мононуклеотиди зв’язані між собою через залишки фосфорної кислоти. До складу одного з нуклеотидів входить амід нікотинової кислоти (вітамін РР), інший представляє собою АМФ.
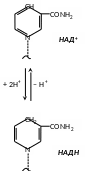
Каталізовані піридинзалежними дегідрогеназами реакції можна зобразити так:
Субстрат - Н2 + НАД+=субстрат + НАД.Н + Н+
Здатність НАД+ та НАДФ+ відігравати роль проміжного переносника водню пов’язана з наявністю в їх структурі аміду нікотинової кислоти. Зворотне гідрування - дегідрування (приєднання та віддача протона та електронів) цих коферментів представляють наступним чином (див. схему).
При перенесенні двох воднів від субстрату на НАД+ один з них включається у кофермент, а інший водень залишається в середовищі у вигляді H+. Для простоти відновлені форми НАД та НАДФ зображають символами НАДН2 та НАДФН2.
Піридинові дегідрогенази, активною групою яких є НАД беруть участь у спиртовому бродінні (алкогольдегідрогеназа), молочнокислому бродінні (лактатдегідрогеназа). Останнє лежить в основі отримання кисломолочних продуктів.
Важливе значення мають ферменти в діагностиці різних захворювань. Зміна їх активнсті в крові порівняно з нормою є важливим показником патологічних змін в організмі. Цінність такої діагностики – висока специфічність та можливість визначення відхилень на ранніх стадіях хвороби. Так, у перші часи захворювання на інфаркт, коли ще ЕКГ не помічає ніяких змін, ферменти вже свідчать про початок хвороби (підвищується активність креатинкінзи та лактатдегідрогенази).
2. Флавінові дегідрогенази - небілковою частиною є флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД). Флавінові дегідрогенази також в основному анаеробні, але деякі можуть передавати водень безпосередньо на кисень, тоді їх називають аеробними.
Флавінові дегідрогенази містять похідні вітаміну В2.
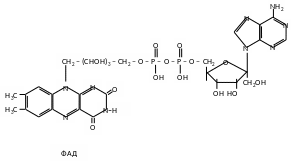
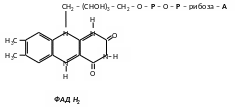
ФМН та ФАД дуже міцно, на відміну від коферментів НАД та НАДФ, приєднані до ферменту (точніше, до апоферменту) і не відщепляються від нього ні на жодній із стадій каталітичного циклу.
Активною частиною молекули ФАД та ФМН є ізоаллоксазинове кільце рибофлавіну, до атомів якого можуть приєднуватись два атоми водню, тобто два електрони та два протони при відповідній внутрішньомолекулярній перебудові подвійних зв’язків.
Оксидази – аеробні дегідрогенази, для яких акцептором водню слугує лише кисень повітря. Важливим їх представником є поліфенолоксидаза, яка містить мідь. Цей фермент окислює поліфенольні сполуки. 13(54) Так, потемніння розрізаного яблука відбувається під впливом саме цього ферменту, який прискорює окислення органічних речовин з утворенням забарвлених продуктів.
3. Перенесення електронів здійснює система цитохромів, яка складається з ряду геммістких білків (гемопротеїнів). В процесі тканинного дихання найбільш важливу роль відіграють цитохроми b, c1, c, a, аa3 (цитохромоксидаза). Всі вони містять простетичну гемінову групу, близьку до гему гемоглобіну (простетична група цитохрому b ідентична гему).

Цитохроми відрізняються не лише простетичними групами, але і білковими компонентами. В ході каталітичного процесу валентність заліза, що міститься в цитохромах оборотно змінюється (Fe2+ Fe3+)
В ланцюзі дихальних каталізаторів цитохроми розміщуються у певній послідовності:
цитохром b цитохром с цитохром а цитохром а3.
Цитохроми b, с виконують функцію проміжних переносників електронів, а цитохром аа3 (цитохромоксидаза) є термінальним дихальним ферментом, що безпосередньо взаємодіє з киснем.
Цитохромоксидаза складається з 6 субодиниць, кожна з яких містить гемінову групу та атом міді. Очевидно, дві субодиниці складають цитохром а, а інші відносяться до цитохрому а3.
4. Ліпоксигеназа (ліпоксидаза) широко розповсюджений у рослинах, каталізує окислення киснем повітря деяких ненасичених ВЖК та утворених ними ефірів.
Ліпогексиназа сої – глобулін, містить залізо.
До окисно-відновинх ферментів належать ферменти, що беруть участь у перенесенні водню: аскорбатоксидаза (окислює аскорбінову кислоту в дегідроаскорбінову кислоту);
глюкозооксидаза (містить дві молекули ФАД, каталізує окислення глюкози до глюконової кислоти; глюкозооксидаза застосовується як антиокислювач для зв’язування кисню, що міститься в продуктах і запобіганню окислення м’яса, соків);
поліфенолоксидаза (каталізує окислення фенолів до відповідних хінонів, спричинює потемніння поверхні розрізаного яблука, картоплі, потемніння плодів та овочів під час висушування);
каталаза (небілковою частиною є залізопорфірин, використовується для розкладу пероксиду водню, що утворюється в результаті дії глюкозооксидази), на м’ясокомбінатах за допомогою каталази освітлюють кров, щоб добути безбарвну білкову суміш, яку використовують для виготовлення деяких ковбас і макаронних виробів;
пероксидаза (каталізує процеси окислення органічних сполук за участю пероксиду водню).
Токсичність ціановодневої кислоти пояснюється тим, що вона є інгібітором багатьох ферментів, що містять метали. Вона зв’язує залізо, що входить до складу дихальних ферментів (наприклад, цитохромоксидази), внаслідок чого різко пригнічується дихання і організм гине.
5. Гідрогенази – ферменти, що каталізують оборотне окислення водню за участю ферредоксину, НАД+ або цитохрому с3. Усі гідрогенази бактерій містять негемінове залізо та сульфідну сірку. Гідрогенази відіграють важливу роль в процесі фотосинтезу і фіксації молекулярного азоту.
6. Пероксидаза – ферменти, що каталізують окислення органічних сполук пероксидом водню. Пероксидаза утворює з пероксидом водню комплексну сполуку, в результаті чого пероксид активується і стає здатним діяти як акцептор водню. Ці ферменти можуть окислювати різні сполуки за допомогою пероксиду водню або органічних перекисів. Пероксидаза – двокомпонентний фермент, простетична група якого містить залізо, з’єднане з залишками чотирьох піррольних кілець у вигляді гематину.
7. Каталаза – фермент під дією якого відбувається розклад пероксиду водню на воду і молекулярний кисень:
2Н2О2 2Н2О + О2
Каталаза – двокомпонентний фермент, що складається з білка і з’єднаної з ним простетичної групи, що містить гематин. В організмі каталаза руйнує отруйний для клітин пероксид водню.
ІІ клас. Трансферази.
Каталізують реакції перенесення функціональних груп. Переносять одновуглецеві залишки, кетонні і альдегідні залишки, глікозидні і ацильні залишки, групи, які утримують Р, N.
Трасферази
Найважливішими представниками цього класу є:
1. Фосфортрансферази (кінази) здійснюють перенесення фосфатного залишку від АТФ на різні речовини і, навпаки, від фосфорильованої речовини на АДФ з утворенням АТФ. Ці процеси мають велике значення в енергетичному обміні. Фосфорилювання глюкози за рахунок АТФ є першим і обов’язковим етапом всіх процесів перетворення цього вуглеводу.
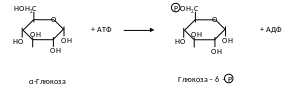
Стрептокіназу та урокіназу застосовують для розсмоктування тромбів.
2. Глікозилтрансферази каталізують перенесення залишків вуглеводів.
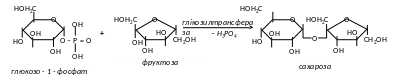
До цього підкласу належать ферменти фосфорилази, які каталізують перетворення крохмалю чи глікогену у глюкозо-1-фосфат за участі фосфорної кислоти, тобто перенесення глюкозильного залишку на фосфорну кислоту. В результаті відбувається взаємоперетворення вуглеводів. Такий процес розкладу поліцукридів називається фосфоролізом. Він аналогічний гідролізу, але роль води виконує фосфорна кислота. На відміну від гідролаз фосфорилази здійснюють і зворотний процес - синтез складних вуглеводів, переносячи залишки моноцукрів від їх фосфорних ефірів на вуглеводи.
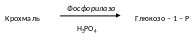
3. Ацилтрансферази беруть участь в перенесенні залишків органічних кислот, головним чином залишку оцтової кислоти - ацетилу (СН3СО-). Цей процес є важливим етапом аеробного окислення вуглеводів, а також окислення та синтезу жирних кислот. Небілкова частина ацилтрасфераз називається коферментом ацилювання (КоА), складається із похідного АДФ, залишку пантотенової кислоти та тіоетаноламіну. Активна частина коферменту - сульфгідрильна група тіоетаноламіну - SH, тому кофермент ацилювання позначають також символом SН - КоА. Кислотні залишки приєднуються до сульфгідрильної групи завдяки макроергічному зв’язку, наприклад: СН3СО S-КоА (ацетил - КоА) 1(161).
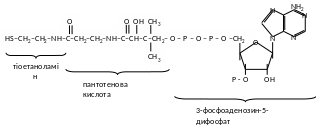
4. Метилтрансферази – каталізують перенесення метальних груп. Це має велике значення в процесі синтезу холіну, що є складовою частиною лецитинів. Холін регулює жировий обмін у тваринному організмі.
5. Амінотрасферзи – каталізують реакції пере амінування (перенесення аміногрупи з амінокислоти на кетокислоту). Амінотрансферази містять як кофермент вітамін В6.
Амінотрансферази
Ці ферменти каталізують реакції переамінування перенесення аміногруп на кетокислоти.
Двох компонентні ферменти каталізують реакції переамінування амінокислот.

піровіноградова кислота (ПВК) + аспарагінова кислота аланін + щавлевооцетова кислота
3. Метилтрансферази.
Ці ферменти каталізують реакції перенесення метильних груп. Ці ферменти мають велике значення в процесі синтезу холіна В4, який є складовою частиною фосфотідіхогіна.
4. Ацилтрансферази.
Ці ферменти каталізують перен. залишків карбонових кислот (ацилів). Головним чином залишку оцтової кислоти СН3СО.
Небілковою частиною цих ферментів являється кофермент А (КоА). КоА складається із залишків трьох речовин: аденілова кислота тіоетаноламіну, В3 – пантотенової кислоти.
CH3 – СО ~ КоА
CH3 – СО ~ S - КоА
Ацетил - КоА – є найважливішим метабулітом в організмі.
У процесі розкладу цих речовин в організмі утворюються як проміжні продукти ацетил - КоА, приймає роль у синтезі речовин.
КоА утримує вітамін В3 (пантотенова кислота), двух залишків фосфорної кислоти, аденіловий мононуклеотид та тіоетаноламіна.
Тіоетаноламін утрим. гр. SН, залишки карбонових кислот приєдн. замість Н до групи SН утвор. макроергічний зв’язок.
Коа SH СН3СО SКоА ацетіл КоА
