
1.1 Введение.
Реакция сульфоокисления углеводородов была открыта в 1940 году при пропускании сернистого ангидрида и кислорода через насыщенные алифатические и циклические углеводороды под действием на реакционный объем ультрафиолетового излучения. В общем случае виде реакция может быть представлена следующей схемой:
RH![]() RSO3H
RSO3H
Сульфокислоты, образующиеся при этой реакции, легко переводятся в алкилсульфонаты нейтрализацией щелочью в отличие от получения их через сульфохлориды углеводородов, которые омыливаются при повышенной температуре (90o) с выделением большого количества тепла. При производстве алкилсульфонатов по реакции сульфоокисления вместо хлора используется кислород. Это позволяет получать их непосредственно на нефтеперерабатывающих предприятиях, не прибегая к транспортировке сырья на заводы производящие хлор.
Реакция сульфоокисления углеводородов представляет большой интерес для производства ПАВ. Алкилсульфонаты идут на приготовление различных эмульгаторов, смачивателей, пенообразующих средств и т.д.
Сырьем для получения алкилсульфонатов по реакции сульфоокисления являются парафиновые углеводороды С5-С10 , выделяемые из нефтяных фракций методом экстрактивной кристаллизации мочевиной или с помощью молекулярных сит.
Реакция сульфоокисления протекает под действием не только ультрафиолетового излучения, но и вещественных катализаторов и озона. Кроме того, она эффективно инициируется -излучением.
Радиационное инициирование процесса сульфоокисления углеводородов имеет некоторые преимущества перед фотохимическим и химическим. Высокая проникающая способность -излучения позволяет проводить процесс в реакторах большого объема при более равномерном облучении реакционной смеси, чем при фотохимическом, Использование ионизирующего излучения позволяет проводить реакцию при более низкой температуре, оптимальной для процесса сульфоокисления.
Фотохимический процесс в промышленности необходимо проводить в присутствие воды во избежание осмоления сульфокислот в зоне реакции. Наличие воды в реакционной смеси снижает скорость сульфоокисления и способствует образованию побочных продуктов радиолиза воды.
Сульфоокисление углеводородов в присутствие вещественных инициаторов требует высокого расхода последних, что ведет к загрязнению конечного продукта.
При радиационном сульфоокислении нет необходимости применять воду, легко осуществлять отвод тепла реакции и не требуется прозрачности реакционной смеси. Кроме того, создаются условия для организации непрерывного и автоматизированного производства с высокой производительностью.
1.2 Описание процесса
Реакция радиационного сульфоокисления углеводородов относится к классу цепных радикальных процессов с вырожденным разветвлением цепи. Средняя длина цепей, определяется как отношение радиационно-химического выхода сульфокислот к радиационно-химическому выходу свободных радикалов, составляет 800 – для С6Н14 – С9Н20, 180 – для С16Н34 и 1000 – для циклогексана.
Механизм реакции радиационного сульфоокисления углеводородов был принят на основе уже имеющихся представлений о процессе инициированном УФ-излучением. В настоящее время механизм описывается следующей схемой:
1.Зарождение цепи
RH
![]() R
+ H Ki
(1)
R
+ H Ki
(1)
H. + RH R. + H2 Ki (2)
2.Продолжение цепи
R. + SO2 RSO2 K1 (3)
RSO2. + O2 RSO2O2 K2 (4)
RSO2O2. + RH RSO2O2H + R K3 (5)
3.Вырождение цепи
RSO2O2Н RSO2O. + OH. K4 (6)
RSO2O. + RH RSO2OH + R. K5 (7)
OH. + RH H2O + R. K6 (8)
4.Обрыв цепей
R. + O2 RO2. K7 (9)
5. Побочная реакция
RSO2O2Н + SO2 + H2O RSO2OH + H2SO4 K8 (10)
Реакция радиационного сульфоокисления углеводородов начинается с распада молекулы углеводорода на радикал и атом водорода. Доля разрыва связи С-С незначительна вследствие “эффекта клетки”. Такой характер иницирования обусловлен тем, что электронная доля других компонентов в реакционной смеси (SO2 и O2) крайне мала. Например, в условиях, оптимальных для процесса сульфоокисления нормальных углеводородов их электронные доли не превышают 2%.
В результате взаимодействия -излучениемс углеводородом возникает радикал R., реагирующий с молекулой сернистого ангидрида с образованием сульфонового радикала (реакция 3) . После присоединения к этому радикалу молекулы кислорода (реакция 4) образуется персульфоновый радикал, при взаимодействии которого с молекулой углеводорода образуется персульфокислота и новый радикал, способный к продолжению цепи.
Являясь неустойчивым соединение, персульфокислота разлагается с образованием двух радикалов (реакция 6) . Процесс распада персульфокислоты представляет собой реакцию вырожденного разветвления цепи, что приводит к увеличению скорости появления свободных радикалов.
При взаимодействии возникших радикалов с молекулами углеводородов образуется сульфокислота и вода. Протекающие реакции (6 - 8) обуславливают самопроизвольное сульфоокисление углеводородов после прекращения облучения (постэффект).
Обрыв цепей происходит в результате взаимодействия алкильного радикала с молекулярным кислородом. Продуктом этой реакции перекисный радикал RO2. - при температуре 60oС малоактивен и в реакции продолжения цепи не участвует. Для большинства углеводородов значения констант скоростей реакций отрыва атома водорода радикалом RO. низки и составляют примерно 0.1 - 0.01 л/(моль.с). Наиболее вероятна рекомбинация радикалов RO2. c образованием молекул спирта, альдегида и кислорода. Константа скорости этой реакции порядка 105 - 106 л/(моль.с).
Линейный обрыв радикалов R. цепной реакции сульфоокисления углеводородов подтверждает отсутствие зависимости радиационно-химического выхода от мощности дозы.
Образующаяся, по реакции (8), вода способствует появлению побочного продукта - серной кислоты - и еще одной молекулы сульфокислоты (реакция 10).
Механизм радиационного и фотохимического сульфоокисления углеводородов различаются стадией зарождения цепи. При фотохимическом сульфоокислении световая энергия поглощается молекулами сернистого ангидрида, в то время как парафиновые углеводороды не поглощают УФ-излучения. Затем энергия передается от возбужденной молекулы SO2* к углероду с последующим гомолитическим разрывом связи С-Н и образованием алкильного радикала.
SO2
![]() SO2*
SO2*
 R
+ H + SO2
R
+ H + SO2
RH + SO2*
(RH* + SO2) R + H + SO2
Как при фотохимическом, так и при радиационном сульфоокислении начиная с определенных концентраций персульфокислоты протекает вторичные реакции, в результате которых образуется кислый эфир дисульфоната и серной кислоты.
Суммарное уравнение вторичных реакций, приводящих к образованию КЭДС, имеет следующий вид :
4С6Н11SO2O2H + 2SO2 + C6H12 3C6H11SO2OH +
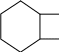
OSO3H
+ H2SO4
OSO3H
КЭДС был обнаружен и выделен при радиационном сульфоокислении циклогексана.
Целевым продуктом реакции сульфокисления углеводородов является моносульфокислота. Помимо нее образуется следующие побочные продукты : серная кислота, полисульфокислоты, кислый эфир диолмоносульфоната и серной кислоты. При достаточном накоплении всех продуктов реакции и углеводорода, они выделяются в кислотную фазу, которая располагается в нижней части реактора. По мере образования продуктов реакции они переходят в нижнюю часть. В углеводородной фазе концентрация этих компонентов значительно ниже.
Персульфокислота, как промежуточный продукт присутствует в обеих фазах, но в очень маленьких концентрациях.
Радиационное сульфоокисление углеводородов является типичным хемосорбционным процессом, по этому при относительно низких удельных расходах реакционных газов скорость образования сульфокислот и других продуктов реакции с увеличением удельного расхода монотонно возрастает.
