
- •17Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
- •18Молекулярно-кинетическая теория (сокращённо мкт) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
- •22Закон сохранения электрического заряда гласит, что алгебраическая сумма зарядов электрически замкнутой системы сохраняется.
- •241.4. Теорема Гаусса для напряженности электростатического поля
- •27Потенциал электростатического поля — скалярная величина, равная отношению потенциальной энергии заряда в поле к этому заряду:
- •29Силой тока называется физическая величина, равная отношению количества заряда, прошедшего за некоторое время через поперечное сечение проводника, к величине этого промежутка времени.
- •31Зависимость плотности тока от скорости дрейфа свободных зарядов.
14Равновесным процессом будем называть процесс, состоящий из ряда следующих друг за другом равновесных состояний. Параметры двух таких соседних состояний отличаются на бесконечно малую величину. Равновесный процесс может быть только бесконечно медленным процесс, чтобы в любой момент времени существовало равновесное состояние во всех частях системы. Всякий процесс, протекающий с конечной скоростью, вызовет появление конечных градиентов плотности, температуры, давления и т. д. Параметры системы будут изменяться и процесс станет неравновесным.
Изобарный процесс. При изобарном процессе

давление газа постоянно, т. е. р=const. Работа расширения газа
![]() Изохорный
процесс. При изохорном процессе
Изохорный
процесс. При изохорном процессе
постоянным остается
объем газа, т. е. V
= const,
следовательно, dV
= О и никакой работы при таком процессе
совершить нельзя: A=0.
![]()
![]()
15Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию
тела нельзя измерить напрямую. Можно
определить только изменение внутренней
энергии:
![]()
16Степень свободы молекул — количество координат для определения расположения молекулы в пространстве.
В классической статистической механике теорема о равнораспределении кинетической энергии по степеням свободы позволяет связать температуру системы с её средней энергией. Эта теорема также известна под названиями закон равнораспределения и теорема о равнораспределении. В первоначальном виде теорема равнораспределения утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняя кинетическая энергия поступательного движения молекулы должна равняться средней кинетической энергии её вращательного движения.
С помощью теоремы о равнораспределении можно делать количественные предсказания
17Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единицы измерения: Джоули Дж
Уде́льная теплоёмкость (Удельная теплота нагревания на один градус, обозначается как c) вещества определяется как количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус.
Единицей СИ для удельной теплоёмкости является Джоуль на килограмм-Кельвин. Следовательно, удельную теплоёмкость можно рассматривать как теплоёмкость единицы массы вещества. На значение удельной теплоёмкости влияет температура вещества. К примеру, измерение удельной теплоёмкости воды даст разные результаты при 20 °C и 60 °C.
![]() Формула
расчёта удельной теплоёмкости:
Формула
расчёта удельной теплоёмкости:
олярная теплоёмкость — это теплоёмкость одного моля вещества. Часто употребляется обозначение C. Однако буквой C часто обозначается и простая теплоёмкость.
Связь с удельной теплоёмкостью:
С=M•с,
где с — удельная теплоёмкость, М — молярная масса.
Размерность молярной теплоёмкости [Дж/(К•моль)
Еще древнему человеку было известно, что путем трения можно получить огонь. Но только в XIX в. познание этого явления получило количественное выражение и приобрело значение научного принципа – принципа эквивалентности теплоты и работы.
Р. Клаузиус назвал эквивалентность теплоты и работы первым началом термодинамики: "Во всех случаях, когда из теплоты появляется работа, тратится пропорциональное полученной работе количество теплоты, и наоборот, при затрате той или иной работы получается то же количество тепла".
Справедливость принципа эквивалентности теплоты и работы была доказана блестящими экспериментальными работами Р. Майера и Д. Джоуля . Майер был первым, кто попытался ответить на вопрос, какую работу требуется совершить для получения определенного количества теплоты. Выполнив эксперименты по расширению газа в разных условиях, он очень красиво решил эту важнейшую для физики задачу и на основании проведенных опытов получил значение механического эквивалента теплоты.
17
Среди равновесных процессов, которые происходят с термодинамическими системами, отдельно рассматриваются изопроцессы, при которых один из основных параметров состояния остается постоянным.
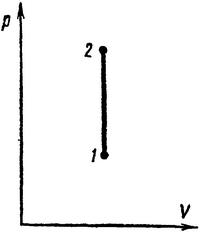
Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 1), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
![]()
Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:
![]()
Тогда для произвольной массы газа получим
![]()
Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
![]()
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.
