
- •6.Потенциальная энергия, законы сохран мех энерг.
- •15.Термодинамичемкое равновесие.
- •19.Барометрическая Формула.
- •20. Распределения Максвелла.
- •Количество теплоты, полученное системой, в общем случае идёт на изменение внутренней энергии системы и на совершение системой работы.
- •26.Термодинамическая вероятность.
- •29.Стационарное движение жидкости, ур-ние Бернули.
- •30. Вязкость жидкости.
20. Распределения Максвелла.
МА́КСВЕЛЛА РАСПРЕДЕЛЕ́НИЕ, распределение по скоростям частиц (молекул) макроскопической физической системы, находящейся в состоянии термодинамического равновесия, (в отсутствии внешнего поля, при условии, что движение частиц подчиняется законам классической механики.
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndvопределяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv и имеет смысл плотности вероятности.
Для газа, подчиняющегося классической механике, в состоянии статистического равновесия функция распределения f Максвелла по скоростям имеет вид:
f(v) =n(m/2pkT)3/2exp(-mv2/2kT),
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Значение функции распределения f(v) зависит от рода газа (от массы молекул) и от температуры.
С помощью распределения Максвелла можно вычислять средние значения скоростей молекул и любых функций этих скоростей. В частности, средняя квадратичная скорость v2 = 3kT/m, а средняя скорость молекулы
v = (8kT/pm)1/2.
21.
22.Первый закон термодинамики. Изопроцессы в газах.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
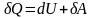
Количество теплоты, полученное системой, в общем случае идёт на изменение внутренней энергии системы и на совершение системой работы.
Для
конечного процесса первое начало
термодинамики можно записать так:
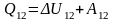
Частные случаи:
1.Если δQ > 0, то это означает, что тепло к системе подводится. 2.Если δQ < 0, аналогично — тепло отводится. 3.Если δQ = 0, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
-при
изобарном процессе
![]()
- при изохорном процессе (A = 0)
![]()
-при изотермическом процессе (ΔU = 0)
![]()
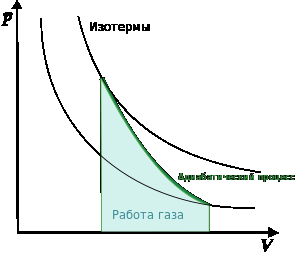
23.Адиабатный процесс. Ур-ние Пуассона.
Адиабатный
процесс — термодинамический процесс
в макроскопической системе, при котором
система не получает и не отдаёт тепловой
энергии. Если термодинамический процесс
в общем случае являет собой три процесса
— теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии, то адиабатический
процесс в силу отсутствия теплообмена
(ΔQ = 0) системы со средой сводится только
к последним двум процессам. Поэтому,
первое начало термодинамики в этом
случае приобретает вид![]() U-измен.вн.эн.
А-работа.сов.сист. Ур-ние
Пуассона.Для
идеальных газов, чью теплоёмкость можно
считать постоянной ур-ние адиабаты:
U-измен.вн.эн.
А-работа.сов.сист. Ур-ние
Пуассона.Для
идеальных газов, чью теплоёмкость можно
считать постоянной ур-ние адиабаты:
![]() к=Ср/Cv –показатель адиабаты С-теплоем
к=Ср/Cv –показатель адиабаты С-теплоем
С
учётом уравнения состояния идеального
газа![]() или
или
![]() Т-абсол. Темп.
Т-абсол. Темп.
Поскольку К всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении V) газ нагревается (T возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент К
23.Идеальная тепловая машина.
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной машины описывается циклом Карно.
1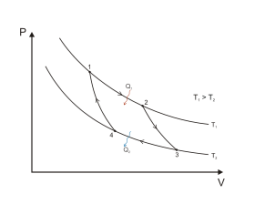 -2-изотермическое
расширение
-2-изотермическое
расширение
Q1-кол-во теплоты перед. тел.
2-3-адиабатическое расширение
3-4-изотремическое сжатие
Q2-кол-во теплоты отданное рабочему телу, теплоприемнику
4-1-адиабатическое сжатие
24. 2 закон термодинамики.
Форм.Клазиуса-Теплота не может самостоятельно переходить от менее нагретого к более нагретому.
Форм.Планка-Не возможно совершить процесс при котором вся подводимая теплота превращается в работу.
КПД тепловой машины определяется только температурой нагревателя и температурой холодильника
Форм.Кельвина- Невозможно построить тепловую машину которя превращала бы в работу теплоту наиболее холодную из имеющихся ТВ системе тел, т.е невозможно построить вечный двигатель.
25.Энтропия, теорема Эрнеста
Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() dS-приращение
энтропии
dS-приращение
энтропии
Q-минимальная теплота подведенная к системе
Т-абсолютная температура процесса
Теорема Нернста (тепловая теорема Нернста) - утверждение, являющееся одной из формулировок третьего начала термодинамики, сформулированное Вальтером Нернстом в 1906 году как обобщение экспериментальных данных по термодинамике гальванических элементов.
Теорема
Нернста утверждает, что всякий
термодинамический процесс, протекающий
при фиксированной температуре T в сколь
угодно близкой к нулю,
![]() не должен сопровождаться изменением
энтропии S, то есть изотерма T = 0 совпадает
с предельной адиабатой S0.
не должен сопровождаться изменением
энтропии S, то есть изотерма T = 0 совпадает
с предельной адиабатой S0.
