
КІНЕТИКА ХІМІЧНИХ РЕАКЦІЙ
Хімічна термодинаміка не дає відповіді на питання про швидкість досягнення рівноважного стану в процесі хімічної реакції. Цим питанням займається хімічна кінетика. Швидкістю хімічної реакції vp називається зміна кількості реагуючої речовини за одиницю часу в одиниці реакційного простору. Миттєва (істинна) швидкість визначається як границя відношення зміни концентрації ΔC за проміжок часу Δt до величини цього проміжку за умови, що t0
![]()
тобто, це перша похідна за часом від концентрації. Концентрація в хімічній реакції є функцією часу. Знак – означає, щo з часом концентрація зменшується. Значення швидкостей, обчислені за концентраціями тих різних речовин, які беруть участь у реакції, різні, але пропорційні, тобто, відрізняються на якусь сталу величину.
Середню швидкість зміни концентрації і-го компонента vpi за час t знаходять за формулою:
![]()
![]()
noi - число молів в початковий момент часу. ni – число молів через проміжок часу t. v - об’єм реагуючої системи.
У 1867р. К. Гульдберг і П. Вааге сформулювали закон діючих мас: при постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, взятих у ступенях, які дорівнюють стехіометричним коефіцієнтам у рівнянні реакції.
Для реакції
аА+bB cC+dD
математичний вираз закону має такий вигляд:
![]() ,
,
де k – коефіцієнт пропорційності, що називається константою швидкості хімічної реакції. k залежить від природи реагуючих речовин і температури реакції. Якщо концентрації реагуючих речовин дорівнюють одиницям, то vp=k.
Розглянемо реакції у гомогенних системах при T = const. Швидкість реакції пропорційна концентраціям реагуючих речовин. Для тримолекулярної реакції можна записати:
![]() .
.
Якщо реакція протікає у газовій фазі, то концентрації реагентів і продуктів можна виразити через парціальні тиски:
![]() .
.
Порядок реакцій.
У хімічній кінетиці взаємодію частинок класифікують за ознаками молекулярності реакції або її порядку. Молекулярність визначається числом одночасно взаємодіючих частинок. У реакції може приймати участь не менше двох речовин: АВ. Співвідношення між швидкостями зміни концентрацій реагенту СА і продукту СВ таке:
![]() .
.
Різні знаки швидкостей показують, що концентрація продукту зростає, а реагенту зменшується. Тут реакція є мономолекулярною.
1 Для здійснення мономолекулярної реакції (першого порядку) необхідно, щоб молекули (атоми) одного сорту перебували в такому стані, при якому можлива хімічна реакція. Сторонні молекули не впливають на швидкість процесу. За приклад візьмемо реакцію:
N2O4→ 2NO2
очевидно, що тут швидкість прямої реакції пропорційна концентрації молекул N2 O4 :
![]() ,
,
Це реакція першого порядку. Зауважимо, що зворотна реакція буде бімолекулярною.
2. для здійснення бімолекулярної реакції (другого порядку) необхідне зіткнення двох молекул:
H + H = H2, або H2 + I2 = 2HI.
тут швидкості будуть пропорційними добутку концентрацій:
vр = - kCHCH = kC2.
3. у тримолекулярних реакціях (третього порядку) потрібне одночасне зіткнення трьох молекул:
2NO + O2 = 2NO2;
![]() .
.
Якщо концентрації реагентів стехіометричні, то:
vр = - kC3.
Такий процес малоймовірний і подібні реакції зустрічаються рідко.
4. Бувають реакції нульового порядку. Їх швидкість реакції не залежить від концентрації:
![]() ,
або
,
або
![]() .
.
Реакції першого порядку (A продукти)
Швидкість мономолекулярної реакції пропорційна концентрації реагенту СА = С:
![]() .
.
Розділимо змінні та проінтегруємо цей вираз:
![]() ,
,
![]() ,
,
![]() .
.
Стала
інтегрування знаходиться за початковими
умовами: в момент початку
реакції
![]() початкова концентрація дорівнювала
початкова концентрація дорівнювала
![]() .
Отже,
.
Отже,
![]() ,
звідки
,
звідки
![]() ,
,
![]() ,
,
![]() .
Позбавившись від логарифмів, запишемо:
.
Позбавившись від логарифмів, запишемо:
![]() .
.
Рівняння
встановлює зв’язок між концентрацією
реагенту
![]() в даний момент часу
в даний момент часу
![]() і часом протікання хімічної реакції.
Кількість речовини, що прореагувала за
деякий час, починаючи з моменту початку
реакції, визначається різницею відповідних
концентрацій
і часом протікання хімічної реакції.
Кількість речовини, що прореагувала за
деякий час, починаючи з моменту початку
реакції, визначається різницею відповідних
концентрацій
![]() і дорівнює:
і дорівнює:
![]() .
.
Визначимо
час, протягом якого прореагує половина
початкової кількості речовини (період
напіврозпаду
![]() ):
):
![]() ,
звідки знаходимо:
,
звідки знаходимо:
![]() .
.
В реакції першого порядку період напіврозпаду не залежить від початкової концентрації і визначається лише швидкістю реакції.
Зауваження: деякі бімолекулярні реакції протікають як реакції першого порядку. Це буває тоді, коли є великий надлишок одного із компонентів і його концентрація в міру перебігу реакції практично не змінюється.
Реакції другого порядку
![]()
Для
спрощення математичного розгляду задачі
покладемо, що
![]() та розділимо змінні:
та розділимо змінні:
![]() .
.
Результатом інтегрування буде вираз:
![]() .
.
Початкові умови: в момент початку реакції початкова концентрація дорівнювала . Знаходимо сталу інтегрування:
![]() ,
,
![]() .
.
Звідси одержимо залежність концентрації реагенту від часу протікання реакції:
![]() .
.
За
час
відбудеться зміна концентрації
![]() .
.
![]() Знайдемо
період напіврозпаду:
Знайдемо
період напіврозпаду:
![]() ,
,
![]() .
.
В реакції другого порядку період напіврозпаду обернено пропорційний початковій концентрації реагентів та константі швидкості реакції.
Реакції третього порядку
Нехай
![]() .
Диференційне рівняння такої реакції
має вид:
.
Диференційне рівняння такої реакції
має вид:
![]() .
.
Розділимо змінні та виконаємо інтегрування цього виразу:
![]() .
.
Стала інтегрування має таке значення:
![]() ,
,
![]() .
.
Звідси знаходимо залежність концентрації реагенту від часу протікання реакції:
![]() .
.
Зміна
концентрації за час
дорівнює
![]() .
.
Знайдемо період напіврозпаду:
![]() ;
;
![]() ;
;
![]() .
.
Період напіврозпаду обернено пропорційний квадрату початкової концентрації константі швидкості реакції. Якщо початкові концентрації реагентів неоднакові, то залежність буде більш складною.
Послідовні реакції.
Відомі рівняння реакцій, в яких сума стехіометричних коефіцієнтів буває більше десяти. Тут реакції відбуваються через проміжні стадії, які не відображаються в рівнянні реакцій.
Звичайно, кожна стадія є бімолекулярною, і сумарна реакція є теж реакцією другого порядку. При вивченні таких реакцій необхідні складні математичні обчислення, особливо тоді, коли реакція в цілому, або окремі її стадії є оборотними.
Хімічна рівновага.
Хімічні реакції можуть бути оборотними. Разом з хімічною взаємодією реагентів (пряма реакція) відбуваються хімічні взаємодії між продуктами реакції (зворотна реакція). Спочатку швидкість протікання прямої реакції зменшується, а зворотної збільшується. Коли обидві швидкості зрівнюються, то настає динамічна рівновага (хімічна рівновага). Це означає, що далі співвідношення між учасниками реакції при рівновазі не зміниться. Ясно, що із зміною зовнішніх умов (тиск, температура) динамічна рівновага буде зміщуватися, тобто, при зміні умов змінюється співвідношення між учасниками реакцій. Нехай в реакції реагують а молів речовини А і b молів речовини В. При цьому утворюється g молів речовини G і h молів речовини H:
aA + bB gG + hH
Нехай константи швидкостей прямої і оберненої реакцій відповідно дорівнюють k1 і k2, а їх швидкості будуть:
![]()
За
умови рівноваги
![]() отже, можна записати:
отже, можна записати:
![]() .
.
Звідси знаходимо відношення:
 .
.
Якщо реакція протікає у газовій фазі, то константу рівноваги можна виразити через парціальні тиски компонентів:

При написанні констант рівноваги домовилися речовини, що є продуктами реакцій, записувати в чисельнику. Константи рівноваги можуть бути виражені через тиски або концентрації, мольні частки чи активність в залежності від умов, в яких проходять реакції. Наприклад, для суміші газів парціальні тиски пропорційні їхнім концентраціям:
![]() .
.
Тут![]() молярна концентрація газу (число його
молів у літрі). Підставивши у рівняння
для
молярна концентрація газу (число його
молів у літрі). Підставивши у рівняння
для
![]() ,
одержимо:
,
одержимо:

n=g +h–(a+b) означає зміну числа молів при переході від реагентів до продуктів. Наприклад, в реакції
H2(г) + I2(г ) 2HI(г )
a = 1, b = 1, g = 2, h = 0;
n=21–1=0. В процесі хімічної реакції число молів учасників не змінюється.
N2 + 3H2 2NH3.
n=2–1–3=–2. Число молів зменшується на 2.
Для рідин константа рівноваги може бути виражена через активності:
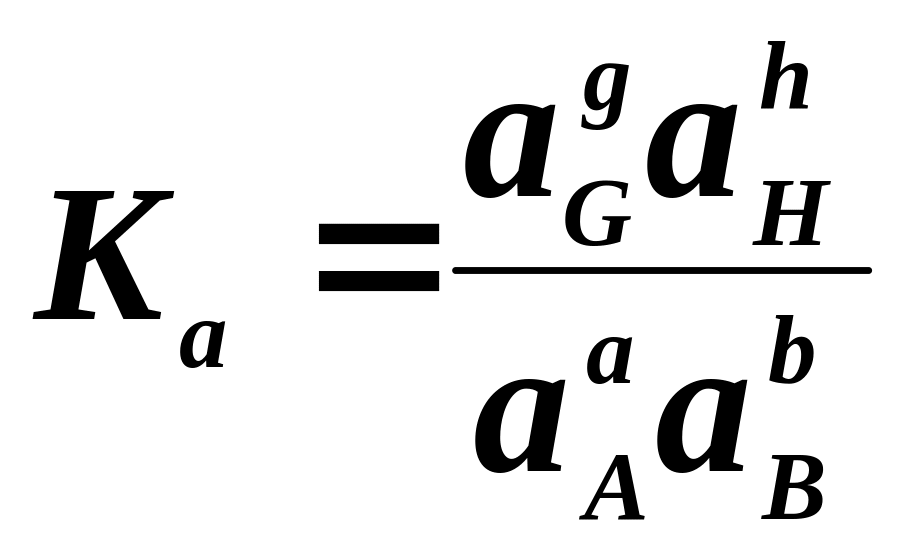 .
.
