
Циклоалканы.
(Циклопарафины, полиметиленовые УВ, нафтены)
Общая характеристика.
Циклопарафины (полиметиленовые УВ, нафтены)

 Циклические
УВ
Циклические
УВ



 Моноциклические Бициклические
Моноциклические Бициклические
н асыщенные
ненасыщенные спираны мостиковые
асыщенные
ненасыщенные спираны мостиковые




 СН
СН
Н2С СН2
спиро-[2,4]-гептан СН2

Н2С СН2
СН
бицикло-[2,2,1]-гептан
Циклоалканы – это предельные УВ, у которых углеродная цепь замкнута в цикл.
СnН2n, n≥3

С3Н6 циклопропан С5Н10 циклопентан С3-С4 малый цикл
С5-С10 средние (обыч)

 >С10
высшие
>С10
высшие
С4Н8 циклобутан С6Н12 циклогексан

С троение
троение





H H С (4σ→4е-) sр3 – гибридизация + 3 → 4

 C
↑ ↑
C
↑ ↑

С…↑↓ валентный угол должен быть 109˚,28′,
H H ↑ ↑ ↑
C C С*… ↑ ПСМ – тетраэдрическое, но…
H H
При образовании циклических соединений происходит отклонение валентных связей от нормальной тетраэдрической ориентации, это вызывает напряжение в цикле и делает его менее устойчивым. Угол отклонения (β) определяется как разность между тетраэдрическим углом и углом геометрической фигуры, которую образуют атомы углерода в соответствующей цепи:


 β =
β =

 β (С3)
=
β (С3)
= 
 β
β
 β (С4)
= 9˚44′ β (С5)
= 0˚44′ β (С6)
= -5˚16′
β (С4)
= 9˚44′ β (С5)
= 0˚44′ β (С6)
= -5˚16′
Чем больше угол отклонения от тетраэдрического, тем больше напряжение в цикле, тем менее устойчивый цикл.
 «банановая
связь» или τ (тау) связь – область
перекрыва-
«банановая
связь» или τ (тау) связь – область
перекрыва-

 ния
лежит вне линии, соединяющей центры
взаимо-
ния
лежит вне линии, соединяющей центры
взаимо-

 действующих
атомов.
действующих
атомов.


Изучение строения циклогексана привело к созданию конформационных представлений – эта область стереохимии, которая рассматривает пространственные структуры (конформации), возникающие в результате вращения атомов или групп атомов вокруг простых одинарных связей. Геометрические формы, которые превращаются друг в друга при повороте простых связей, называются конформерами (конформациями или поворотными изомерами). У циклогексана две конформации –
«ванна» «кресло» Д.п. «твист»


 СН2 СН2
СН2 СН2
Н 2С
СН2
СН2
СН2 СН2
2С
СН2
СН2
СН2 СН2
СН2 СН2 СН2
СН2 СН2 СН2 СН2
Н2С СН2
СН2 СН2
Номенклатура
По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки "цикло" (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы. Напpимеp, бутан имеет фоpмулу С4Н10, а циклобутан – С4Н8.
Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле.

Изомерия
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомеpия
Изомерия углеродного скелета:
а) по величине цикла

б) по числу и положению заместителей

в) изомерия в боковой цепи

г) метамерия (разные по величине R)


. . . . . . . .
диэтилциклобутан метилпропилциклобутан
Межклассовая изомерия

циклоалканы

CnH2n
алкены

Пространственная изомерия
Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные:

Оптическая (зеркальная) изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение.

Физические свойства:
С3 – С4 – газы
С5 – С10 – жидкости
Tкип. немного выше, чем у соответствующих алканов.
Нерастворимы в воде, растворяются в ССl4, эфире, лигроине.
Химические свойства:
I Окисление:
 1)
горение 2С3Н6
+ 9О2
t˚
6СО2
+ 6Н2О
+ Q
1)
горение 2С3Н6
+ 9О2
t˚
6СО2
+ 6Н2О
+ Q
2) не взаимодействуют с КМnО4, Вr2 (н.у.). Могут окисляться в жёстких условиях, например:



 2
+ O2
145˚, 0,7 МПа
+
2
+ O2
145˚, 0,7 МПа
+
циклогексанол циклогексанон
II Реакции замещения:
1) галогенирование (для средних циклов – замещение ат. Н на атом Наl)


 + Сl2
hν
+ HCl
хлорциклогексан
+ Сl2
hν
+ HCl
хлорциклогексан
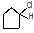 (хлористый
циклогексил)
(хлористый
циклогексил)

 + Сl2
hν-HCl
хлорциклопентан
+ Сl2
hν-HCl
хлорциклопентан


 +
HCl
+
HCl
 + Сl2
t˚
+ Сl2
t˚
Cl – CH2 – CH2 – CH2 – CH2 – Cl 1,4-дихлорбутан

+ Br2 hν Br – CH2 – CH2 – CH2 – Br 1,3-дибромпропан
2) взаимодействие с галогеноводородными кислотами. HBr, HCl, HJ ( )
+ HBr H2O CH3 – CH2 – CH2 – Br 1-бромпропан
C H3-CH
H3-CH
+ HBr H2O CH3 – CH – CH2 – CH3 2-бромбутан

H2C CH2
Br
3) нитрование (HNO3, N2O4)
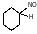
 2
2
+ N2O4 → + HNO2
