
- •Введение
- •Методические рекомендации по выполнению физического практикума
- •Литература
- •Вводное занятие
- •Погрешности электрических измерений
- •Правила техники безопасности при работе с электрическими установками
- •Применение правил Кирхгофа к расчету электрических цепей, измерение сопротивлений резисторов мостиком Уитстона
- •Теоретическое введение
- •Описание установки
- •Описание установки и метода измерения
- •Выполнение работы
- •Контрольные вопросы
- •Задание по уирс
- •Исследование условий эксплуатации химических источников тока
- •Теоретическое введение
- •Описание установки и метода измерения
- •Выполнение работы
- •Описание установки и метода измерения
- •Выполнение работы
- •Изменение температуры вещества при помощи термопары
- •Теоретическое введение
- •Описание установки и метода измерений.
- •Подготовка прибора к работе
- •Выполнение работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы и задания по уирс.
- •Определение удельного сопротивления электролитов и изучение зависимости сопротивления электролитов от температуры
- •Теоретическое введение
- •Описание установки и метода измерений
- •Выполнение работы
- •Контрольные вопросы
- •Измерение коэффициента самоиндукции, ёмкости и проверка закона Ома для цепи переменного тока
- •Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Определение электродвижущей силы элемента методом компенсации
- •Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
Выполнение работы
Ознакомившись с инструкцией и приборами, собирают схему по рис. 1.

Рис. 1
Сосуд заполняют электролитом и помещают в него медные электроды.
Предварительно высушенную катодную пластинку, взвешивают на весах, находят М1.
Устанавливают катодную пластинку, замыкают цепь и при помощи реостата устанавливают ток равный 1,5 А. При этом одновременно включают секундомер. Время пропускания тока 15-30 мин.
Разомкнув цепь, вынимают катодную пластинку, просушивают её и снова взвешивают. Находят М2. Разность (М2 – М1) = m дает массу вещества, выделившегося на катоде при электролизе.
По формуле m = Ikt вычисляют электрохимический эквивалент вещества. По формуле
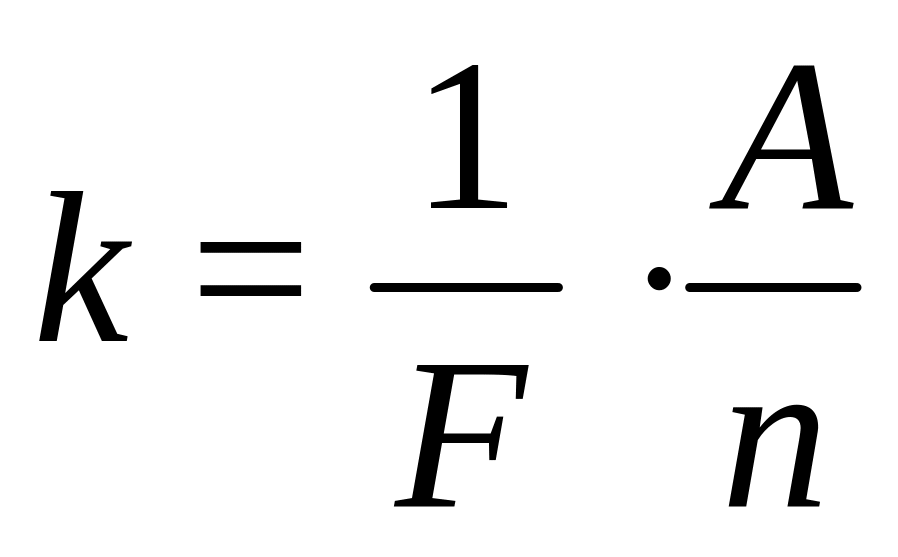 вычисляют число Фарадея; по формуле
(2) определяют заряд электрона.
вычисляют число Фарадея; по формуле
(2) определяют заряд электрона.Заполняют таблицу:
№ п.п |
Измерено |
Вычислено |
|||||||||
М1, кг |
М2, кг |
m, кг |
I, A |
t, c |
k, мг/Кл |
kср, мг/Кл |
k, мг/Кл |
Е, % |
F, Кл/(кгмоль) |
е, Кл |
|
1. 2. 3. 4. 5. |
|
|
|
|
|
|
|
|
|
|
|
Примечание: в соединении CuSO4 медь двухвалентная n = 2. Масса грамм–атома меди A = 63,54 г = 63,5410–3 кг/моль.
Контрольные вопросы и задания по уирс.
Объясните механизм электропроводности в электролитах.
Что называется электрохимическим эквивалентом вещества?
Что называется химическим эквивалентом вещества? Каков его физический смысл.
Сформулируйте законы Фарадея для электролиза.
Что понимается под числом Фарадея?
можно ли определить электрохимический эквивалент вещества, если электролиз проводить при переменном токе?
Как используется явление электролиза в технике?
На каком из электродов выделится большее количество вещества (рис. 2).

Рис. 2 Рис.3
На каком из электродов выделится большее количество вещества (рис. 3).
Работа №8
Определение удельного сопротивления электролитов и изучение зависимости сопротивления электролитов от температуры
Приборы
и принадлежности: растворы электролитов
различной концентрации,
![]() - образная трубка, мост для измерения
сопротивлений электролитов, источник
тока, соединительные провода.
- образная трубка, мост для измерения
сопротивлений электролитов, источник
тока, соединительные провода.
Теоретическое введение
Носителями тока в электролитах являются ионы растворённых веществ (молекула вещества под действием электрических сил растворителя распадается на две части – ионы несущие положительные и отрицательные заряды).
Плотность тока в электролитах
![]() ,
,
где q – заряд иона;
n – концентрация ионов.
Из закона сохранения электрического заряда следует, что сумма зарядов положительных и отрицательных ионов равна нулю, следовательно:
![]() ,
,
здесь n0 – концентрация молекул растворённого вещества,
![]() – коэффициент диссоциации, т.е. отношение
концентрации ионов к концентрации
молекул вещества в электролите.
– коэффициент диссоциации, т.е. отношение
концентрации ионов к концентрации
молекул вещества в электролите.
Следовательно, плотность тока:
![]() .
.
Постоянство тока в жидкости объясняется тем, что ионы, двигаясь среди молекул растворителя, имеющих большой дипольный момент, встречают сопротивление и очень скоро приобретают установившуюся скорость. Независимость подвижности ионов от напряженности электрического поля обеспечивает выполнение закона Ома для столба жидкости. Благодаря наличию ионов двух знаков закон Ома для электролитов записывается в виде
![]() ,
,
где
![]() – подвижность иона;
– подвижность иона;
– проводимость электролита.
Однако, для электролитической ванны в целом (включая электроды) закон Ома не выполняется, так как на границе металл–раствор возникают скачки потенциала.
Рост электропроводности при нагревании электролита качественно объясняется уменьшением ориентации молекул растворителя, препятствующих движению иона. Электропроводности жидкостей гораздо меньше, чем металлов.
