
- •Неорганическая химия: учеб. Пособие / л.Н.Зорина и др.; под общ. Ред. Н 52 а м. Сыркина. – Уфа: Нефтегазовое дело, 2009 – 128с.
- •Введение
- •6. Термическая устойчивость соединений элемента.
- •7. Качественные реакции на характеристичные ионы.
- •8. Применение соединений элемента.
- •Лабораторная работа № _____
- •Основные правила безопасной работы в химической лаборатории
- •1. Химия металлов
- •Диаграмма Латимера для хрома:
- •Опыт I. Взаимодействие хрома с кислотами
- •Отметить цвет раствора после добавления Na2s2o3 . Сделать вывод о свойствах дихромата калия.
- •2. Химия неметаллов
- •Получение и свойства оксидов азота
- •Диаграмма Латимера для азота:
- •Диаграмма Латимера для фосфора
- •Диаграмма Латимера для серы
- •Произведение растворимости некоторых
- •Стандартные окислительно-восстановительные потенциалы
- •Растворимость солей, кислот и оснований в воде
- •Периодическая таблица д.И.Менделеева
- •Образец оформления титульного листа отчета о лабораторной работе Уфимский государственный нефтяной технический университет Кафедра «Общая и аналитическая химия»
- •Библиографический список
- •Содержание
- •Учебное издание
- •450062, Республика Башкортостан г. Уфа, ул. Космонавтов, 1
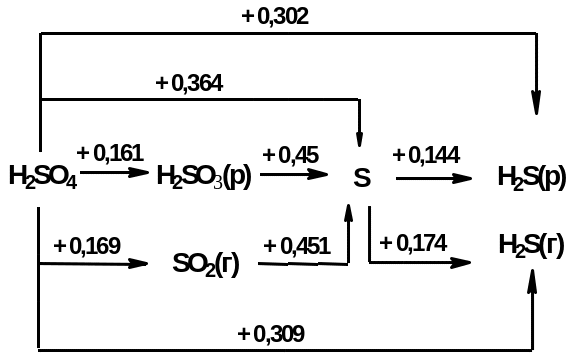
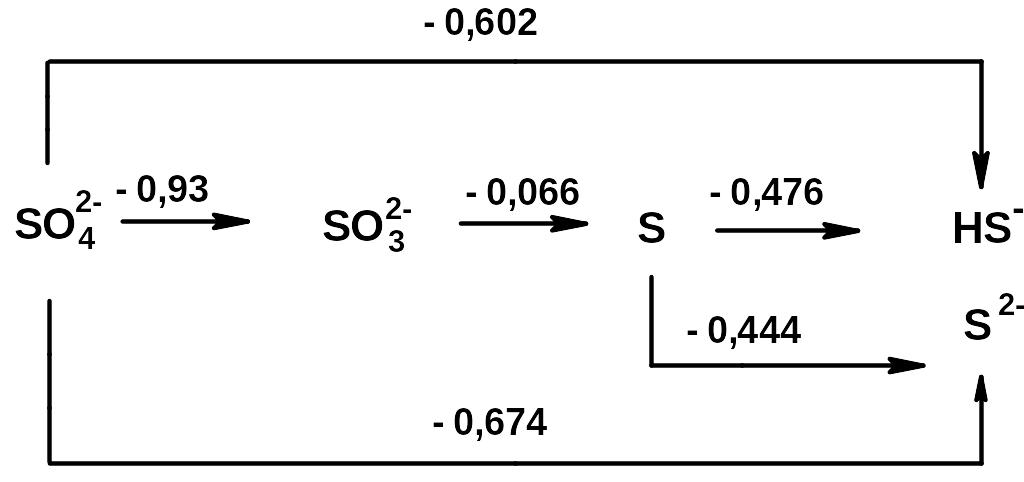
Диаграмма Латимера для серы
а) в кислой среде:
б) в щелочной среде:
Cерная кислота является окислителем. Причем разбавленная кислота окисляет ионом H+. Сульфат-ион проявляет окислительные свойства при высоких концентрациях в сильно кислой среде. Концентрированная серная кислота окисляет большинство металлов, стоящих в ряду стандартных окислительно-восстановительных потенциалов металлов левее серебра. Некоторые металлы (Al, Cr, Fe, Co, Ti и другие) пассивируются на холоде концентрированной серной кислотой. Продуктами реакции являются соль металла, вода и продукты восстановления серы (+6): SO2, S или H2S. Например:
Mg + H2SO4 → MgSO4 + SO2 + H2O
Mg + H2SO4 → MgSO4 + H2S + H2O
Концентрированная серная кислота окисляет неметаллы:
S + 2H2SO4 → 3SO2 + 2H2O,
а также обладает водоотнимающим, обугливающим действием по отношению к органическим веществам.
Соединения серы в промежуточной (+4) степени окисления проявляют двойственные окислительно-восстановительные свойства.
Вопросы для подготовки к занятию
1. Электронные конфигурации атомов, валентные электроны, степени окисления.
2. Свойства простых веществ – неметаллов VIA подгруппы:
- окислительная и восстановительная активность неметаллов, значения стандартных окислительно-восстановительных потенциалов для процессов окисления и восстановления;
- взаимодействие с металлами;
- взаимодействие с кислородом, галогенами, азотом и другими неметаллами;
- отношение к воде, водным растворам щелочей, водным растворам кислот, окисляющим ионом H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другим);
- взаимодействие с концентрированной H2SO4, разбавленной и концентрированной HNO3.
3. Свойства оксидов и кислот неметаллов VIA подгруппы:
- растворимость, взаимодействие с водой, диссоциация в водном растворе;
- взаимодействие с основаниями и основными оксидами.
4. Свойства соединений неметаллов VIA подгруппы с водородом.
5. Свойства солей, образуемых кислотными соединениями неметаллов VIA подгруппы:
- растворимость в воде, гидролиз;
- растворимость в кислотах.
6. Окислительно-восстановительные свойства соединений неметаллов VIA подгруппы.
7. Нахождение в природе и получение простых веществ – неметаллов.
8. Получение и применение неметаллов VIA подгруппы и их соединений.
Экспериментальная часть
Опыт 1. Сероводород и его свойства
а) Получение сероводорода и его горение
Пробирку, на 1/3 наполненную мелкими кусочками сернистого железа, закрепить в штативе. Добавить в нее концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Быстро закрыть пробирку пробкой с отводной трубкой. Выделяющийся газ зажечь у конца отводной трубки. Над пламенем горящего газа подержать смоченную дистиллированной водой индикаторную бумажку. Объяснить изменение ее цвета. Отметить наблюдаемые явления. Написать уравнения реакций:
- получения сероводорода;
- полного сгорания сероводорода;
- взаимодействия с водой газа, полученного при горении сероводорода.
Указать, какая из этих реакций относится к окислительно-восстановительной.
б) Растворение сероводорода в воде
В пробирку с сульфидом железа (II) добавить концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Закрыть пробирку пробкой с изогнутой трубкой. Выделяющийся сероводород направить в пробирку, наполненную дистиллированной водой. Добавить в полученную сероводородную воду индикатор.
Отметить и объяснить изменение цвета индикатора, указав, что собой представляет водный раствор сероводорода. Написать уравнения диссоциации сероводородной кислоты и выражения констант диссоциации по 1-ой и по 2-ой ступени. Выписать их значения из таблицы. Сделать вывод о свойствах сероводородной кислоты.
в) Восстановительные свойства сероводорода
В две пробирки внести растворы: в первую - 5 капель перманганата калия и 2 капли 2н. раствора серной кислоты, во вторую - 5 капель дихромата калия и 2 капли 2н. раствора серной кислоты. В каждую из пробирок добавлять по каплям сероводородную воду до изменения окраски растворов и помутнения вследствие выделения серы.
Написать уравнения соответствующих реакций, учитывая, что MnO4--ион переходит в ион Mn2+ , а дихромат-ион (Cr2O72-) восстанавливается до Cr3+.
Опыт 2. Получение малорастворимых сульфидов
В первую пробирку внести 2 - 3 капли раствора сульфата марганца(II), во вторую пробирку - 2 - 3 капли раствора нитрата свинца(II). В каждый раствор добавить, по 2 - 3 капли сульфида аммония. Наблюдать выпадение осадков сульфида марганца(II) и сульфида свинца(II). К полученным осадкам прибавить по 2 - 3 капли 2н. раствора азотной кислоты.
Какой сульфид растворился? Возможно ли его образование в кислой среде?
Написать уравнения реакций получения сульфидов марганца(II) и свинца(II) в молекулярном и ионном виде. Указать цвет осадков.
Написать уравнение реакции растворения MnS в кислоте. Пользуясь значениями ПРMnS и ПРPbS, а также констант диссоциации сероводородной кислоты, рассчитать константы равновесия для процессов растворения сульфида свинца(II) и сульфида марганца(II) в кислоте. Сделать вывод о направлении протекания указанных реакций.
В две другие пробирки с растворами тех же солей марганца(II) и свинца(II) добавить по 3 - 4 капли сероводородной воды. В каком случае образование осадка не наблюдалось? Почему?
Объяснить различные результаты действия H2S и (NН4)2S на соль марганца и образование осадка PbS в обоих случаях.
Образование черного осадка PbS может служить реакцией обнаружения иона Pb2+ или сероводорода.
Опыт 3. Получение диоксида серы и его растворение в воде
В колбу поместить кристаллический сульфит натрия (Na2SO3), добавить 6-8 капель 4 н. раствора серной кислоты и быстро закрыть пробкой с отводной трубкой. Выделяющийся газ пропустить в пробирку с дистиллированной водой в течение 2-3 мин. Если выделение газа идет недостаточно энергично, пробирку осторожно подогреть. Проверить универсальным лакмусом рН раствора. На какие свойства водного раствора SO2 указывает окраска лакмуса?
Написать уравнения реакций:
Na2SO3 + H2SO4
SO2 + H2O
Сохранить раствор SO2 для следующего опыта.
Опыт 4. Окислительные и восстановительные свойства соединений серы (IV)
а) Окислительные и восстановительные свойства SO2.
В две пробирки, одна из которых с сероводородной (а), другая с иодной водой (б) (по 3-5 капель), добавить по несколько капель водного раствора SO2. Отметить происходящие изменения в растворах. Написать уравнения соответствующих реакций и указать, какие свойства проявляет диоксид серы в том и другом случае.
Р


 аствор
SO2
Раствор
SO2
аствор
SO2
Раствор
SO2
Р

 аствор
H2S
в воде Раствор I2
в воде
аствор
H2S
в воде Раствор I2
в воде
а) б)
H2S + SO2 I2 +SO2
б)
Восстановительные свойства SО![]() -
иона.
-
иона.
В
пробирку, содержащую 5-6 капель раствора
перманганата калия и 3-4 капли 2н раствора
азотной кислоты, прибавить несколько
кристалликов сульфита натрия. Отметить
обесцвечивание раствора в связи с
переходом иона MnO![]() в ион Mn2+.
в ион Mn2+.


 Na2SO3
(крист.)
Na2SO3
(крист.)
2н HNO3 (3-4 капли)



 KMnO4
(5-6 капли)
KMnO4
(5-6 капли)


 KMnO4
+ HNO3
+ Na2SO3
…
KMnO4
+ HNO3
+ Na2SO3
…
Данная реакция может служить реакцией открытия иона SO32- в отсутствии других восстановителей. В какое соединение при этом перешел сульфит натрия? Учитывая, что сульфит бария растворим в азотной кислоте, а сульфат бария нерастворим, убедиться в переходе иона SO32- в ион SO42-, для чего в полученный раствор добавить 1-2 капли 2н азотной кислоты и столько же раствора хлорида бария. Какое соединение выпало в осадок? Отметить наблюдаемые явления и написать уравнения всех протекающих реакций.
Опыт 5. Дегидратирующие свойства серной кислоты
а) Обугливание бумаги.
На листочке фильтрованной бумаги с помощью стеклянной палочки сделать надпись 2 н.раствором серной кислоты. Бумагу просушить, держа высоко над пламенем горелки. Отметить и объяснить почернение. Какое свойство проявляет серная кислота в этом опыте?
б) «Черная колонна» (демонстрационный).
В стаканчик объемом 100 мл поместить 10-15 гр сахарозы (С12Н22О11) или глюкозы (С6Н12О6), поместить стеклянную палочку длиной приблизительно 30 см. Прилить по палочке 10 мл 4н.серной кислоты, энергично перемешать палочкой, оставить палочку в стакане вертикально. Через некоторое время содержимое стакана начнет увеличиваться в объеме. Написать уравнения реакций. Объяснить образование газа с резким запахом. Составить уравнения реакций.



С6Н12О6 + Н2SО4
С12Н22О11 +Н2SО4
С + H2SO4
Опыт 6. Взаимодействие серной кислоты с металлами
а) Взаимодействие разбавленной серной кислоты с металлами
В три пробирки внести 5-8 капель 2 н. раствора серной кислоты и по 2-3 кусочка металлов: в первую – цинка, во вторую – железа, в третью – меди. Если реакция идет медленно, слегка подогреть пробирки небольшим пламенем горелки. В каком случае реакция не идет? Почему? Написать уравнения протекающих реакций. Какой элемент в этих реакциях является окислителем?
5-8 капель 5-8 капель 5-8 капель
 2н
H2SO4
2н H2SO4
2н H2SO4
2н
H2SO4
2н H2SO4
2н H2SO4


 Zn
Fe
Cu
Zn
Fe
Cu





б) Взаимодействие концентрированной серной кислоты с цинком.
В пробирки поместить немного цинковой пыли и налить 5-10 капель концентрированной серной кислоты (плотность 1,84 г/см3). Пробирку нагреть над небольшим пламенем спиртовки. Над пробиркой подержать фильтровальную бумагу, смоченную раствором ацетата или нитрата свинца. Объяснить появление темного пятна на этой бумаге. Описать наблюдаемые явления. Написать уравнения реакции взаимодействия концентрированной серной кислоты с цинком с образованием сероводорода.
в) Взаимодействие концентрированной серной кислоты с медью.
В пробирку поместить 1-2 кусочка медной стружки и прилить 5-10 капель концентрированной серной кислоты (плотность 1,84 г/см3). Пробирку слегка нагреть над пламенем спиртовки.
H2SO4
 Влажную синюю лакмусовую бумажку
подержать над про
Влажную синюю лакмусовую бумажку
подержать над про
(конц) биркой. Отметить изменение цвета лакмусовой бумажки.
По запаху (осторожно!) определить какой газ в ыделяется.
Cu Содержимое пробирки выпарить, охладить и раствор ить,
 прибавив в
пробирку 8-10 капель дистиллированной
воды.
прибавив в
пробирку 8-10 капель дистиллированной
воды.
Перенести пипеткой некоторое количество раствора в
 чистую
пробирку. Отметить окраску раствора.
Для какого
чистую
пробирку. Отметить окраску раствора.
Для какого
иона характерна эта окраска? Описать наблюдаемые явле

 ния.
Ответить на поставленные вопросы.
Написать уравне
ния.
Ответить на поставленные вопросы.
Написать уравне
ние реакции и указать, какой элемент в молекуле серной
кислоты является окислителем?
Опыт 7. Различная растворимость сульфита и сульфата бария в кислоте
В
двух пробирках получить обменной
реакцией сульфит и сульфат бария, для
чего взять по 3-4 капли растворов
соответствующих солей Na2SO3
или Na2SO4
и BaCl2.
Наблюдать образование осадков в обеих
пробирках. Сравнить растворимость
сульфита и сульфата бария в кислоте,
добавив в обе пробирки по 1-2 капли 2 н.
соляной кислоты. Что наблюдается? Можно
ли этой реакцией различить ионы SO![]() и SO
и SO![]() .
Написать уравнения реакций получения
сульфата и сульфита бария и растворения
последнего в кислоте.
.
Написать уравнения реакций получения
сульфата и сульфита бария и растворения
последнего в кислоте.
Опыт 8. Восстановительные свойства тиосульфата натрия
В две пробирки внести раздельно по 5-6 капель бромной и иодной воды. В обе пробирки добавить по несколько капель тиосульфата натрия до обесцвечивания растворов.
Написать уравнения протекающих реакций, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. (Выделяющаяся сера является продуктом побочной реакции.) Йод окисляет тиосульфат до тетратионата Na2S4O6. В какую степень окисления переходит при этом бром и иод? Может ли хлорная вода окислить тиосульфат натрия? Ответ мотивировать, используя окислительно-восстановительные потенциалы.
Опыт
9. Качественное определение ионов SO
,
SO
,
S![]() O
,
S
O
,
S![]() и их открытие
и их открытие
Получить у преподавателя сухую соль, растворить ее в дистиллированной воде и размешать стеклянной палочкой. Установить любыми известными вам реакциями, является ли данная соль сульфитом, сульфатом, тиосульфатом или сульфидом. (В каждом отдельном случае брать 5-6 капель исходного раствора.)
Описать методику работы и наблюдаемые явления, на основании которых сделать вывод о присутствии или отсутствии каждого иона. Записать уравнения соответствующих реакций.
Контрольные вопросы
1.Написать электронные формулы атомов серы, селена и теллура в невозбужденном и возбужденном состояниях.
2. В какой степени окисления сера может быть: а) только окислителем;
б) только восстановителем? Написать соответствующие электронные формулы. Привести примеры реакций.
3. В какой степени окисления сера может быть окислителем и восстановителем? Привести примеры соответствующих реакций.
4. Написать уравнения ступенчатой диссоциации сероводородной кислоты. Как будет смещаться равновесие при прибавлении: а) хлороводородной кислоты; б) нитрата свинца (II); в) щелочи?
5. Какие вещества будут получаться при взаимодействии FeS: а) с хлороводородной кислотой, б) концентрированной азотной кислотой? Написать соответствующие уравнения реакций.
6. Написать формулы: а) двух различных сульфидов, нерастворимых в воде и растворимых в кислой среде; б) двух сульфидов, нерастворимых в нейтральной и кислой среде. Составить уравнения реакций их получения и растворения в кислоте.
7. Написать уравнения реакций получения сернистого газа тремя различными способами. В каком состоянии гибридизации находится атом серы в молекуле SO2? Какова в связи с этим геометрическая структура молекулы?
8. Какие ионы получатся при пропускании SO2: а) в чистую воду; б) в воду, содержащую Cl2? Написать соответствующие уравнения в ионном виде.
9. Какая соль - K2SeO3 или K2SO3 имеет большую степень гидролиза в водном растворе одинаковой концентрации?
10. Написать графическую формулу тиосульфата натрия, указать степени окисления серы в этом соединении и объяснить его неустойчивость в кислой среде.
11. Можно ли в качестве осушителя для сероводорода, бромоводорода и йодоводорода применить концентрированную серную кислоту? Ответ мотивировать, написать соответствующие уравнения реакций.
12. Написать в молекулярном и ионном виде уравнения реакций:
а) (NH4)2S +FeCl2
б) H2S +FeCl3
в) H2SO4 (конц.) +Zn
13. Дописать уравнения реакций и расставить коэффициенты:
а) H2S + HNO3 (конц.)
б) K2Cr2O7 + Na2S +H2SO4 S +Cr2 (SO4)3 +…
в) Na2SO3 +Zn +HCl (разб.)
г) H2SO3 +KMnO4 Mn2+ +…
д) FeSO4 + K2S2O8 Fe3+ +…
14. Назовите аллотропные модификации серы. Каковы температуры фазовых переходов?
15. Составить молекулярные и сокращенные ионные уравнения реакции гидролиза сульфидов и сульфитов.
16. Пользуясь электронными и электронно–ионными схемами, написать уравнения для следующих окислительно–восстановительных реакций:
а) Na2SO3 +Cl2 +H2O Na2SO4 +HCl
б) Na2SO3 Na2SO4 +Na2S
в) Hg +H2SO4 HgSO4 +SO2 +H2O.
17. Сернистый газ, получившийся при сжигании 179,2 л сероводорода, пропущен через 2л 25%-ного раствора гидроксида натрия (плотность раствора 1,28 г/см3). Каков остаток образовавшейся соли и какова ее концентрация в растворе?
18.Составить уравнения реакций для следующих превращений:
FeS SO2 H2SO3 BaSO4 BaS
19. Составить уравнения реакций для следующих превращений:
SO2 SO3 H2SO4 H2S ZnS
20. Составить уравнения реакций для следующих превращений:
S SO2 K2SO3 BaSO3 BaSO4
21. Составить уравнения реакций для следующих превращений:
FeS2 SO2 Na2SO3 Na2S2O3 Na2S4O6
22. Составить уравнения реакций для следующих превращений:
SO2 SO3 H2SO4 S ZnS
23. Сравните значения молярной концентрации сульфид-ионов в 0,1М растворах: а) сероводорода; б) гидросульфида натрия при 25° С.
24. Определите молярную концентрацию (моль/л) гидросульфид- и сульфид-ионов в О,1М растворе сероводорода при 25о С в отсутствие и в присутствии хлороводорода с концентрацией 0,1 моль/л.
25. Рассчитайте рН 0,1 М раствора сульфида натрия.
Лабораторная работа № 15
Тема: Химические свойства неметаллов VIIA подгруппы
Цель работы: изучение химических свойств неметаллов VIIA подгруппы – галогенов
Краткая теория: Химические свойства неметаллов VIIA подгруппы и их соединений
Галогены
Г
17
Cl
хлор
неметаллическими свойствами. В газообразном
состоянии они образуют двухатомные молекулы.
Так как галогены обладают высокой химической
активностью, в природе они находятся только в
связанном состоянии.
Конфигурация валентных электронов атомов галогенов …ns2np5. До полного завершения наружного валентного слоя не хватает одного электрона, поэтому валентное состояние в виде одноразрядных отрицательных галогенид-ионов наиболее устойчиво: I+eI-.
Вследствие большого сродства к электрону свободные галогены являются сильными окислителями. По ряду F2, Cl2, Br2, I2 уменьшается окислительная активность и возрастает восстановительная активность. Более сильный окислитель - Cl2 вытесняет иод из иодидов
2 KI + Cl2 2 KCl + I2
Все галогены, кроме фтора, можно перевести в состояние со степенью окисления +1, +3, +5, +7. Отсутствие таких соединений у фтора объясняется особенностями строения его внешней электронной оболочки:
Фтор с кислородом образует соединение OF2, кислород в этом соединении имеет степень окисления +2. Хлор, бром и иод с кислородом дают оксиды различного состава, кислородные кислоты и их соли.
В ряду: НГО - НГО2 - НГО3 - НГО4 растет сила кислородсодержащих кислот. НClО4 - самая сильная минеральная кислота.
В ряду Cl2 - Br2 - I2 растет восстановительная активность, поэтому каждый последующий член этого ряда может вытеснить предыдущий из кислородных соединений, например,
I2 + 2 KClO3 Cl2 + 2 KIO3
В ряду HClO - HBrO - HIO самый сильный окислитель - кислота HClO.
При растворении галогенов в воде происходят химические реакции
F2 + H2O = 2HF + O; F2 + O = OF2.
Хлор, бром, иод реагируют с водой с образованием двух кислот:
Г 2 + H2O НГ + НОГ
Равновесие сдвинуто влево. В растворах щелочей равновесие смещается вправо и удается получить соли кислородсодержащих кислот
Cl2 + 2 NaOH NaCl + NaClO + H2O
При взаимодействии галогенов с горячими растворами щелочей получаются хлораты (соли HClO3), броматы (соли HBrO3) и иодаты (соли HIO3).
3 Г2 + 6 КОН = КГО3 + 5 КГ + 3 Н2О
В водных растворах хлорноватистая кислота разлагается:
3 HClO = 2 HCl + HClO3
Ослабление окислительных свойств в направлении от хлорноватистой к хлорной кислоте можно объяснить большей устойчивостью перхлорат ионов в результате дополнительного -связывания.
Кислородные соединения галогенов окисляют в кислой среде и восстанавливаются при этом в отрицательно заряженные галогенид-ионы :
ClO- + 2H+ + 2 e Cl- + H2O
ClO2- + 4 H+ + 4 e Cl- + 2H2O
ClO3- + 6 H+ + 6 e Cl- + 4 H2O
ClO4- + 8 H+ + 8e Cl- + 4 H2O
В тех случаях, когда восстановителем является галогенид-ион, восстановление кислородного соединения того же галогена протекает до свободного галогена:
ClO3- + 6 H+ + 5 Cl- = 3Cl2 + 3 H2O
При растворении газообразных галогеноводородов в воде образуются сильные галогеноводородные кислоты.
В ряду HF - HCl - HBr - HI кислотные свойства возрастают, так как в этом ряду падает прочность связи молекул НГ вследствие увеличения атомного радиуса галогенов. Фтороводородная кислота является слабой. Указанная аномалия обусловлена большей прочностью связи H-F и способностью HF образовывать ассоциаты типа (HF)n, где n может быть равно 4.
Различная восстановительная активность галогеноводородов обусловливает различное взаимодействие их с концентрированной серной кислотой:
F- и Cl- - слабые восстановители и поэтому фториды и хлориды с серной кислотой вступают в реакции обмена:
2 KF + H2SO4 = K2SO4 + 2 HF
2 KCl + H2SO4 = K2SO4 + 2 HCl
Br- и I- - сильные восстановители, они окисляются концентрированной серной кислотой до свободных Br2 и I2:
2 KBr + 2 H2SO4 = K2SO4 + Br2 + SO2 + 2 H2O
8 KI + 5 H2SO4 = 4 K2SO4 + 4 I2 + H2S + 4 H2O
Галогены соединяются почти со всеми металлами, образуя галогениды металлов. В галогенидах щелочных и щелочноземельных металлов связи ионные. По мере уменьшения активности металлов связи в галогенидах становятся менее ионными и всё более ковалентными.
Характер их меняется от типичных солей (NaCl) до кислотообразующих соединений (SnCl4, PCl5).
Вопросы для подготовки к занятию
1. Электронные конфигурации атомов, валентные электроны, степени окисления.
2. Свойства простых веществ – галогенов:
- окислительная и восстановительная активность галогенов, значения стандартных окислительно-восстановительных потенциалов для процессов окисления и восстановления;
- взаимодействие с металлами;
- взаимодействие с кислородом, серой, азотом и другими неметаллами;
- отношение к воде, водным растворам щелочей, водным растворам кислот, окисляющим H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другим);
- взаимодействие с концентрированной H2SO4, разбавленной и концентрированной HNO3.
3. Свойства оксидов и кислот неметаллов VIIA подгруппы:
- растворимость, взаимодействие с водой, диссоциация в водном растворе;
- взаимодействие с основаниями и основными оксидами.
4. Свойства соединений галогенов с водородом (галогеноводородов).
5. Свойства солей неметаллов VIIA подгруппы:
- растворимость в воде, гидролиз;
- растворимость в кислотах.
6. Окислительно-восстановительные свойства соединений неметаллов VIIA подгруппы.
7. Нахождение в природе и получение простых веществ – неметаллов.
8. Получение и применение неметаллов VIIA подгруппы и их соединений.
Экспериментальная часть
Все опыты проводить в вытяжном шкафу, так как все галогены и галогеноводороды очень ядовиты!
Опыт 1. Получение галогенов (демонстрационный)
а) Получение хлора.
В 2 пробирки раздельно внести по 2-3 кристаллика KMnO4 и K2Cr2O7. В обе пробирки добавить по 2-3 капли концентрированной HCl. Вторую пробирку подогреть. Наблюдать выделение хлора.
Написать уравнения протекающих реакций, учитывая, что K2Cr2O7 переходит в Cr(III), а KMnO4 - в хлорид марганца (II). Указать окислитель и восстановитель.
б) Получение брома и йода.
В 2 пробирки внести: в одну - 2-3 кристаллика бромида калия и 1-2 микрошпателя диоксида марганца, в другую – 2-3 кристаллика иодида натрия и 1-2 микрошпателя диоксида марганца. В каждую пробирку добавить по 2-3 капли концентрированной H2SO4. Отметить выделение Br2 и I2 в газообразном состоянии. Написать уравнения протекающих реакций, учитывая, что MnO2 переходит в MnSO4.
Опыт 2. Окислительные свойства галогенов и их сравнительная
активность
а) Окислительные свойства галогенов.
В три пробирки внести по 3-5 капель хлорной , бромной и иодной воды.
Добавить к хлорной воде несколько капель сероводородной воды до появления мути. К бромной и иодной воде добавить порошок магния. Перемешать растворы стеклянной палочкой и отметить их обесцвечивание. Написать уравнения протекающих реакций.
б) Сравнение окислительных свойств галогенов.
В одну пробирку внести 3-5 капель раствора NaBr, а в две другие - по 3-5 капель раствора KI. Во все три пробирки добавить по 2-3 капли органического растворителя.
В пробирки с раствором бромида и иодида натрия внести по 3-4 капли хлорной воды, а в пробирку с раствором иодида натрия - столько же бромной воды. По окраске полученного слоя органического растворителя установить, какой галоген выделяется в свободном виде в каждой из пробирок.
Написать уравнения реакций. Расположить галогены в ряд по убыли их окислительной активности.
в) Окисление сульфата железа (II).
В две пробирки раздельно внести по 3-5 капель бромной и иодной воды. Добавить в каждую из пробирок по 1-2 кристаллика сульфата железа (II). Что наблюдается? Написать уравнение протекающей реакции.
Опыт 3. Восстановительные свойства галогеноводородов
а) Восстановление серной кислоты галогеноводородами.
В три пробирки раздельно внести по 2-3 микрошпателя хлорида, бромида и иодида калия и по 2-3 капли концентрированной серной кислоты. Наблюдать в начале реакции выделение белого дыма в каждой пробирке.
Отметить последующее появление бурых паров брома и иода в соответствующих пробирках. По запаху определить выделение диоксида серы во второй пробирке и сероводорода - в третьей. Написать уравнения реакции.
б) Восстановление дихромата калия.
В три пробирки внести по 2-4 капли дихромата калия, подкисленного 2н серной кислотой ( 1-2 капли). Добавить по 2-3 капли в первую пробирку раствора иодида калия, во вторую - столько же какого-либо бромида и в третью - хлорида натрия. Растворы перемешать чистой стеклянной палочкой.
В каком случае восстановление дихромата не произошло? Написать уравнения реакций, учитывая, что дихромат калия переходит в сульфат хрома (III) зеленого цвета.
в) Восстановление хлорида железа (III).
Проделать опыт, аналогичный опыту 3б, заменив раствор дихромата калия раствором хлорида железа (III). Что наблюдается?
В каком случае произошло восстановление FeCl3 и окисление галогена? Как изменяется восстановительная способность галогенид-ионов? Расположить их в ряд по возрастающей восстановительной активности.
Опыт 4. Характерные реакции на галогенид - ионы
Образование осадков AgCl, AgBr и AgI является характерной реакцией на ионы галогенов. Получить указанные вещества реакцией обмена. Необходимые растворы соответствующих солей брать в количестве 2-3 капель. К полученным осадкам добавить по 2-3 капли 2н раствора азотной кислоты. Наблюдается ли их растворение? Написать уравнения реакций обмена в молекулярной и ионной форме, отметить цвет полученных осадков и результат действия на них азотной кислоты.
В пробирки с осадками галогенидов серебра добавить избыток концентрированного раствора аммиака. Отметить, какой осадок растворился. Составить уравнения реакций, учитывая, что растворение осадков происходит в результате образования комплексного соединения – галогенида диаминсеребра(I). К осадку, не растворившемуся в избытке аммиака, добавить избыток тиосульфата натрия до полного растворения осадка. Составить уравнения реакций, учитывая, что растворение осадков происходит в результате образования комплексного соединения – дитиосульфатоаргентата(I) натрия. Объяснить разную растворимость галогенидов серебра в аммиаке и в тиосульфате натрия, используя справочные значения произведений растворимости галогенидов серебра и констант нестойкости комплексных соединений - диаминсеребра(I) и дитиосульфатоаргентата(I). Какой реагент – аммиак или тиосульфат натрия – может быть использован для разделения галогенидов серебра?
Контрольные вопросы
1. Какие степени окисления характерны для атомов галогенов? Почему для фтора не характерны положительные степени окисления?
2. Как объяснить разное агрегатное состояние галогенов при стандартных условиях и наблюдаемую закономерность в изменении температур кипения и плавления при переходе от фтора к астату? Чем объяснить, что галогены лучше растворимы в органических растворителях, чем в воде?
3. Как изменяется окислительная способность галогенов в ряду: фтор – астат? Могут ли они проявлять восстановительные свойства?
4. Какие химические реакции могут протекать, если через раствор бромида натрия пропустить газообразный фтор? Написать уравнения реакций.
5. Как и почему изменяется восстановительная способность в ряду галогеноводородов? Можно ли использовать фтороводород в качестве восстановителя?
6. Написать уравнения реакций взаимодействия кристаллических NaF, NaCl, NaBr, NaI с концентрированной серной кислотой и объяснить причину различия в характере протекающих при этом процессов.
7. Какие химические реакции лежат в основе промышленных и лабораторных методов получения фтороводорода? Из какого материала изготавливается аппаратура для его получения?
8. Написать уравнения реакций галогенов а) с водой; б) с водным раствором гидроксида натрия при комнатной температуре и при нагревании.
9. Сравнить устойчивость, кислотные и окислительные свойства в ряду кислот: HClO – HClO2 – HClO3 – HClO4.
10. Сравнить гидролизуемость солей в рядах: а) KClO – KClO2 – KClO3 – KClO4; б) KClO – KBrO – KIO.
11. Действием каких галогенов можно вытеснить бром: а) из раствора бромида калия; б) из раствора бромата калия? Написать уравнения реакций.
12. При пропускании хлора через раствор иодида калия раствор желтеет, а затем обесцвечивается. Написать уравнения протекающих реакций.
13. Написать уравнения реакций получения хлороводорода тремя различными способами. Какая из приведенных реакций не применима для получения бромоводорода и иодоводорода? Почему?
14. Составить формулы известных оксидов хлора и написать уравнения реакций их взаимодействия с водой.
15. Как получают фтор в промышленных условиях? Можно ли получить фтор в водной среде?
16. Сравнить кислотные свойства в ряду: HF –HCl – HBr – HI. Какова реакция среды в водных растворах а) бромида калия; б) бромида аммония;
в) фторида калия.
17. Как получить хлорную известь, исходя из карбоната кальция, хлорида натрия и воды? Написать уравнения соответствующих реакций. Какие при этом получаются побочные продукты?
18. Как получают хлорат калия в промышленных и лабораторных условиях? Написать уравнения реакций.
19. С какими из перечисленных веществ взаимодействует бромоводород:а) гидроксид кальция; б) магний; в) хлорат калия? Написать уравнения протекающих реакций.
20. Составить уравнения реакций:
а) NaCl + KClO3 + H2SO4 →
б) NaCrO2 + Br2 + NaOH →
в) I2 + HNO3(конц.) →
г) Cl2 + NaOH →
д) Cl2 + NaOH →
е) Cl2 + I2 + → KIO3
21. Составить уравнения реакций для превращений:
а) NaCl → Cl2 → CaCl(OCl) → CaCl2
б) NaI → I2 → KI → CuI
Домашнее задание по теме
«Основные законы химии. Расчеты по уравнениям реакций»
1. Сколько минут следует пропускать ток силой 5 А, чтобы получить
1,5 л гремучего (2 объема Н2 и 1 объем О2) газа(20°С и 98,64 кПа)?
2. Сколько миллилитров 4 н. раствора НCl потребуется для взаимодействия с 10 г цинка? Вычислить объем образующегося газа (0°С и 50,65 кПа). Какова будет нормальность полученного раствора соли, если его разбавить до 0,5 л?
3. Сколько литров водорода (20оС и 100 кПа) выделится при взаимодействии 165 г железа с 1 кг 30%-ного раствора НС1? Сколько граммов НС1 не войдет при этом в реакцию?
4. Масса 1 л газа, измеренного при З1оС и 104 кПа, составляет 1,154 г. Найти плотность газа по водороду.
5. Какова плотность гремучего газа (2 объема Н2 и 1 объем О2) по отношению: а) к водороду; б) кислороду; в) водяному пару; г) воздуху?
6. Для наполнения аэростатов в полевых условиях иногда пользуются взаимодействием гидрида кальция с водой. Сколько килограммов гидрида кальция придется израсходовать для наполнения аэростата объемом 500 м3 (считая условия нормальными)?
7. Какой объем водорода следует добавить к 1 м3 кислорода, чтобы получить смесь, плотность которой равна плотности воздуха?
8. Плотность некоторой смеси водорода с кислородом по отношению к водороду равна 10. Вычислить процентный состав этой смеси.
9. После реакции между пероксидом натрия и водой общий объем раствора составил 750мл; 10 мл полученного раствора потребовалось для нейтрализации 15 мл 0,2 н. НС1. Сколько граммов Na2O2 вошло в реакцию?
10. При электролизе водного раствора хлорида натрия в течение 6 ч при силе тока 1000 А получено 70л 10,6%-ного раствора NаОН (ρ=1,12 г/см3). Вычислить выход по току.
11. Каким объемом 35%-ного раствора КОН (ρ = 1,34 г/см3) можно заменить 10 л 4 н. раствора КОН?
12. Плотность 10,85%-ного раствора Nа2СО3 составляет 1,116 г/см3. Вычислить процентное содержание кристаллической соды Nа2СО3•10Н2О в растворе. Сколько килограммов кальцинированной и кристаллической соды содержится в 1 м3 указанного раствора?
13. Какой объем СО2 (27°C и 81 кПа) получится при нагревании 1,4 т NaHCO3? Сколько тонн кальцинированной соды получится при этом?
14. Вычислить расход сырья — объем рассола с содержанием 300 г NaCl в 1 л, NH3 и СО2 (в кубических метрах при 0°С и 101,3 кПа), требуемый для производства 1 т кальцинированной соды по аммиачному способу, считая, что только 2/з NaCl превращается в соду, а образующийся при прокаливании NаНСО3 оксид углерода (IV) без потерь возвращается в производственный цикл.
15. При взаимодействии 1г смеси КС1 и NН4Cl с раствором Н2[РtС16] образовалось 1,5 г малорастворимой соли K2[РtС16]. Вычислить процентное содержание KCl в смеси.
16. Насыщенный раствор медного купороса содержит 27,06% CuSO4•5H2O. Выразить концентрацию раствора в процентах безводной соли CuSO4.
17. При промышленном получении медного купороса медный лом окисляется при нагревании кислородом воздуха и полученный оксид меди (II) растворяется в серной кислоте. Вычислить теоретический расход меди и 80%-ной (по массе) серной кислоты на 1 т CuSO4•5H2O.
18. При действии 25 мл раствора СuС12 на раствор КI образовалось 0,3173 г йода. Какова молярность раствора СиС12? Какова нормальность раствора СuС12 как окислителя?
19. Исходя из формулы двойной соли арсенита и ацетата меди 3Cu(AsO2)2•Сu(СН3СОО)2 вычислить теоретический расход As2О3 и медного купороса СuSО4•5Н2О на 1 т готового продукта.
20. Сколько килограммов гидрида кальция следует разложить водой, чтобы получить 1680 м3 водорода (0°С и 101,3 кПа)?
21. Какой объём водорода (27оС и 99,7 кПа) получится при разложении водой 21 г гидрида кальция? Какой объем 1 нормального раствора НСl необходим для нейтрализации полученного продукта?
22. Для нейтрализации 100 мл насыщенного при 25оС раствора Ca(OH)2 потребовалось 49 мл 0,1 н раствора HCl. Вычислить произведение растворимости Ca(OH)2 при указанной температуре.
23. Плотность известкового молока, 1 л которого содержит 300 г СаО, составляет 1,22 г/мл. Вычислить процентное содержание оксида кальция и гидроксида кальция в известковом молоке.
24. Насыщенный раствор хлорида бария содержит при 20оС 26,3% BaCl2. Выразить массовую долю (%) кристаллогидрата BaCl2 2H2O в растворе.
25. Какое количество технического цинка, содержащего 96% Zn, и 27,5% -ного раствора НС1 должно быть израсходовано для получения 1т 45%-ного раствора хлорида цинка?
26. Какой объем 8н раствора КОН способен прореагировать с 250 г оксида цинка, содержащего 18,6% примесей, не растворяющихся в щелочах?
27. Нитрат ртути (I) получают растворением ртути в разбавленной азотной кислоте в условиях избытка металла. Сколько литров 25%-ного раствора НNО3 (ρ=1,15 г/см3) расходуется на 1 кг ртути, исходя из принятого на практике молярного соотношения ν(Hg) : ν(НNО3) = 1:1,19?
28. Сколько килограммов ортоборной кислоты Н3ВО3 и какой объем 23%-ного раствора Nа2СО3 (ρ = 1,25 г/см3) необходимо затратить для получения I т буры Nа2В4О7•10Н2О?
29. Пероксоборат натрия NаВО3•4Н2О получают окислением смешанного раствора буры и гидроксида натрия пероксидом водорода. Вычислить расход реактивов— буры (в килограммах), объемы 30%-ного раствора NaOH (ρ=1,33 г/см3) и 3%-ного раствора H2O2 (ρ=1 г/см3), требуемых для получения 1т готового продукта, считая, что реактивы берутся в количествах, на 20% превышающих теоретически вычисленные.
30. Алюминий получают электролизом раствора глинозема в расплавленном криолите. Сколько алюминия получится при электролизе 1 т глинозема, содержащего 94,5% Аl2О3, и какова продолжительность электролиза при силе тока в 30000 А, если коэффициент использования тока составляет 95,5%.
31. Сульфат алюминия А12(SО4)3•18Н2О получают обработкой каолинитовых глин серной кислотой. Сколько тонн глины, содержащей 20% А12O3, надо подвергнуть переработке для получения I т готового продукта, если при этом удается извлечь из глины только 70% А12О3? Каков теоретический расход серной кислоты на 1 т готового продукта?
32. Растворимость TlI составляет при температуре 20°С около 6 10-3 г на 100 г воды. Вычислить приблизительное значение ПР этой соли.
33. Вычислить объем воздуха (21% О2, 0°С, 101,3 кПа), теоретически необходимый для превращения 1т кокса в генераторный газ (смесь CO, N2). Вычислить объем получающейся смеси газов, ее процентный состав и теплотворную способность.
34. Вычислить теоретический состав водяного газа и его теплотворную способность. ∆Ho298,H2O = - 238 кДж/моль.
35. Вычислить процентный состав и теплотворную способность полуводяного (смешанного) газа, полученного смешением равных объемов генераторного и водяного газов.
36. Вычислить процентный состав и теплотворную способность смешанного газа, получаемого в генераторе, в который подается смесь воздуха и водяного пара в соотношении 3:1.
37. Водяной газ содержит 40% СО, 48% Н2, 6% СО2, 5% N2 и 1% СН4. Какой теоретический объем воздуха (21% О2, 0°С, 101,3 кПа) необходим для сжигания 1 м3 газа? Каков будет общий объем газа и его состав в объемных процентах после сжигания, если считать, что пары Н2О конденсируются?
38. Какой объем воздуха (0°С и 101,3 кПа) требуется для сжигания 1 т кокса, содержащего 4% негорючих примесей, если 3/8 массы углерода, содержащегося в коксе, образуют СО2, а 5/8 — СО? Каков объем образующейся газовой смеси и ее процентный состав?
39. Сколько тонн негашеной извести и оксида углерода (IV) дает ежесуточно известково-обжигательная печь, перерабатывающая за сутки 75 т известняка с содержанием 96% СаСО3, если расход угля, входящего в состав шихты, составляет 12% от массы известняка?
40. Исходя из тепловых эффектов реакций:
C + O2 = CO2; ∆Ho298 = - 393 кДж;
CaCO3 = CaO + CO2; ∆Ho298 = + 180 кДж
вычислить теоретическое количество угля, которое следует добавить к 1т известняка для возмещения теплоты, затрачиваемой на его разложение.
41. В сосуд с водой поместили 15,6 г смеси кальция и оксида кальция. Вычислить массу каждого из веществ, зная, что в результате реакции выделилось 5,6 л газа (н.у.).
42. При прокаливании 12 г известняка выделилось 2,24 л оксида углерода (IV) (н.у.). Определить массовую долю карбоната в навеске известняка.
43. Определить массу осадка, образующегося при приливании избытка раствора карбоната натрия к 200 г 20%-ного раствора хлорида кальция.
44. К 100 мл 0,25 М раствора CaCl2 прибавили равный объём 0,25 М раствора Na2SO4. Сколько мг ионов Са2+осталось в растворе?(ПРCaSO4 = 6,110-5).
45. Сколько алебастра можно получить при обжиге 1 т гипса?
46. На сколько увеличится масса 1 кг алебастра при его переводе в гипс?
47. Какой объем воздуха необходимо подать в известково-обжигательную печь, в которую загружена шихта, состоящая из 1 т СаСО3 и 120 кг угля? Каковы объем (0°С и 101,3кПа) и процентный состав газовой смеси, получающейся при обжиге этой массы?
48. При растворении 0,5 г известняка в соляной кислоте получено 75мл СО2 (23°С и 104 кПа). Вычислить процентное содержание СаСО3 в известняке.
49. Продуктами окисления щавелевой кислоты являются СО2 и Н2О. Сколько миллилитров раствора щавелевой кислоты, содержащего 7% Н2С204•2Н2О (ρ=1,02 г/см3), можно окислить в сернокислом растворе при действии 75 мл 0,08 н. раствора KMnО4?
50. После прохождения 1м3 воздуха через раствор Ва(ОН)2 образовалось 2,64 г ВаСО3. Вычислить процентное содержание СО2 в воздухе.
51. Сколько цианида натрия получится при сплавлении с углем и содой 1т технического цианамида кальция, содержащего 64% СаСN2?
52. Вычислить объемы (0°С и 101,3 кПа) СО2 и аммиака, требуемые для получения 0,6 т мочевины.
53. Вычислить процентное содержание углерода, азота и водорода в веществе, если при сжигании 0,18 г его было получено: 0,132 г СО2, 0,108 г Н2О и выделилось в свободном состоянии 67,2 мл азота (0°С и 101,3 кПа).
54. Сколько кремния (кг) и какой объем 32% -ного раствора NаОН (ρ = 1,35 г/см3) потребуется для получения 15м3 водорода (17°С и 98,64 кПа)?
55. Состав стекла выражается формулой Nа2О•СаО•6SiO2. Вычислить теоретический расход сырья — соды, известняка и кремнезема—на 1т стекла.
56. Предельная растворимость NH4Cl и NaNО2 при 20°С составляет соответственно 37,2 и 84,5. Сколько граммов насыщенного раствора одной и другой соли требуется для получения 24 л азота (20°С и 101,3 кПа) при нагревании смеси растворов?
57. Технический цианамид кальция содержит 19,6% азота. Вычислить процентное содержание СаСN2 в техническом продукте.
58. Какой объем азота (0°С и 101,3 кПа) и сколько килограммов карбида кальция необходимо для получения 1т технического цианамида кальция, содержащего 60% СаСN2?
59. Сколько граммов Mg3N2 подверглось разложению водой, если для солеобразования с продуктами гидролиза потребовалось 150мл 4%-ного раствора НС1 (ρ=1,02 г/см3)?
60. Вычислить объемы водорода и азота (0°С и 101,3 кПа), теоретически необходимые для получения: а) 1л аммиака (0°С и 101.3 кПа); б) 1л 35%-ного водного раствора NH3 (ρ = 0,882 г/см3).
61. Сколько килограммов 60%-ного раствора НNО3 может быть получено из 1 м3 аммиака (0°С и 101,3 кПа) при отсутствии потерь азота?
62. Какой объем газовой смеси (0°С и 101,3 кПа), содержащей 11% NН3, необходим для получения 1т азотной кислоты при отсутствии потерь N2?
63. Сколько тонн цианамида кальция можно получить из 3600 м3 азота (27° С и 101,3 кПа) при взаимодействии его с карбидом кальция, если потери азота составляют 40%?
64. Какой объем, воздуха (21% О2) теоретически необходим для окисления в NO 100 м3 NH3? Какой объем NO получится при тех же условиях?
65. Завод вырабатывает в сутки 120 т нитрата аммония. Какова ежесуточная потребность завода в аммиаке (в м3, при 0°С и 101,3 кПа) и 60%-ной азотной кислоте (в т)?
66. На тонну сульфата аммония практически расходуется 0,97т 78%-ной серной кислоты и 0,27т аммиака. Вычислить выход сульфата аммония по отношению: а) к расходуемой кислоте; б) к расходуемому аммиаку.
67. Каким объемом 20%-ного раствора NH4Cl (р= 1,06 г/см3) можно заменить 1 л 14%-ного раствора (NH4)2SО4 (р = 1,08 г/см3) для получения равных количеств аммиака при действии КОН на растворы этих солей?
68. Сколько процентов азота содержится в продукте, полученном смешением: а) равных масс сульфата и нитрата аммония; б) равного числа молей тех же солей?
69. Сколько килограммов раствора аммиака с содержанием 20% NН3 получается при коксовании 1т угля, содержащего 1% азота, если 20% последнего образует аммиак?
70. Сколько тонн нитрата аммония следует смешать с 1т сульфата аммония для получения удобрения, содержащего 30% азота?
71. Вычислить концентрацию NH4+ (в моль/л) в растворе сульфата аммония, если при окислении 50 мл его раствора гипобромитом натрия в щелочной среде образовалось 56 мл N2 (0°С и 101,3 кПа).
72. Константа диссоциации [NН3ОН]ОН равна 210-8. Вычислить константу и степень гидролиза [NН3ОН]Cl в 0,2 М растворе соли. Каков рН раствора?
73. рН 0,1 М раствора азида натрия составляет 8,85. Вычислить концентрацию ионов ОН-, константу и степень гидролиза соли в растворе и константу диссоциации НN3.
74. Сколько граммов меди можно перевести в раствор при действии
60 мл 33%-ного раствора азотной кислоты (ρ = 1,2 г/см3)? Какой объем NO (0°С и 101,3 кПа) выделится при этом?
75. Какой объем 4 н. КОН потребуется для поглощения 23 г NО2, если при этом образуется нитрат и нитрит калия?
76. При 27°С устанавливается состояние равновесия в системе:
2NО2 → N2О4. 1 г вещества при указанной температуре и 101,3 кПа занял объем, равный 0,321 л. Вычислить, какая доля вещества находится в виде простейших молекул и какая в виде молекул N2О4.
77. Сколько граммов йода и сколько миллилитров 36%-ного раствора НNO3 (ρ = 1,22 г/см3) следует взять для получения 1л 21%-ного раствора НIO3 (ρ=1,21 г/см3)? Какой объем NO (0°С и 101,3 кПа) образуется?
78. Сколько граммов KNО2 потребуется для выделения всего йода из 10 мл 15%-ного раствора КI (ρ = 1,12 г/см3), подкисленного разбавленной Н2SО4?
79. Сколько миллилитров 0,05М раствора KMnO4, потребуется для окисления в сернокислом растворе 25мл 0,1 М раствора KNО2?
80. Вычислить расход фосфорита с содержанием 40% P2О5, кремнезема и кокса, необходимых для получения 1т фосфора, если выход готового продукта составляет 80% от теоретически возможного. Побочные продукты реакции СО и СаSiO3.
81. При температуре 800°С плотность паров фосфора по отношению к воздуху составляет 4,27, а при 1500°С она уменьшается в два раза. Какова атомность молекулы фосфора в обоих случаях? Какой процесс происходит в интервале указанных температур?
82. Какое количество теплоты выделится при превращении 1т белого фосфора в красный, если теплота перехода составляет 16,73 кДж/моль?
83. Вычислить процентное содержание Р2О5 во фторапатите, состав которого выражен формулой 3Са3(РО4)2•СаF2.
84. В каком соотношении следует смешать массы моноаммоний фосфата и диаммонийфосфата, чтобы получить продукт с содержанием 59,7% P2O5? Каково процентное содержание азота в указанном продукте?
85. Метаарсенит кальция получается растворением As2О3 в известковом молоке. Вычислить расход сырья - извести и оксида мышьяка(III) As2О3, необходимого для получения 1т готового продукта.
86. Сколько граммов хлората калия, содержащего 4% посторонних примесей, следует взять для получения 25л кислорода при 37°С и 101,ЗкПа?
87. Определите объем (л, н.у.) газа, который образуется при взаимодействии избытка пероксида водорода в кислой среде с перманганат - ионами, содержащимися в 100 мл 0,45 М раствора.
88. 10л озонированного кислорода (0°С и 101,3 кПа), будучи пропущены через раствор KI, выделили 2,54 г йода. Вычислить процентное содержание озона в озонированном кислороде. Какой объем занял бы весь газ после полного разложения содержащегося в нем озона и превращения его в кислород?
89. 750 мл озонированного кислорода (0°С и 101,3 кПа) образовали после разложения содержащегося в нем озона 780 мл кислорода. Сколько граммов йода выделится из раствора KI при прохождении через него 1л исходного озонированного кислорода?
90. В каком объеме воздуха (21% О2), измеренном при 0°С и 101,3 кПа, содержится 1т кислорода?
91. Исходя из теплового эффекта реакции 2О3 = ЗО2; ∆Н° = - 288,4 кДж
и теплоты образования воды (∆Н°298,обрН2О = - 241,6 кДж) вычислить тепловой эффект реакции H2 + 1/З О3 = H2O.
92. Определите значение объемной доли (%) сероводорода в техническом газе, если 5 л (н. у.) этого газа затрачено на реакцию с 0,048 моль дихромата калия в кислой среде (остальные компоненты газа в реакцию не вступают).
93. В равновесной системе: 2H2 + O2 = 2H2O содержится 90% не разложенных молекул Н2О. Вычислить плотность этой системы по отношению к воздуху при той же температуре.
94. Какой объем озона следует добавить к 1л воздуха, чтобы получить газовую смесь, плотность которой равна плотности кислорода при той же температуре?
95. После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона энтальпия образования ∆Н°298, О3 = 144,2 кДж/моль?
96. После прохождения воздуха через озонатор плотность его повысилась на 5%. Сколько процентов озона содержится в таком озонированном воздухе?
97. Сколько килограммов ВаО2 и 20%-ного раствора Н2SО4 требуется для получения 120кг 30%-ного раствора пероксида водорода?
98. Какой объем озонированного кислорода (0оС и 101,ЗкПа), содержащего 10% озона (по объему), требуется для взаимодействий со 100 г 3,4%-ного раствора Н2О2 по реакции H2O2 + O3 → H2O + 2O2?
Какой объем кислорода при этом образуется?
99. 0,8 г раствора перекиси водорода (Н2О2) выделили из подкисленного раствора KI 0,3 г йода. Вычислить процентное содержание Н2О2 в растворе.
100. Сколько граммов 3,4%-ного раствора Н2О2 требуется для окисления 100 мл 1 молярного раствора FeSO4 в присутствии Н2SO4?
101. Для полного обесцвечивания 20 мл 0,02 М раствора KMnO4 в сернокислой среде потребовался равный объем раствора Н2О2. Какова молярная концентрация раствора пероксида водорода? Какой объем кислорода (0°С и 101,3 кПа) выделился при этом?
102. Какое количество железных стружек следует сплавить с 1 кг природного серного колчедана, содержащего 80% FeS2 для перевода последнего в сульфид железа?
103. Какие объемы Н2S и SО2(при н.у.) должны прореагировать друг с другом, чтобы масса образовавшейся серы составила 100 кг?
104. Какой объем воздуха (21% О2, 0°С и 101,3 кПа) теоретически необходим для сгорания 1т серного колчедана? Вычислить массу образовавшегося Fe2О3 и объем диоксида серы при тех же условиях.
105. Теплоты образования FeS2, Fe2О3 и SО2 равны соответственно
- 148,5; - 803,3; - 297,4 кДж/моль. Вычислить теплотворную способность (в кДж/кг) серного колчедана, содержащего 20% пустой породы.
106. Какой объем печных газов (0°С и 101,3 кПа), содержащих 7% SО2, получается при обжиге 1т серного колчедана, содержащего 45% серы, если учесть, что при этом не сгорает 1,6% всего содержания серы?
107. Какова ежесуточная потребность в воздухе (21%О2, при 0°С и 101,3 кПа) колчеданной печи, сжигающей в сутки 12т колчедана, если при этом воздух берется в избытке и с таким расчетом, чтобы печные газы содержали 10,5% неизрасходованного кислорода?
108. Какой объем Н2S (7°С и 96кПа) следует пропустить через 400 мл 6%-ного раствора KMnO4, (р=1,04 г/см3), подкисленного серной кислотой, до полного восстановления KMnO4?
109. Сколько литров Н2S при 14°С и 98,6 кПа следует пропустить через 1,8л 0,1 н. раствора йода для полного восстановления йода?
110. 20,16 л воздуха, содержащего Н2S и практически не содержащего других восстановителей, оказалось достаточным, чтобы восстановить 7,5 мл 0,12 н. раствора йода. Вычислить процентное содержание Н2S в воздухе.
111. 560 мл Н2S (0°С и 101.3 кПа) оказалось достаточным для того, чтобы в сернокислом растворе восстановить 500 мл раствора K2Cr2O7. Какова нормальность этого раствора?
112. Серный колчедан дает в среднем 70% колчеданного огарка, содержащего 2% невыгоревшей серы. Сколько тонн H2SО4 теряет завод ежесуточно из-за неполного выгорания серы, если производственная мощность печей составляет 80 т колчедана в сутки?
113. Сколько миллилитров концентрированной серной кислоты (ρ=1,84 г/см3), содержащей 98% Н2SO4, теоретически необходимо для перевода в раствор 10 г меди? Какой объем SO2 (0°С и 101,ЗкПа) выделится при этом?
114. Сколько литров SО2 (0°С и 101,3 кПа) потребуется для восстановления в сернокислом растворе 100мл 5,7%-ного раствора K2Cr2O7 (ρ = 1,04 г/см3)?
115. Для восстановления 80 мл 0,02 М раствора KMnO4 оказалось достаточным пропустить через раствор 17,9 л газа (0°С н 101,3 кПа), содержащего SО2 и не содержащего других восстановителей. Вычислить процентное содержание SО2 в газе.
116. Вычислить процентное содержание Н2SO3 в растворе, содержащем 10% SO2.
117. При 0°С и 101,3 кПа 1 объем воды поглощает 79,8 объема SО2. Вычислить процентное содержание SО2 и Н2SO3 в полученном растворе.
118. Сколько граммов насыщенного раствора бромной воды (3.6 г брома в 100 г воды) требуется для окисления 10 г насыщенного раствора Н2SО3 (см. условие задачи 117)?
119. Вычислить процентное содержание безводной соли в растворе, содержащем 46% Na2S2O3•5Н2О.
120. Сколько миллилитров раствора (ρ = 1,04 г/см3) сернистой кислоты, содержащего 7,5% SO2, можно окислить прибавлением 25 мл 6% -ного раствора KClO3 (ρ = 1,04 г/см3)?
121. Сколько миллилитров 0,2М раствора K2Cr2O7 потребуется для окисления в сернокислом растворе 50 мл раствора (ρ = 1,022 г/см3) сернистой кислоты, содержащей 4% SО2?
122. 1,6 л газа (0°С и 101,3 кПа), содержащего SO2, при отсутствии других восстановителей окисляется при действии 100 мл 0,1н. раствора йода. Вычислить процентное содержание SО2 в газе.
123. Вследствие неполноты окисления SO2 в SО3 газы, выходящие из контактных аппаратов, содержат в среднем 0,5% SО2. Какой объем газов (0°С и 101,3 кПа) и какой объем 32%-ного раствора NaОН (ρ = 1,35 г/см3) необходимы для получения: а) 1т Na2SO3 7H2O; б) 1т NaHSO3?
124. При производстве NaHSO3 по сульфатно-известковому методу насыщают диоксидом серы раствор Na2SO4, в котором суспендирован известняк СаСO3; при этом сначала диоксид серы разлагает известняк с образованием Са(НSО3)2, а последний, вступая в обменное разложение с Na2SO4, образует малорастворимый гипс СаSО4•2Н2О. Вывести суммарное уравнение реакции и вычислить количество известняка, сульфата натрия и объем газа, содержащего 7% SО2, необходимые для получения 5,2 т NaHSO3. Какое количество гипса получится при этом?
125. При получении Na2S2О4 водная суспензия цинковой пыли обрабатывается диоксидом серы, после чего образовавшийся при этом Zn2S2О4 обменным разложением с содой дает малорастворимый карбонат цинка, а в растворе остается Na2S2О4. Вычислить количество цинковой пыли, объем SО2 (0°С и 101,3 кПа) и объем 22,5%-ого раствора Na2СО3
(ρ =1,24 г/см3), необходимые для получения 0,87т готового продукта.
126. Сколько граммов Na2S2О3•5Н2О способно вступить в реакцию с 250 мл 0.2 н. йода, если известно, что продуктами реакции являются тетратионат Na2S4О6 и иодид натрия?
127. Сколько литров 26%-ного раствора Н2S04 (ρ = 1,19 г/см3) можно получить из 1кг пиросерной кислоты?
128. Вычислить общее процентное содержание SО3 в олеуме, содержащем 20% свободного SО3. Сколько килограммов моногидрата можно получить из 1т олеума?
129. Вычислить процентное содержание свободного SО3 в олеуме, в котором общее содержание SО3 составляет 90,81%,
130. Для солеобразования с 1,2 г олеума потребовалось 50 мл 0,5 н. KОН. Вычислить общее процентное содержание SО3 в олеуме и процентное содержание свободного SО3.
131. Для получения 1т олеума с 20%-ным содержанием свободного SО3 в контактный аппарат подают 3500 м3 газа (0оС и 101,3 кПа), содержащего 7% SО2. Каков коэффициент использования SО2 в контактном аппарате?
132. Сколько граммов хлорсульфоновой кислоты вступило в реакцию с водой, если для нейтрализации продуктов гидролиза израсходовано 25 мл 1,2 н. NaОН?
133. Сколько миллилитров 2н. KOH потребуется для нейтрализации продуктов гидролиза 2,7 г диоксодихлорида серы?
134. Для получения Na2Cr2О7•2Н2О поступают следующим образом. Сначала получают плав, содержащий хромат натрия, подвергая окислительной плавке с участием кислорода воздуха смесь хромита железа Fe(CrО2)2 и соды. Побочными продуктами этой реакции являются Fe2О3 и СО2. Хромат натрия Na2CrO4 извлекается из плава, и полученный раствор обрабатывается серной кислотой. Вычислить расход сырья — 45%-ного хромита железа, соды и кислоты — на 1т готового продукта, учитывая, что расход хромита на 15%, а расход соды и кислоты на 50% больше теоретического.
135. Триоксид хрома получают разложениемNa2Cr2O7 концентрированной серной кислотой; побочный продукт реакции NaHSO4. Каков выход продукта, если для получения 1т его расходуется 1,85 т Na2Cr2O7•2Н2О?
136. Морская вода содержит в среднем 3,5% различных солей, из которых около 80% приходится на долю NaCl. В каком количестве воды содержится 1т NaCl?
137. Солевая масса, полученная из вод Балтийского моря, содержит в среднем 84,7% NaCl и 9,7% MgCl2. Сколько тонн солевой массы следует подвергнуть переработке для получения 1 т хлора?
138. В морской воде содержится в среднем 4•10-30% брома. Из какого количества морской воды можно получить 100 кг брома?
139. Зола водорослей содержит в среднем 0,3% йода. Сколько тонн золы следует подвергнуть переработке для получения 12 кг йода?
140. Сколько кубических метров хлора (0°С и 101,3 кПа) можно получить из 1м3 раствора (ρ= 1,23 г/см3), содержащего 20,7% NaCl и 4,3% MgCl2?
141.Какое количество электричества (в А•ч) потребуется для получения 1т КОН при электролизе КС1, если выход по току составляет 0,955? Какие объемы водорода и хлора (при н.у.) выделяются при этом на электродах?
142. При электролизе хлорида натрия током в 1050 А в течение суток выделилось 30,5 кг хлора. Вычислить выход по току.
143. Фтор получают электролизом раствора KF в безводной плавиковой кислоте. Какова суточная производительность в м3 (при 0°С и 101,3 кПа) электролитической ванны, работающей при нагрузке 1200 А с коэффициентом использования тока 96%?
144. Какой объем хлора (при 17°С и 99,3 кПа) выделится при взаимодействии соляной кислоты с 1 кг MnO2?
145. Сколько миллилитров концентрированной соляной кислоты, содержащей 39% HCl (ρ=1,2 г/см3), теоретически необходимо для взаимодействия с 0,1 моль KMnO4? Какой объем хлора выделится при этом (0°С и 101,3 кПа)?
146. Какой объем хлора (27°С и 104 кПа) и какой объем 40%-ного раствора KBr (ρ =1,37 г/см3) потребуется для получения 1кг брома?
147. Сколько граммов йода выделится в сернокислом растворе при взаимодействии раствора KI со 150 мл 6%-ного раствора KMnO4
(ρ =1,04 г/см3)?
148. Какой объем хлора (0°С и 104 кПа) требуется для взаимодействия с 10л 3,75%-ного раствора Ва(ОН)2 (ρ = 1,04 г/см3)?
149. Сколько миллилитров 6,8%-ного раствора KClO3 (ρ = 1,04 г/см3) следует взять для того, чтобы в сернокислом растворе окислить 250 мл 21%-ного раствора FeSO4 (ρ =1,22 г/см3)?
150. Выделение йода из раствора, полученного после выщелачивания золы морских водорослей, производится путем добавления диоксида марганца и серной кислоты. Сколько тонн раствора, содержащего 4,5% KI, и сколько килограммов MnО2 требуется для получения 1т йода?
151. Сколько кубических метров (0°С и 101,3 кПа) технического водорода, содержащего 96% Н2, и сколько тонн технического хлора, содержащего 92% (по массе) Cl2, расходуется на образование 1т хлорида водорода, учитывая, что для полного использования ценного хлора объем водорода берется на 10% больше теоретического?
152. При взаимодействии брома с раствором соды при нагревании образуются NaBr и NaBrO3. Сколько килограммов брома пойдет на взаимодействие с 1м3 14%-ного раствора Na2СО3 (ρ =1,15 г/см3)? Какой объем СО2 (0oС и 101,3 кПа) выделится при этом?
153. В заводских условиях для удобства хранения и транспортировки брома его улавливают железными стружками, с которыми он образует Fe3Br8 (2FeBr3+ FeBr2). Какое количество железных стружек расходуется на заводе, перерабатывающем в сутки 750 т сильвинита с содержанием 0,03% брома, и какое количество Fe3Br8 образуется при этом?
154. Сколько килограммов 39%-ного раствора HCl можно получить из 1т технической поваренной соли, содержащей 8% посторонних, не содержащих хлора примесей? Сколько литров 98%-ной серной кислоты
(ρ = 1,84 г/см3) потребуется для взаимодействия с этим количеством соли?
155. Какова продолжительность электролитического окисления 1т 70%-ного раствора NaClO3 в NaClО4, если сила тока 12000А, а коэффициент использования тока 96%?
156. Сколько кубических метров хлора (0°С и 101,ЗкПа) требуется пропустить через 1м3 59%-ного раствора KI (р=1,71 г/см3) для выделения из раствора всего йода? Какой объем хлора потребуется дополнительно пропустить для окисления выделившегося йода в HIO3?
157. Вычислить нормальность раствора НС1, если 40 мл раствора после прибавления AgNO3 образовали 0,574 г AgCl.
158. Сколько граммов K2Cr2О7 и сколько миллилитров 39%-ного раствора HCl (ρ = 1,2 г/см3) следует взять, чтобы с помощью выделившегося хлора окислить 0,1 моль FeCl2 в FeCl3?
159. Вычислить процентное содержание KIО3 в растворе, если 3,21 г раствора, реагируя с избытком KI в разбавленном сернокислом растворе, образует 0,635г йода.
160. Сколько граммов 20%-ного раствора NaHSО3 потребуется для выделения всего йода из 1,6 л 0,4 М раствора NaIO3? При реакции образуются NaHSO4 и Na2SО4.
161. В 100 г Н2О при 20оС растворяется 3,6 г брома. Сколько граммов бромной воды потребуется для окисления 7,6 г FeSO4 в сернокислом растворе?
162. Сколько килограммов плавикового шпата, содержащего 97,5% CaF2, и сколько литров 98%-ной H2SO4 (ρ =1,84 г/см3) потребуется для получения 1кг HF?
163. Раствор HIO3 содержит 65% I2О5. Вычислить процентное содержание HIO3 в растворе.
164. Сколько миллилитров 5%-ного раствора HIO3 (ρ = 1,02 г/см3) потребуется для окисления 40 мл 8%-ного раствора HI (ρ =1,06 г/см3)? Сколько граммов йода образуется при этом?
165. Сколько миллилитров 6%-ного раствора KBrO3 (ρ =1,04 г/см3) потребуется для окисления в сернокислом растворе 50 мл 0,75 М раствора FeSO4?
166. Сколько граммов KI можно окислить в KIO3 электрическим током силой 13,4А за 2 ч?
167. При изготовлении KClO3 вначале, действуя хлором на известковое молоко Са(ОН)2, получают Са(С1О3)2; обменной реакцией с KCl его переводят в KClO3. Вычислить в тоннах расход хлора, негашеной извести и KCl, необходимый для получения 1т KClO3, учитывая при этом, что выход продукта составляет 80% от теоретически вычисленного.
168. Какое количество K2MnО4 получится из 100 кг пиролюзита с содержанием 87% MnO2, если выход K2MnO4 составляет 60% теоретического? Сколько часов следует пропускать ток в 1000 А для окисления полученного количества K2MnO4 в KMnO4?
169. Сколько граммов FeSО4•7Н20 можно окислить в сернокислом растворе при действии 40мл 0,12 н. раствора KMnO4?
170. Какой объем хлора (0°С и 101,3кПа) требуется для окисления 1т 24%-ного раствора K4[Fe(CN)6].
171. Какие объемы 39%-ного раствора HCl (ρ = 1,19 г/см3) и 75%-ной азотной кислоты (ρ = 1,44 г/см3) теоретически необходимы для перевода 100 г платины в платинохлористоводородную кислоту, если исходить из предположения, что продуктом восстановления азотной кислоты является эквимолярная смесь NO и NO2? Какова масса образовавшейся комплексной кислоты H2[PtCl6] 6H2O?
Варианты домашнего задания по теме
«Основные законы химии. Расчеты по уравнениям реакций»
Номер варианта |
Задача 1 |
Задача 2 |
Задача 3 |
Задача 4 |
Задача 5 |
Задача 6 |
1 |
1 |
31 |
61 |
91 |
121 |
151 |
2 |
2 |
32 |
62 |
92 |
122 |
152 |
3 |
3 |
33 |
63 |
93 |
123 |
153 |
4 |
4 |
34 |
64 |
94 |
124 |
154 |
5 |
5 |
35 |
65 |
95 |
125 |
155 |
6 |
6 |
36 |
66 |
96 |
126 |
156 |
7 |
7 |
37 |
67 |
97 |
127 |
157 |
8 |
8 |
38 |
68 |
98 |
128 |
158 |
9 |
9 |
39 |
69 |
99 |
129 |
159 |
10 |
10 |
40 |
70 |
100 |
130 |
160 |
11 |
11 |
41 |
71 |
101 |
131 |
161 |
12 |
12 |
42 |
72 |
102 |
132 |
162 |
13 |
13 |
43 |
73 |
103 |
133 |
163 |
14 |
14 |
44 |
74 |
104 |
134 |
164 |
15 |
15 |
45 |
75 |
105 |
135 |
165 |
16 |
16 |
46 |
76 |
106 |
136 |
166 |
17 |
17 |
47 |
77 |
107 |
137 |
167 |
18 |
18 |
48 |
78 |
108 |
138 |
168 |
19 |
19 |
49 |
79 |
109 |
139 |
169 |
20 |
20 |
50 |
80 |
110 |
140 |
170 |
21 |
21 |
51 |
81 |
111 |
141 |
171 |
22 |
22 |
52 |
82 |
112 |
142 |
151 |
23 |
23 |
53 |
83 |
113 |
143 |
152 |
24 |
24 |
54 |
84 |
114 |
144 |
153 |
25 |
25 |
55 |
85 |
115 |
145 |
154 |
26 |
26 |
56 |
86 |
116 |
146 |
155 |
27 |
27 |
57 |
87 |
117 |
147 |
156 |
28 |
28 |
58 |
88 |
118 |
148 |
157 |
29 |
29 |
59 |
89 |
119 |
149 |
163 |
30 |
30 |
60 |
90 |
120 |
150 |
168 |
ПРИЛОЖЕНИЕ
Таблица 1
Константы диссоциации некоторых кислот и оснований при 25оС
Соединения |
Формула |
К1 |
К2 |
К3 |
|
Кислоты |
|||||
Метаалюминиевая |
HAlO2 |
6∙10-13 |
– |
– |
|
Азотистая |
HNO2 |
5,1∙10-4 |
– |
– |
|
Бромноватистая |
HBrO |
2,5∙10-9 |
– |
– |
|
Метакремниевая |
H2SiO3 |
2,2∙10-10 |
1,6∙10-12 |
- |
|
Муравьиная |
HCOOH |
1,8∙10-4 |
– |
- |
|
Селенистая |
H2SeO3 |
2,4∙10-3 |
4,8∙10-9 |
- |
|
Селеноводородная |
H2Se |
1,3∙10-1 |
1∙10-11 |
- |
|
Сернистая |
H2SO3 |
1,7∙10-2 |
6,2∙10-8 |
- |
|
Сероводородная |
H2S |
1,0∙10-7 |
1∙10-14 |
- |
|
Синильная |
HCN |
6,2∙10-10 |
– |
- |
|
Теллуроводородная |
H2Te |
2,3∙10-3 |
1∙10-11 |
- |
|
Угольная |
H2CO3 |
4,5∙10-7 |
4,8∙10-11 |
- |
|
Уксусная |
CH3COOH |
1,75∙10-5 |
– |
- |
|
Орто-фосфорная |
H3PO4 |
7,6∙10-3 |
6,2∙10-8 |
4,2∙10-13 |
|
Фтороводородная |
HF |
6,8∙10-4 |
– |
- |
|
Хлорноватистая |
HClO |
5,0∙10-8 |
– |
- |
|
Основания и амфотерные гидроксиды |
|||||
Гидроксид алюминия |
Al(OH)3 |
– |
– |
1,38∙10-9 |
|
Гидроксид аммония |
NH4OH |
1,79∙10-5 |
– |
– |
|
Гидроксид галлия |
Ga(OH)3 |
– |
1,6∙10-11 |
4∙10-12 |
|
Гидроксид железа (II) |
Fe(OH)2 |
– |
1,3∙10-4 |
– |
|
Гидроксид железа (III) |
Fe(OH)3 |
– |
1,8∙10-11 |
1,3∙10-12 |
|
Гидроксид кадмия |
Cd(OH)2 |
– |
5∙10-3 |
– |
|
Гидроксид кобальта (II) |
Co(OH)2 |
– |
4∙10-5 |
– |
|
Гидроксид лития |
LiOH |
6,7∙10-1 |
– |
– |
|
Гидроксид магния |
Mg(OH)2 |
– |
2,5∙10-3 |
– |
|
Гидроксид марганца (II) |
Mn(OH)2 |
– |
5∙10-4 |
– |
|
Гидроксид меди (II) |
Cu(OH)2 |
– |
3,4∙10-7 |
– |
|
Гидроксид никеля (II) |
Ni(OH)2 |
– |
2,5∙10-5 |
– |
|
Гидроксид свинца (II) |
Pb(OH)2 |
9,6∙10-4 |
3∙10-8 |
– |
|
Гидроксид серебра |
AgOH |
1,1∙10-4 |
– |
– |
|
Гидроксид хрома (III) |
Cr(OH)3 |
– |
– |
1∙10-10 |
|
Гидроксид цинка |
Zn(OH)2 |
4,4∙10-5 |
1,5∙10-9 |
– |
|
Таблица 2
