
1) Кратність – одинарні, подвійні, потрійні зв’язки;
Направленість, що визначає просторову структуру молекул, або їх форму. А просторова структура в свою чергу характеризується валентним кутом.
Ще одною характеристикою ковалентного зв’язку є насиченість.
Під насиченістю ковалентного зв’язку розуміють повне використання валентних електронів. Наприклад, до молекули Н2 не можна приєднати ще один атом Гідрогену. Тому, що спін електрона цього атому буде паралельним з електроном, що утворив зв’язок в молекулі Н2, а принцип Паулі це забороняє.
Крім всіх перелічених характеристик ковалентного зв’язку, він ще буває полярним та неполярним.
Неполярний зв’язок – це ковалентний зв’язок між атомами з однаковою електронегативністю: при цьому область перетинання електронних хмар знаходиться на однаковій відстані від ядер обох атомів.
Неполярний ковалентний зв’язок відбувається в молекулах H2, O2, N2, Cl2, F2 тощо.
Полярний ковалентний зв’язок – це зв’язок між атомами з різною електронегативністю , в цьому випадку область перетинання електронних хмар зміщена в сторону атома з більшою електронегативністю.
Розглянемо
утворення зв’язку в молекулі хлороводню:
![]() δ-
зв’язок
δ-
зв’язок
Чим більша різниця електронегативності, тим більша полярність зв’язку.
Полярні молекули є діполями.
Діполь – це система, в якій центри позивного та негативного зарядів розташовані на значній відстані один від одного. Ця відстань називається довжиною діполя.
l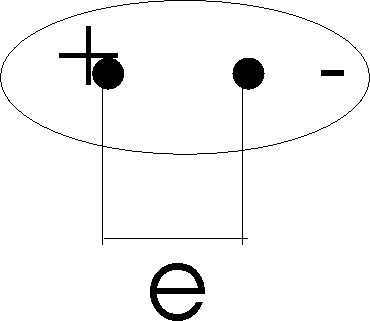
Кількісною характеристикою полярності зв’язку є діпольний момент μ (векторна величина)
μ= δ·l
δ – величина часткового заряду
l – довжина діполя
Діпольний момент молекули дорівнює ∑ діпольних моментів всіх зв’язків в цій молекулі.
Поки що ми з вами розглянули утворення ковалентних зв’язків за обмінним механізмом. Але є ще один механізм.
Механізм утворення ковалентних зв’язків за рахунок електронної пари одного атома та вільної орбіталі іншого називається донорно – акцепторним.
Атом , що надає електрони називається донором, а атом, що дає вільну орбіталь – акцептором.
Розглянемо цей механізм на прикладі утворення іону амонію:
йон амонію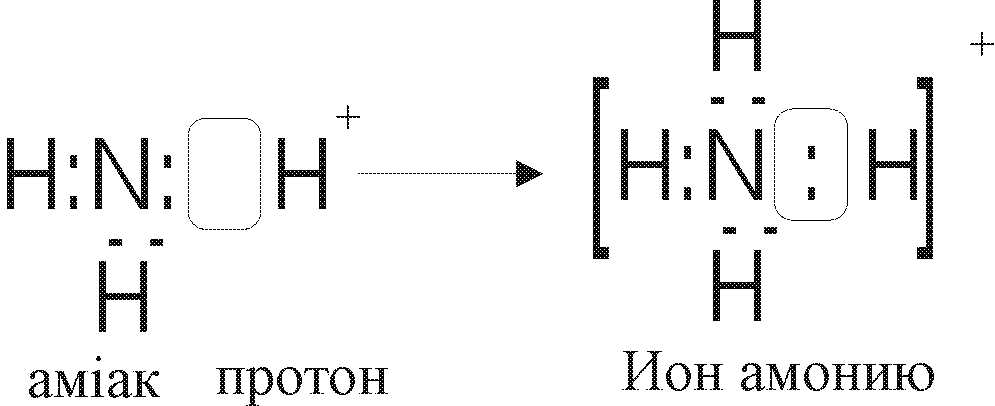



Цей зв’язок утворений теж парою електронів двохелектронної орбіталі одного з атомів та вільної орбіталі іншого атома.
Поки що ми з вами розглядали прості молекули і зв’язки, які в них утворюються. А як же будуть утворюватись хімічні зв’язки в молекулах, які містять 3 чи більше атомів. Розглянемо молекулу BeCl2.
Be 1s22s22p0- звичайний стан, але в цьому випадку всі електрони парні і невідомо, як утворюють два зв’язки з хлором. Під впливом хлору електрон Be переходить з s – p – орбіталь і Be в збудженому стані має таку електронну конфігурацію:
*Be 1s22s12p1. Тепер він має 2 непарні електрони, які приймають участь в утворенні зв’язків. Таким чином утворюють зв’язок між s –електроном Be та р – електроном Cl – в одному випадку. та p –електроном Be і p – електроном Cl в другому. Як ви думаєте довжина цих зв’язків буде однаковою чи різною? Зв’язки будуть однакові за довжиною і це пояснюється поняттям гібридизованих орбіталей .
В багатьох молекулах, особливо в молекулах органічних сполук, деякі атомні орбіталі, що приймають участь в утворенні ковалентних зв’язків, змішуються між собою, тобто вирівнюються, утворюючи таким чином гібридні атомні орбіталі. В період гібридизації початкова форма та енергія орбіталей взаємозамінюється, утворюючи орбіталі нової, вже однакової форми і енергії.
2
3
1800 лінійна
о
109,70 тетраедрична


Геометрична форма молекул визначається гібридизацією.
Тепер ми розглянули всі характеристики ковалентного зв’язку:
1. довжина |
4. направленість |
7. валентний кут |
2. енергія |
5. насиченість |
8. гібридизація |
3. кратність |
6. полярність |
|
Перейдемо до другого типу хімічного зв’язку – іонного (Me - HeMe)
Атоми можуть витрачати або здобувати електрони, утворюючи іони. Якщо атоми втрачають електрони, вони перетворюються на катіони, а якщо здобувають – на аніони. Аніони і катіони з заповненим зовнішнім рівнем мають стійку електронну конфігурацію: Na+, Cl-.
Хімічний зв’язок, що утворюється за рахунок електростатичного притягання між іонами з протилежними зарядами називається електровалентним, або іонним.
Іонний зв’язок утворюється за рахунок переносу електронів від одного атома до другого. Цей механізм дув предложений Косселем в 1916 р.
Найбільш типові іонні сполуки – це сполуки між металами І ІІ гр. та неметалами VI, VII гр. При зближенні елементів в періодах іонний характер зв’язку зменшується, а ковалентний – збільшується.
Більшість іонних сполук стійки в твердому стані. Це пояснюється наявністю в них кристалічної ґратки. В вузлах такої кристалічної ґратки послідовно розташовані позитивні і негативні іони. Молекули відсутні а кристал – це ніби –то гігантська молекула, яка складається з іонів.
Ці зв’язки, на відміну від ковалентних не мають направленості та насиченості.
Ненаправленість іонного зв’язку визначається тим, що кожен іон (заряджений шарик) може притягати іон протилежного знаку в любих напрямках. Взаємодія іонів веде до компенсації силових полів, в них залишається здібність притягувати іони протилежного знаку в інших напрямках, це каже про ненасиченість іонних зв’язків.
Але все ж таки природа ковалентних і іонних зв’язків однакова і єдина. Різниця лише в ступені поляризації загальних електронних пар, що можна поясніти різницею електронегативностей атомів.
Розглянути зв’язки F – Li, C – Cl, Cl – Cl.
Своєрідним хімічним зв’язком є водневий зв’язок.
Водневі зв’язки бувають міжмолекулярними та внутрішньо-молекулярні.
Міжмолекулярні хімічні зв’язки виникають між молекулами, до складу яких входить гідроген та дуже електронегативний елемент (F, O, N, Cl, S).
![]()


![]()
![]()


![]()
![]()
![]()
В таких молекулах загальна електронна пара від Гідрогену дуже зміщена до атому електронегативного елемента, а позитивний заряд його сконцентровано в дуже малому об’ємі. Тому такий протон взаємодіє з неподільною парою електронів другого атому чи іона. Таким чином, Гідроген утворює ще один зв’язок, більш слабкий, чим в самій молекулі. Але водневий зв’язок грає досить велику роль в поясненні властивостей багатьох сполук: наприклад, збільшення t0кип та зменшення t0замер для H2O.
Внутрішньомолекулярний водневий зв’язок має місце в органічних сполуках:
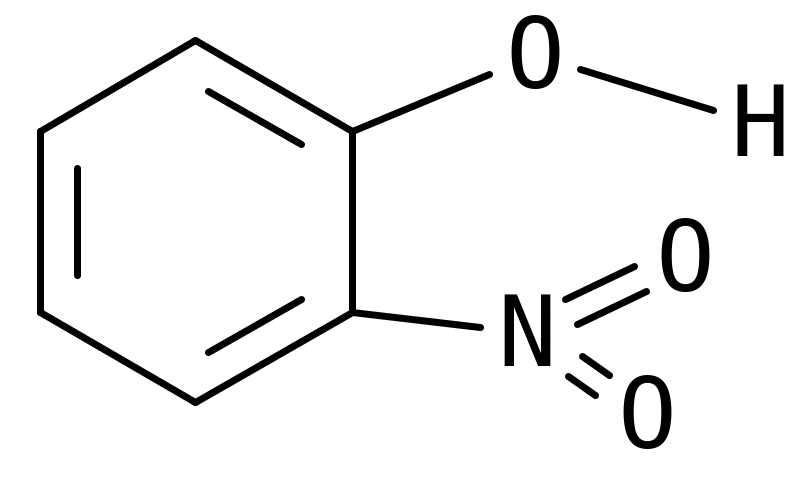
нітрофенол
Металевий зв’язок сходний з іонним по природі утворення – в вузлах кристалічної ґратки розташовані позитивні іони метала, що зв’язані між собою електронним газом.
Якщо розглянути електронегативність елементів ІІ періода, то від Li до F електронегативність змінюється на 0,5. У Li –1.
-
H2,1
Li
Be
B
C
N
O
F
1.0
1.5
2.0
2.5
3.0
3.5
4.0
Na
Mg
Al
Si
P
S
Cl
0.9
1.2
1.5
1.8
2.1
2.5
3
K
Ca
Ge
As
Se
Br
0.8
1.0
1.9
2.0
2.4
2.8
Зв`язок |
Різниця |
Тип зв`язку |
F – Li |
4,0-1,0=3,0 |
Іонний |
C – Cl |
3,0-2,5=0,5 |
Полярний ковалентний |
Cl –Cl |
3,0-3,0=0 |
Неполярний ковалентний |
Чим > ∆x, тим більший внесок іонного зв`язку, тобто більший ступінь іонності.
≈2,1=∆x – 50% іонний зв`язок
<2,1 – ковалентний полярний зв`язок
0 – чисто ковалентний зв`язок
