- •Гликопротеины
- •Способ присоединения углевода к белку Функцией гликопротеинов являются:
- •Протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков.
- •Строение гиалуроновой кислоты и хондроитинсульфата
- •Выделяют четыре основных класса липопротеинов:
- •Фосфопротеины - это, как правило, ферменты
- •Способ присоединения фосфата к белку на примере серина и тирозина Фосфорная кислота может выполнять:
- •Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии
- •Сравнение строения азотистого основания, нуклеозида и нуклеотида
- •Строение и функции рнк и днк
- •Гемопротеины: - гемоглобин
- •2. Магнийпорфирины: хлорофилл
- •3. Флавопротеины: ферменты, содержащие фад, фмн.
- •Замена аминокислоты на поверхности гемоглобина а
- •2. Изменения аминокислотного состава в области активного центра гемоглобина
Гемопротеины: - гемоглобин
- миоглобин
- цитохромы
2. Магнийпорфирины: хлорофилл
3. Флавопротеины: ферменты, содержащие фад, фмн.
и др.
Гемопротеины
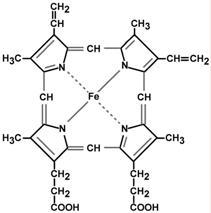
Строение гема |
Цитохромы
Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b, с, d. Все они неспособны связывать кислород, кроме цитохрома а3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления.
Флавопротеины
Являются ферментами окислительно-восстановительных реакций, содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
Миоглобин
- глобулярный белок,
- имеет только одну полипептидную цепь из 153 аминокислот,
- содержит небелковую часть (гем) и белковую часть (апомиоглобин).
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
Строение миоглобина
Гем - молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В теме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe2+, находящимся в центре молекулы.
Апомиоглобин - белковая часть во вторичной структуре уложены в 8 альфа-спиралей от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот.
Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), располагающихся в активном центре. Они расположены по разные стороны от плоскости тема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в теме может образовывать 6 координационных связей, 4 из которых удерживают Fe2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fe2+ и атомом азота имидазольного кольца Гис F8.
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда - О2 к миоглобину.

Аминокислотное окружение тема создаёт условия для довольно прочного, но обратимого связывания О2 с Fe2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe2+ в Fe3+. Трёхвалентное железо в составе тема не способно присоединять О2.
Гемоглобин
Молекула гемоглобина состоит из 4 полипептидных цепей (субъединиц), в каждой субъединице – гем; внутри каждого гема – один атом Fe.
В одном эритроците содержится около 340 млн молекул гемоглобина.
Функция – транспорт газов.
Кровь ежедневно должна переносить из лёгких в ткани около 600 л, О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма. С другой стороны, О2 - сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина - его способность регулировать сродство к О2 в зависимости от тканевых условий.
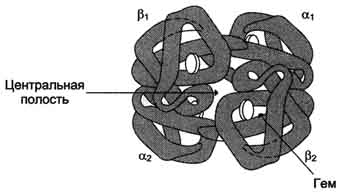
Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая альфа-цепь контактирует с двумя бета-цепями.
Так как в области контакта между альфа1- и бета1-, а также между альфа2- и бета2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры альфа1 бета1, и альфа2 бета2. Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга.
Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется "центральная полость", проходящая сквозь всю молекулу гемоглобина.
Изменение прложения Fe2+ и белковой части гемоглобина при присоединении О2.

Кооперативные изменения конформации протомеров гемоглобина при присоединении О2.

Четвёртая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула.
Изменение конформации (следовательно, и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации О2 для миоглобина и гемоглобина.
Отношение занятых О2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки О2 при различных значениях парциального давления кислорода.
Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы.
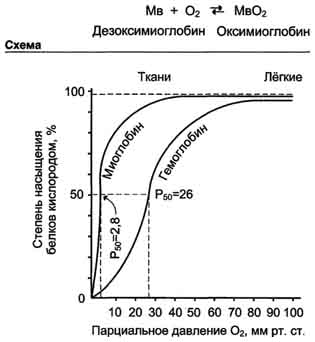
Миоглобин имеет очень высокое сродство к О2. Даже при парциальном давлении О2, равном 1-2 мм рт. ст., миоглобин остаётся связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина. Из графика видно, что гемоглобин имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около 26 мм рт. ст.).
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше О2 отдают протомеры, тем легче идёт отщепление последующих молекул О2.
В капиллярах покоящихся мышц, где давление О2 составляет около 40 мм рт. ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе давление О2 в капиллярах мышц падает до 10-20 мм рт. ст. Именно в этой области (от 10 до 40 мм рт. ст.) располагается "крутая часть" S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы протомеров.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин - присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин - присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2.
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. В эритроцитах под действием фермента карбангидразы:
СО2 + Н2О ------ H2CO 3 ------ H+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух бета-цепей, радикалам Гис122 и концевым альфа-аминогруппам двух альфа-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе
Hb (O2 )4 -------- Hb H+
приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора.
.

В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию Hb и удалению 6H+. Реакция СО2 + Н2О - Н2СО3 - Н+ + НСО3- сдвигается влево, и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.

Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым альфа-аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
Имеет сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух бета-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2

В нормальньж условиях 2,3-БФГ присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 бета-цепей и положительно заряженные альфа-аминогруппы N-концевого валина бета-цепей. В расширенную полость дезоксигемоглобина присоединяется БФГ.
Присоединение БФГ к дезоксигемоглобину происходит не в участке, , где происходит связывание О2. Такой лиганд называется "аллостерический", а центр, где связывается аллостерический лиганд, - "аллостерический центр" (от греч. "аллос" - другой, иной, "стерос" - пространственный).
В лёгких высокое парциальное давление О2 приводит к оксигенированию Hb. Разрыв ионных связей между димерами приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ. Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей.
Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
Гемоглобины человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, 2 альфа и 2 бета.
Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 альфа и 2 дельта-цепей.
Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гены, кодирующие альфа-цепи и сходные с ними дзэта-цепи, располагаются на 16-й хромосоме, а гены, кодирующие бета-цепи и сходные с ними гамма-, дельта- и эпсилон-цепи, - на 11-й хромосоме. В норме гемоглобины содержат две цепи из первой группы (альфа или дзэта) и две - из второй (бета, дельта, эпсилон или гамма).
Последовательная экспрессия различных генов глобина во время онтогенеза приводит к смене преобладающего типа гемоглобина.
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через 2 недели после оплодотворения. Представляет собой тетрамер: 2 дзета, 2 эпсилон. Через 6 нед., после формирования печени в ней начинает синтезироваться Hb F, который постепенно замещает эмбриональный гемоглобин.
Фетальный гемоглобин (Hb F) , синтезируется в печени и костном мозге плода до периода его рождения ( с 8 нед.). Имеет тетрамерную структуру, состоящую из 2 альфа- и 2 гамма-цепей. После рождения ребёнка постепенно замещается на Hb А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
В физиологических условиях HbF имеет более высокое сродство к О2, чем НbА, что создаёт оптимальные условия для транспорта О2 из крови матери в кровь плода. Это свойство HbF обусловлено тем, что он слабее, чем НЬА связывается с 2,3-БФГ. Связывание 2,3-БФГ с НЬА происходит при участии положительно заряженных радикалов аминокислот двух бета-цепей, некоторые из которых отсутствуют в первичной структуре гамма-цепей. В среде, лишённой 2,3-БФГ, НbА и HbF проявляют одинаковое высокое сродство к О2.
наследственные гемоглобинопатии
В аномальных гемоглобинах изменения могут затрагивать аминокислоты:
находящиеся на поверхности белка;
участвующие в формировании активного центра;
замена которых нарушает общую трёхмерную конформацию молекулы;
изменяющие четвертичную структуру белка и его регуляторные свойства.