
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ
Первое начало термодинамики утверждает, что при превращении одной формы энергии в другую полная энергия системы не изменяется, однако не указывает никаких ограничений относительно возможности этого процесса. Поэтому первое начало термодинамики позволяет рассчитать энергетический эффект процесса, однако не дает ответа на вопросы о том, будет ли процесс протекать самопроизвольно, о направлении и глубине протекания процесса.
Самопроизвольные процессы – процессы, которые протекают без вмешательства со стороны окружающей среды. Такие процессы сопровождаются уменьшением внутренней энергии системы и передачей энергии в окружающую среду в форме теплоты или работы, или, наоборот, увеличением внутренней энергии за счет теплоты или работы, полученной из окружающей среды. К самопроизвольным процессам относятся: переход теплоты от горячего тела к холодному, диффузия вещества из области большей концентрации в область меньшей концентрации, растекание одной жидкости по поверхности другой и т.д.
Несамопроизвольные процессы – процессы, которые сами собой совершаться не могут, протекающие за счет «вмешательства извне». Примерами таких процессов являются: переход теплоты от холодного тела к горячему, переход вещества из области с меньшей концентрации в область с большей концентрацией, выделение продуктов электролиза на электроде за счет затраты электрической работы извне и т.д. Не самопроизвольные процессы в изолированных системах невозможны. Различают обратимые и необратимые процессы.
Обратимые процессы – процессы, после протекания которых, и систему, и окружающую среду можно вернуть в первоначальное состояние. При этом в обратном процессе система проходит через те же промежуточные состояния, что и в прямом процессе, но в обратном порядке. В обратимом процессе все термодинамические функции принимают экстремальные значения. Например, работа, совершаемая в обратимом процессе, наибольшая, она называется максимально полезной работой. Обратимые процессы являются идеализацией реальных процессов. Экспериментально к ним можно приблизиться, но нельзя достигнуть.
Необратимые процессы – процессы, после протекания которых, систему и окружающую среду одновременно нельзя вернуть в прежнее состояние. При необратимом процессе систему можно вернуть в первоначальное состояние, но при этом в окружающей среде останутся некоторые изменения. К необратимым процессам относятся: механическое трение твердых поверхностей, потеря тепла в окружающую среду, электрическое сопротивление, переход вещества из области с высоким давлением в область с низким давлением и т.д. Необратимые самопроизвольные процессы протекают в направлении, которое приближает систему к состоянию равновесия.
Второе начало термодинамики. Энтропия Второе начало термодинамики является одним из наиболее общих законов природы, действие которого простирается на самые разные системы. Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса. Далее, второе начало термодинамики дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных задач прикладного характера. Как и первое начало, второе начало термодинамики является постулатом, все выводы, вытекающие из него, всегда находили подтверждение на опыте.
Формулировки второго начала термодинамики
никакая совокупность процессов не может сводиться к передаче теплоты от холодного тела к горячему, тогда как передача теплоты от горячего тела к холодному является единственным результатом процесса (формулировка Клаузиуса);
никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса (формулировка Томсона);
невозможно создание вечного двигателя второго рода (формулировка Оствальда). Под вечным двигателем второго рода понимают машину, которая производила бы работу только за счет поглощения теплоты из окружающей среды без передачи части тепла холодильнику.
На основе анализа работы идеальной тепловой машины Карно можно сделать следующий вывод, являющийся также одной из формулировок второго начала термодинамики:
любая форма энергии может полностью перейти в теплоту, но теплота преобразуется в другие формы энергии лишь частично.
Приведенные формулировки сводятся к тому, что протекание самопроизвольных процессов сопровождается рассеиванием тепла в окружающую среду. Для количественной характеристики рассеянной энергии в 1865 г. Клаузиус ввел новую функцию состояния «энтропия», которая является функцией теплоты процесса:
![]()
Физический смысл энтропии. Внутреннюю энергию изолированной системы рассматривают как сумму свободной и связанной энергий. Свободная энергия – это та часть внутренней энергии, которая способна превращаться в полезную работу. Связанная энергия – это та часть внутренней энергии, которая рассеивается в виде теплоты и никогда, ни при каких условиях не может превратиться в работу. Мерой связанной энергии является энтропия. Величина энтропии является критерием работоспособности изолированной системы: чем больше S, тем больше связанная энергия (TS), и меньше свободная энергия (так как их сумма – величина постоянная), тем меньше работоспособность системы. Энтропия характеризует интенсивность броуновского движения частиц и меру беспорядка в системе и возрастает при любых процессах, связанных с увеличением интенсивности движения частиц и хаотичности их расположения в пространстве (повышение температуры, смешение, испарение, плавление, диссоциация молекул и т.д.).
Статистическая
природа второго начала термодинамики
Физический
смысл энтропии объясняет и уравнение
Больцмана, в котором абсолютная энтропия
связана с термодинамической вероятностью
процесса:
![]() ,
где S –
абсолютная энтропия, k
– постоянная
Больцмана; ω
–
термодинамическая вероятность процесса
(число микросостояний, с помощью которых
осуществляется данное макросостояние).
Из этого уравнения следует, что: энтропия
является мерой термодинамической
вероятности процесса; энтропия является
мерой неупорядоченности (беспорядка)
в системе, поскольку, термодинамическая
вероятность тем выше, чем больше
беспорядка в системе. С точки зрения
статистической термодинамики второе
начало термодинамики можно сформулировать
следующим образом:
,
где S –
абсолютная энтропия, k
– постоянная
Больцмана; ω
–
термодинамическая вероятность процесса
(число микросостояний, с помощью которых
осуществляется данное макросостояние).
Из этого уравнения следует, что: энтропия
является мерой термодинамической
вероятности процесса; энтропия является
мерой неупорядоченности (беспорядка)
в системе, поскольку, термодинамическая
вероятность тем выше, чем больше
беспорядка в системе. С точки зрения
статистической термодинамики второе
начало термодинамики можно сформулировать
следующим образом:
Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Энтропия вещества в газообразном состоянии будет всегда больше энтропии этого же вещества в жидком состоянии, и больше, чем в твердом, например:
![]()
![]()
Энтропия данного количества вещества увеличивается по мере усложнения молекул, например:
![]()
Математическая запись второго начала термодинамики для обратимых процессов. Для обратимо протекающих процессов математическая запись второго начала термодинамики записывается в виде:
![]() ,
где
,
где
![]() - приведенная теплота.
- приведенная теплота.
Для
обратимых процессов в изолированной
системе энтропия является постоянной
величиной:
![]()
Таким образом, для обратимых процессов второе начало термодинамики выступает как закон о существовании и сохранении энтропии.
Энтропия – функция состояния системы, ее изменение не зависит от пути процесса, а зависит только от начального и конечного состояния системы.
Энтропия
– величина аддитивная.
Энтропия равновесной системы равна
сумме энтропий отдельных ее частей, а
изменение энтропии всей системы равно
сумме изменений энтропий ее частей.
Изменение энтропии в сложном процессе
равно сумме изменений энтропий в
отдельных стадиях процесса:
![]()
Математическая запись второго начала термодинамики для необратимых процессов. Для необратимо протекающих процессов следствием второго начала термодинамики являются неравенства:
![]() .
Так как теплота в необратимом процессе
меньше, чем в обратимом, то математическая
запись второго начала термодинамики
имеет вид:
.
Так как теплота в необратимом процессе
меньше, чем в обратимом, то математическая
запись второго начала термодинамики
имеет вид:
![]() .
Для необратимых самопроизвольных
процессов в изолированной системе:
.
Для необратимых самопроизвольных
процессов в изолированной системе:
![]() .
Таким образом, для необратимых процессов
второе начало термодинамики выступает
как закон о существовании и возрастании
энтропии. Для
обратимых и необратимых процессов
математическая запись второго начала
термодинамики имеет вид:
.
Таким образом, для необратимых процессов
второе начало термодинамики выступает
как закон о существовании и возрастании
энтропии. Для
обратимых и необратимых процессов
математическая запись второго начала
термодинамики имеет вид:
![]() или
или
![]() .
Знак равенства соответствует обратимым
процессам, знак неравенства – необратимым.
Для изолированных систем:
.
Знак равенства соответствует обратимым
процессам, знак неравенства – необратимым.
Для изолированных систем:
![]() .
Таким образом,
.
Таким образом,
в изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии.
энтропия изолированной системы не может самопроизвольно убывать.
Oба этих вывода также являются формулировками второго начала термодинамики.
Подставляя
вместо δQ
выражение
из первого начала термодинамики получим
объединенное
уравнение первого и второго начал
термодинамики:
![]() .
.
Расчет изменения энтропии в различных процессах
Большинство реальных процессов необратимо, то есть рассчитать энтропию нельзя. Так как энтропия является функцией состояния системы, то ее изменение в обратимом и необратимом процессе одинаково. Для вычисления изменения энтропии в данном реальном необратимом процессе, этот процесс (мысленно) разбивают на стадии, которые проводятся обратимо и вычисляют для них изменение энтропии для обратимых процессов, суммируют изменение энтропии всех обратимых стадий и получают изменение энтропии в данном необратимом процессе. Например, для расчета изменения энтропии в необратимом процессе нагревания льда, находящегося при Т= –10°С до состояния жидкой воды при Т=10°С (ΔSпроц), процесс разбиваем на три обратимые стадии: стадию нагревание льда от Т= –10°С до Т=0°С (ΔS1); стадию фазового перехода – плавления льда (ΔS2); стадию нагревания воды от Т=0°С до Т=10°С (ΔS3), тогда: ΔSпроцесса = ΔS1 + ΔS2 + ΔS3.
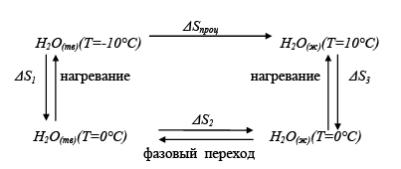
Рассмотрим, как рассчитывается энтропия в различных процессах.
Расчет изменения энтропии в процессе фазового перехода
Процессы фазового перехода (плавление, испарение, возгонка) проходят при постоянной температуре (Т=const). Изменение энтропии рассчитывают по уравнениям:
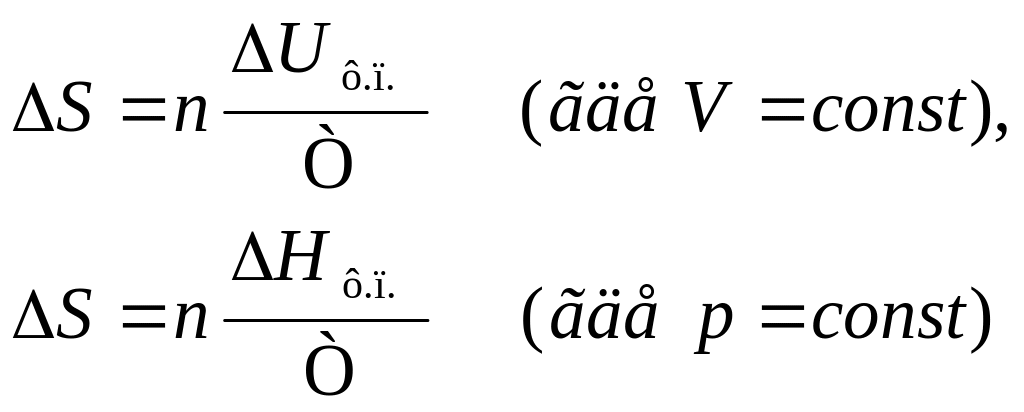 ;
;
где ΔUф.п. и ΔНф.п. – теплоты фазового перехода, Т – абсолютная температура фазового перехода, n – число моль.
2. Расчет изменения энтропии при нагревании жидких или твердых тел от т1 до т2
а) процесс протекает при постоянном объеме и теплоемкости (V, CV = const):
![]()
б) процесс протекает при постоянном давлении и теплоемкости (р, Cр =const):
![]()
в) процесс протекает при постоянном давлении (р = const), теплоемкость зависит от температуры (Cр=а+bT+cT2):
![]() .
.
Пример
Рассчитайте
изменение энтропии при нагревании 1
моль Cd от
25 до 727°С, если температура и теплота
плавления кадмия соответственно равны
321°С и 6109 Дж/моль. Зависимость изменения
теплоемкости от температуры для Cd(тв)
выражена
уравнением:
![]()
Решение: Данный процесс состоит из трех стадий: 1) нагревания твердого кадмия до температуры плавления; 2) плавление кадмия; 3) нагревания жидкого кадмия.
Изменение энтропии в 1 стадии:
![]()
Изменение энтропии в процессе фазового перехода:

Изменение энтропии в 3 стадии:

Общий прирост энтропии составит:
ΔS=
ΔS1
+ ΔS2
+
ΔS3=16,18+10,28+19,28=45,74
![]()
ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутреннюю энергию системы можно условно представить в виде суммы двух величин "свободной" и "связанной" энергии. Возможность рассчитать величину "свободной" энергии, т.е. той части внутренней энергии системы, которую можно превратить в работу, дает тепловая теорема Нернста, называемая также третьим начало термодинамики.
Основные положения тепловой теоремы заключаются в следующем:
1. При абсолютном нуле температуры свободная энергия X равна теплоте процесса.
2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
Одной из формулировок третьего начала термодинамики является также постулат Планка:
Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
Строго говоря, тепловая теорема Нернста и постулат Планка являются следствиями из второго начала термодинамики; но независимо от этого они имеют очень большое значение, позволяя рассчитывать абсолютную энтропию системы и, следовательно, величину свободной энергии системы.
Поскольку
энтропия есть функция состояния,
изменение энтропии в ходе химического
процесса определяется только видом и
состоянием исходных веществ и продуктов
реакции и не зависит от пути реакции;
оно может быть рассчитано по уравнению:
![]()
Для многих веществ величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса лишь для наиболее простых систем – изолированных. На практике же большей частью приходится иметь дело с системами, взаимодействующими с окружающей средой. Для характеристики процессов, протекающих в закрытых системах, были введены новые термодинамические функции состояния: изобарно-изотермический потенциал (свободная энергия Гиббса (G)) и изохорно-изотермический потенциал (свободная энергия Гельмгольца (F)).
Поведение всякой термодинамической системы в общем случае определяется одновременным действием двух факторов – энтальпийного, отражающего стремление системы к минимуму тепловой энергии, и энтропийного, отражающего противоположную тенденцию – стремление системы к максимальной неупорядоченности. Если для изолированных систем (ΔН = 0) направление и предел самопроизвольного протекания процесса однозначно определяется величиной изменения энтропии системы ΔS, а для систем, находящихся при температурах, близких к абсолютному нулю (S = 0 либо S = const) критерием направленности самопроизвольного процесса является изменение энтальпии ΔН, то для закрытых систем при температурах, не равных нулю, необходимо одновременно учитывать оба фактора. Направлением и предел самопроизвольного протекания процесса в любых системах определяет более общий принцип минимума свободной энергии:
Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения.
Для закрытых систем, находящихся в изобарно-изотермических либо изохорно-изотермических условиях свободная энергия принимает вид изобарно-изотермического либо изохорно-изотермического потенциалов (т.н. свободная энергия Гиббса и Гельмгольца соответственно). Данные функции называют иногда просто термодинамическими потенциалами, что не вполне строго, поскольку термодинамическими потенциалами являются также внутренняя энергия (изохорно-изэнтропный) и энтальпия (изобарно-изэнтропный потенциал).
Рассмотрим закрытую систему, в которой осуществляется равновесный процесс при постоянных температуре и объеме. Выразим работу данного процесса, которую обозначим Amax (поскольку работа процесса, проводимого равновесно, максимальна), из уравнений (I.53, I.54):
![]()
![]()
Сгруппировав члены с одинаковыми индексами это выражение может быть преобразовано к виду:
![]()
Введя обозначение:
![]()
![]() получаем:
получаем:
![]() ,
,
Функция есть изохорно-изотермический потенциал (свободная энергия Гельмгольца), определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях.
Закрытую систему, находящуюся в изобарно-изотермических условиях, характеризует изобарно-изотермический потенциал G:
![]()
![]()
Поскольку
–ΔF = Amax,
можно записать:
![]()
Величину А'max называют максимальной полезной работой (максимальная работа за вычетом работы расширения). Основываясь на принципе минимума свободной энергии, можно сформулировать условия самопроизвольного протекания процесса в закрытых системах.
Условия самопроизвольного протекания процессов в закрытых системах:
Изобарно-изотермические (P = const, T = const):
ΔG < 0, dG < 0
Изохорно-изотермические (V = const, T = const):
ΔF < 0, dF < 0
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой. В химии наиболее часто используется изобарно-изотермический потенциал, поскольку большинство химических (и биологических) процессов происходят при постоянном давлении. Для химических процессов величину ΔG можно рассчитать, зная ΔH и ΔS процесса, по уравнению
![]()
либо пользуясь таблицами стандартных термодинамических потенциалов образования веществ ΔfG°; в этом случае ΔrG° реакции рассчитывается аналогично ΔrН° по уравнению :
![]()
Величина стандартного изменения изобарно-изотермического потенциала в ходе химической любой реакции ΔG°298 есть мера химического сродства исходных веществ. Основываясь на уравнении (I), можно оценить вклад энтальпийного и энтропийного факторов в величину ΔG и сделать некоторые обобщающие заключения о возможности самопроизвольного протекания химических процессов, основываясь на знаке величин ΔН и ΔS.
1. Экзотермические реакции; ΔH < 0.
а) Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
б) Если ΔS < 0, реакция будет идти самопроизвольно при ΔН > TΔS (низкие температуры).
2. Эндотермические реакции; ΔH > 0.
а) Если ΔS > 0, процесс будет самопроизвольным при ΔН < TΔS (высокие температуры).
б) Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
