
- •1.1. Строение алкенов.
- •1.2 Номенклатура, изомерия
- •1.3. Способы получения этиленовых углеводородов.
- •1.4. Химические свойства.
- •Реакции радикального замещения
- •5. Гидроборирование
- •3.5. Источники поступления алкенов в окружающую среду
- •3.6. Воздействие алкенов на здоровье человека и окружающую среду
Алкены
1.1. Строение алкенов.
Для этиленовых углеводородов характерна двойная углерод-углеродная связь, состоящая из одной σ- и одной π-связи.
При образовании двойной связи в молекулах ненасыщенных соединений мы встречаемся с гибридизацией одной s- и двух р-атомных орбиталей углерода с образованием трех эквивалентных гибридных орбиталей, называемых sp2 -орбиталями. Они используются на образование трех σ-связей.
Незатронутая гибридизацией р-орбиталь одного углеродного атома перекрывается с р-орбиталью другого атома углерода и дает в результате такого взаимодействия π-связь. Эта связь менее прочная, чем σ-связь, так как р-орбитали с параллельными осями перекрываются значительно меньше, чем при образовании π-связей .
Непредельные углеводороды содержат меньшее число водородных атомов, чем предельные углеводороды, поэтому их называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой CnH2n.
Энергия связи С=С составляет 612,4 кДж/моль, длина её равна 0,134 нм. Двойная связь определяет главнейшие химические свойства олефинов.

Пространственная структура этилена.
В соответствии с теорией гибридизации двойная связь образуется за счет перекрывания вдоль линии связи С-С sp²-гибридных орбиталей атомов углерода (σ-связь) и бокового перекрывания углеродных p-орбиталей (π-связь).

![]()
Схема образования связей в молекуле этилена
В состоянии sp² гибридизации электронное состояние атома углерода можно представить следующим образом:
![]()
Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120°. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С.
1.2 Номенклатура, изомерия
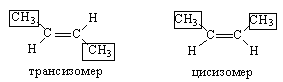
При изучении этиленовых углеводородов следует обратить внимание на то, что изомерия непредельных углеводородов более многообразна, чем предельных, так как она может быть вызвана не только разветвлением углеродного скелета (изомерия углеродного скелета), но и различным расположением кратной связи. К тому же, наличие в алкенах двойной связи (II) делает возможным вращение атомов углерода относительно друг друга. Это приводит к возможности существования алкенов в виде пространственных изомеров, которые различаются расположением атомов в пространстве (пространственная, геометрическая или цис-, трансизомерия).
Изомер, у которого более сложные группы расположены по одну сторону от двойной связи, называется цисизомером. Изомер, у которого те же группы атомов расположены по разные стороны от двойной связи, называется трансизомером. Так, 2-бутен СН3–СН=СН–СН3 существует в форме двух геометрических изомеров:
По рациональной номенклатуре этиленовые углеводороды рассматриваются как производные этилена (пример 1). Если в этилене два атома водорода замещены на углеводородные радикалы, то расположение их у разных атомов углерода этилена обозначается словом «симметрично» (симм.) (пример 2), а расположение радикалов у одного атома углерода – словом «несимметрично» (несимм.) (пример 3).
Названия углеводородов составляют, перечисляя названия радикалов в порядке возрастания сложности с обозначением их расположения и добавления окончания этилен.
Примеры.

По систематической номенклатуре для этиленовых углеводородов в названии алкана с тем же числом атомов углерода окончание «ан» заменяют на «ен». Для обозначения положения двойных связей углеродные атомы цепи нумеруют так, чтобы атомы углерода, за которым следуют связи, получали наиболее низкие номера (примеры 1, 2). Как и для предельных углеводородов, для этиленовых углеводородов выбирают главную цепь. Главной цепью считают самую длинную и самую сложную (самую разветвленную) цепь атомов углерода, включающую по возможности все кратные связи. Нумерации углеродов главной цепи ведут таким образом, чтобы кратные связи получили наименьшие номера (пример 3). При составлении названия сначала называют радикалы-заместители, затем главную цепь. Перед названием радикалов ставят цифру, указывающую их положение в цепи, а перед названием главной цепи цифры, указывающие положение кратных связей.
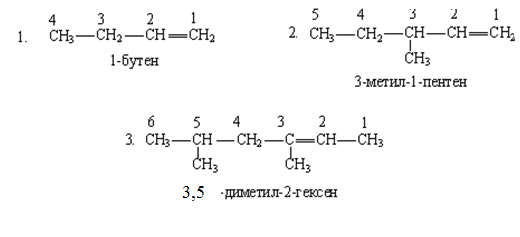
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С==СН— - винил (этенил)
Н2С==CН—СН2 - аллил (пропенил-)
