
Министерство образования и науки Российской Федерации
Белгородский Государственный Университет
Кафедра материаловедения и нанотехнологий
Влияние гомогенизационного отжига на структуру литых алюминиевых сплавов
Методические указания
к лабораторной работе № 1 по курсу «Теория термической, деформационно-термической и химико-термической обработки»
для студентов направления 150100.62 «Материаловедение и
технология новых материалов»
Белгород 2012
Составитель: Кайбышев Р.О.
УДК 620.18
Влияние гомогенизационного отжига на структуру литых алюминиевых сплавов: Методическое указание к лабораторной работе по курсу «Теория термической, деформационно-термической и химико-термической обработки». Для студентов направления 150100.62 "Материаловедение и технология новых материалов" / Белгородский государственный университет; Сост. Р.О.Кайбышев — Белгород, 2012. — 22 с.
В методических указаниях к лабораторной работе " Влияние гомогенизационного отжига на структуру литых алюминиевых сплавов " по курсу «Теория термической, деформационно-термической и химико-термической обработки» приведены основные закономерности структурных изменений в процессе высокотемпературного гомогенизационного отжига литых алюминиевых сплавов. Рассмотрено влияние гомогенизационного отжига на их микроструктуру.
Методические указания составлены в соответствии с рабочей программой курса «Теория термической, деформационно-термической и химико-термической обработки» и предназначены для студентов, обучающихся по направлению 150100.62 "Материаловедение и технология новых материалов".
Рецензенты: Профессор, д.т.н. Салищев Г.А.
Профессор Белов Н.А. (Кафедра литья МИСиС)
Лабораторная работа № 1
Влияние гомогенизационного отжига на структуру литых алюминиевых сплавов
1. Цель работы
Изучить неравновесную кристаллизацию, ее влияния на структуру и свойства литых сплавов.
Изучить влияние гомогенизационного отжига на структуру литых алюминиевых сплавов.
Изучить механизмы гомогеннизационного отжига, коагуляцию и сфероидизацию
2. Теоретическая часть
2.1 Неравновесная кристаллизация. Фазовые превращения, протекающие при кристаллизации сплавов, зависят от скорости кристаллизации, градиента температур и скорости роста кристаллов. Скорость кристаллизации, которая оказывает определяющее влияние на структуру и свойства слитка, в промышленности сильно зависит от применяемой технологии литья и изменяется от 0,5 до 100 К/мин. При литье в песчаные формы по традиционным технологиям скорость затвердевания варьируется от 0.2 до 1 К/мин. Современные технологии типа Disamatic обеспечивают на небольших отливках скорость охлаждения от 5 до 10 К/мин. При литье в кокиль и литье под давлением скорость охлаждения достигает 20 К/мин. В металлургическом производстве максимальная скорость литья 70-100 К/мин достигается при непрерывном литье. Градиент температур определяется температурой перегрева жидкого металла при литье и размером отливки. Скорость роста кристаллов определяется, главным образом, химическим составом сплава, от который зависит тепловая энергию плавления, выделяющуюся при затвердевании, а также температурой. Соответственно, кристаллизация возможна тремя различными путями:
1. Очень медленная равновесная кристаллизация при скорости менее 0.05 К/мин (Рис.1а);
2. Неравновесная кристаллизация, при которой диффузия не успевает выравнивать химический состав кристаллов в твердой фазе, но успевает полностью выравнивать химический жидкости (Рис.1б). Наблюдается при скоростях кристаллизации от 0.1 до 5 К/мин.
3. Неравновесная кристаллизация, при которой диффузия в твердом теле полностью подавлена. Соответственно, химический состав кристаллов не выравнивается. Химический состав жидкости частично выравнивается только за счет диффузионного переноса (Рис.1в). Соответственно, в жидкости вблизи границы жидкость/кристалл будет повышенная концентрация легирующего элемента, которая будет уменьшаться до равновесной величины с увеличением расстояния. Наблюдается при скоростях выше 1 К/мин. Это называется концентрационным переохлаждением жидкости.
Таким образом, в промышленных условиях кристаллизация может быть только неравновесной. Это приводит к появлению следующих особенностей структуры слитка, по сравнению с равновесной кристаллизации, которые могут иметь место как вместе, так и по отдельности:
Легирующие элементы неравномерно распределены в твердом растворе по сечению кристаллитов.
В структуре присутствуют фазы эвтектического происхождения, которые либо не должны образовываться, либо их удельный объем выше равновесного для данного сплава.
Образуется ячеистая, либо дендритная структура.
Твердый раствор пересыщен легирующим элементом, который должен образовывать интерметаллиды по перетектическим (например Sc,Zr,Cr,Ti в Al), либо по эвтектическим (например Mn в Al) реакциям.
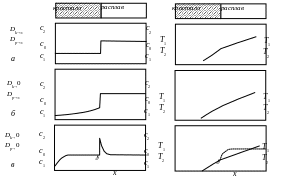
Рис. 1 Затвердевание твердого раствора по диаграмме на Рис.2 с концентрацией C0. Cлева концентрационные профили, справа температурные профили.
Рассмотрим подробно механизмы неравновесной кристаллизации на примере сплава с неограниченной растворимостью элементов в твердом состоянии. При кристаллизации в большинстве случаев отвод тепла происходит через кристалл, примыкающий к стенке формы. В этом случае распределение температур имеет вид, приведенный на Рис.1. Кристалл растет плоским фронтом, поскольку если появится вытянутый дендрит то, он попадет в область более высоких температур и растворится. При втором типе кристаллизации затвердевание сплава состава С0 происходит следующим образом (Рис.2 и 3). При понижении температуры до Т1 (температуры ликвидуса) (Рис.2) образуется первый кристалл состава С1 (Рис.3). При дальнейшем понижении температуры до Т2 образуется кристалл состава С2. На межфазной поверхности жидкость/кристалл всегда будет соблюдаться фазовое равновесие при втором типе неравновесной кристаллизации – кристалл с концентрацией С2 будет контактировать с жидкостью только состава СL2 при температуре T2. Элемент В может перейти из жидкости в кристалл только в том случае, если его концентрация в кристалле вблизи межфазной поверхности станет меньше С2. Если бы кристаллизация была равновесной, то элемент B за счет выравнивающей диффузии переместился бы из кристалла состава С2 в кристалл состава С1, что привело бы к изменению химического состава первого кристаллика до концентрации С2, а во второй кристалл перешло дополнительное количество атомов из жидкости для восстановления в нем концентрации элемента В, которое компенсирует уход этого элемента в первый кристалл. Однако, при неравновесной кристаллизации диффузия в твердом теле подавлен. Элемент В не уходит из второго кристалла в первый. Соответственно, дополнительное количество элемента В не может из жидкости попасть в твердое тело, чтобы выровнять его средний состав до С2. Средний состав твердого тела будет соответствовать точки С2' при неравновесной кристаллизации (Рис.2), а не точке С2, как при равновесной. Доля жидкости mL и доля твердой фазы mS будет рассчитываться по формулам
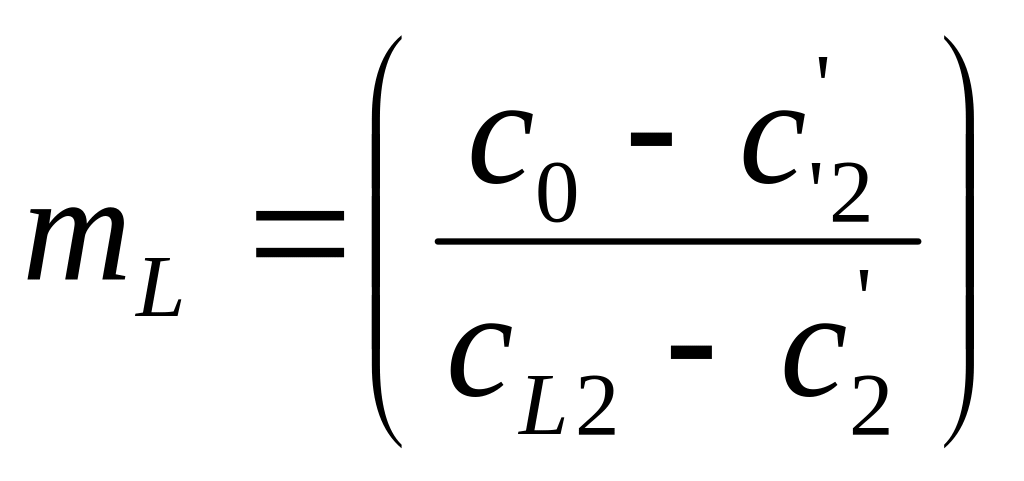
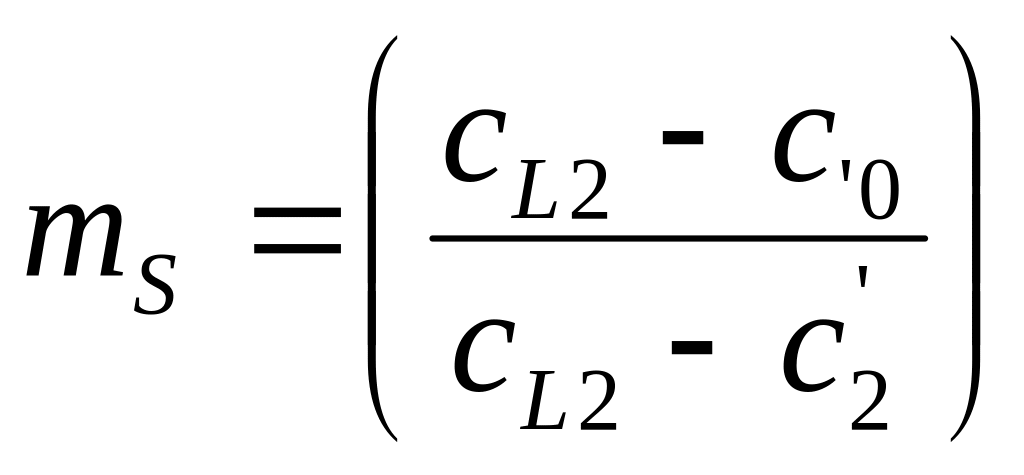
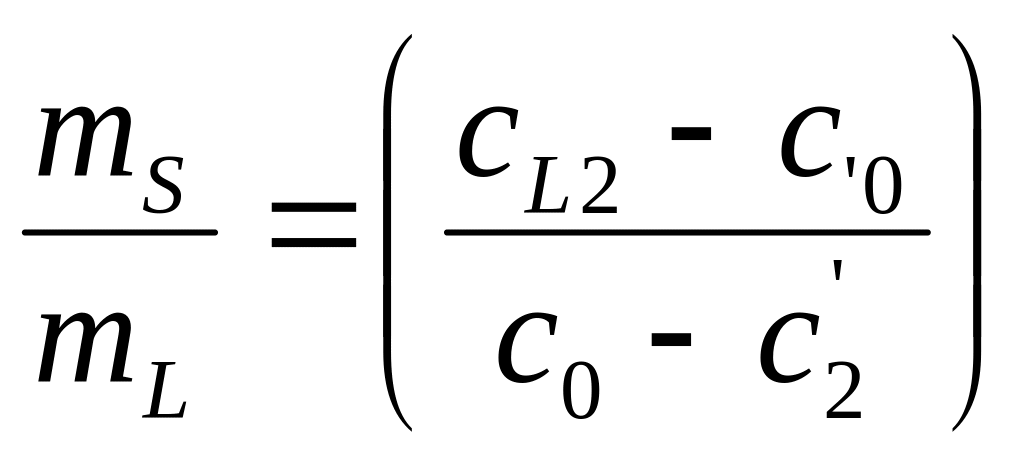
То есть, удельная доля жидкости при неравновесной кристаллизации больше, чем при равновесной поскольку (С0 – С'2)> (С0 – С2) (Рис.2).
При
дальнейшем охлаждении выделяется третий
кристалл состава С0
(Рис.3). Однако, на этом кристаллизация
не заканчивается, поскольку средний
химический состав твердого тела
соответствует C’0
С0.
Остается некоторое количество жидкости,
которое можно рассчитать по формуле
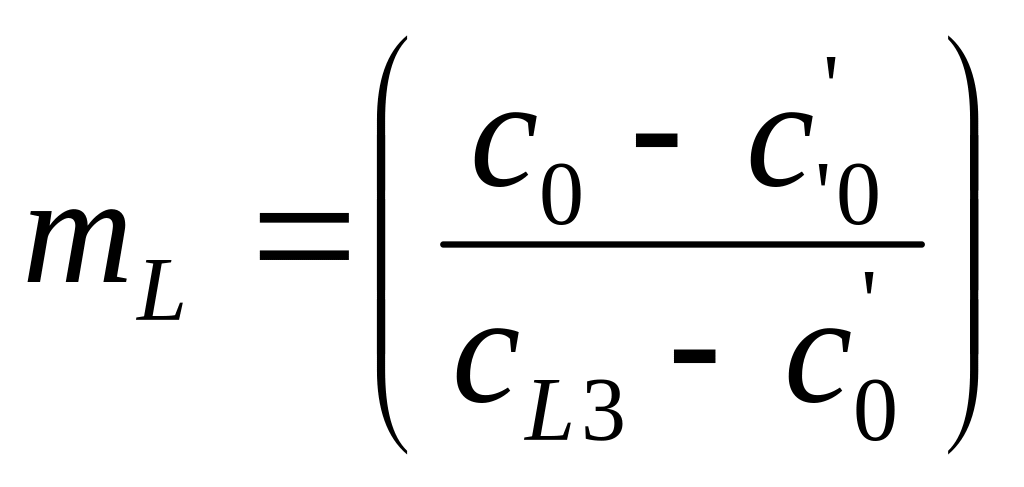 (Рис.3).
Кристаллизация заканчивается с выделением
четвертого последнего кристаллика
состава C4.
При этом средний состав твердого тела
становится равным среднему составу
сплава С0.
Температура T4,
при которой заканчивается неравновесная
кристаллизация, является точкой
метастабильного солидуса. МЕТАСТАБИЛЬНЫЙ
СОЛИДУС представляет собой геометрическое
место точек температур, при которых
происходит затвердевание сплавов с
разным составом при неравновесной
кристаллизации (линия T4-c
на Рис.3). Неравновесная кристаллизация
(2) приводит к возникновению большого
градиента концентрации в твердом
растворе grad(C4-C1)/x:
концентрация легирующего элемента
минимальна в центре кристалла (С1)
и увеличивается к его краям (С4).
(Рис.3).
Кристаллизация заканчивается с выделением
четвертого последнего кристаллика
состава C4.
При этом средний состав твердого тела
становится равным среднему составу
сплава С0.
Температура T4,
при которой заканчивается неравновесная
кристаллизация, является точкой
метастабильного солидуса. МЕТАСТАБИЛЬНЫЙ
СОЛИДУС представляет собой геометрическое
место точек температур, при которых
происходит затвердевание сплавов с
разным составом при неравновесной
кристаллизации (линия T4-c
на Рис.3). Неравновесная кристаллизация
(2) приводит к возникновению большого
градиента концентрации в твердом
растворе grad(C4-C1)/x:
концентрация легирующего элемента
минимальна в центре кристалла (С1)
и увеличивается к его краям (С4).
Абсолютное большинство промышленных сплавов созданы на основе диаграмм эвтектического типа с ограниченной переменной растворимостью компонентов в твердом состоянии (Рис.4). Неравновесная кристаллизация сплавах, в которых при равновесном охлаждении не образуется эвтектика (C0 на Рис.4), приводит к появлению избыточных фаз эвтектического происхождения (Рис.5). Неравновесная кристаллизация сплава состава C0 (Рис.4) проходит как в случае неограниченной растворимости компонентов в твердом стоянии (Рис.2) вплоть до температуры T4 равной эвтектической температуре. При этой температуре состав жидкости CL4 становится равным химическому составу эвтектики, что приводит к ее быстрой кристаллизации. Неравновесная эвтектика выделяется по границам зерен. В большинстве алюминиевых сплавов образуется вырожденная неравновесная эвтектика: по границам зерен выделяются частицы неравновесной фазы эвтектического происхождения, эвтектика как структурная составляющая не выявляется.
Метастабильный сольвус (линия DkC на Рис.4) для большинства составов представляет собой метастабильное продолжении линии эвтектики до точки ke, которая представляет сбой концентрационную границу появления неравновесной эвтектики при данных промышленных скоростях кристаллизации. Величина ke мала. Для примера в таблице приведено сравнение при 20К/мин (литье в кокиль) соотношение величины ke и предельной растворимости C=С4 при эвтектической температуре.
Cистема/вес.% |
Al-Cu |
Al-Mg |
Mg-Al |
С, % |
5,7 |
17,4 |
12,7 |
ke, % |
0,1 |
0,5 |
0,1 |
Видно, что при неравновесной кристаллизации эвтектические фазы образуются при чрезвычайно малой концентрации легирующего элемента. Содержание легирующих элементов в промышленных сплавах многократно превышает величину точки ke. Таким образом, неравновесная кристаллизация ВСЕГДА приводит к выделению неравновесных эвтектических фаз, если состав сплава расположен левее точки С, или к увеличению их концентрации выше равновесного значения, если состав сплава расположен правее точки С.
Таким образом, неравновесная кристаллизация с отсутствием диффузионного выравнивания химического состава в твердом состоянии и полным выравниванием химического состава в жидкости приводит к образованию разности в химическом составе твердого раствора и появлению неравновесных фаз.
Неравновесная кристаллизация, при которой химический состав жидкости выравнивается частично, (3) приводит к формированию ячеистой, либо дендритной структуры. Эта неравновесная кристаллизация происходит следующим образом. При кристаллизации сплава состава С0 между твердым телом и жидкостью существует разница в химическом составе С1/CL1=k (Рис.2). В первом приближении можно принять, что величина k постоянна при любых составах жидкости и твердого тела. При кристаллизации абсолютного большинства промышленных сплавов k<1. При выделении первого кристаллика с концентрацией C1 (Рис.2 и 3) жидкость вблизи границы жидкость/кристалл оказывается обогащена элементом В по сравнению с равновесным составом СL1 до величины C0/k (Рис.2 и 6). Избыточное элемента В вблизи границы жидкость/кристалл не успевает достичь равновесной величины СL1 за счет конвекции, либо перемешивания жидкости, что приводит к возникновению градиента концентрации в жидкости (Рис.2 и 3). Предположим, что C0/k=CL3. Тогда в жидкости существует grad(CL1-CL3)/x. Жидкость состава CL3 (Рис.2) устойчива против кристаллизации при температуре T1; выделение из нее кристаллов может начаться только при ее переохлаждении до температуры T3. Величина T1- T3 называется концентрационным переохлаждением и очень сильно зависит от расстояния от границы жидкость/кристалл и температурного градиента в жидкости. Если в жидкости большой температурный градиент (такое встречается при непрерывном литье с перегревом жидкости – жидкость касается водоохлаждаемых стенок изложницы, на которых быстро начинается кристаллизация с очень большим теплоотводом через кристаллы, а в центре жидкости сохраняется очень высокая температура) выше критического (Рис.6), то концентрационного переохлаждения нет.
В случае небольшого перепада температур внутри жидкости, выделение первого кристалла приводит к возникновению концентрационного переохлаждения жидкости до температуры T3 (состав жидкости границы жидкость/кристалл соответствует CL3), второй кристалл сразу выделяется с составом С0 (Рис.2) или близким к нему (Рис.7), что существенно снижает градиент концентрации в твердом растворе (Рис.2 и 8). Однако концентрационное переохлаждение приводит к образованию ячеистой структуры, а сильное концентрационное переохлаждение к образованию дендритной структуры. В отличие от роста кристаллов плоским фронтом любой, образующийся на фронте роста кристалла при неравновесной кристаллизации (3) выступ попадает в область концентрационного переохлаждения и быстро кристаллизуется (Рис.9). Ускоренная кристаллизация выступов обусловлена тем, что их концы располагаются в области более высоких температур, что существенно увеличивает вероятность как концентрационной, так и энергетической флуктуации, необходимых для образования зародыша кристалла (величина k не зависит от температуры). Однако температура конца выступа должна оставаться ниже локальной температуры ликвидуса. Именно соотношение перепада температур к жидкости и градиента концентрации элемента В жидкости, которая обуславливает увеличение локальной температуры ликвидуса с увеличением расстояния от кристалла, обуславливает существование критического градиента температур (Рис.6).
В основании выступов кристаллов температура минимальна, а концентрационное переохлаждение максимально. Именно в этих местах в сплавах с ограниченной растворимостью состав жидкости первым достигает эвтектического состава СL4 (Рис.4), что приводит к кристаллизации неравновесной эвтектической фазы. Формируется ячеистая структура – зерна, имеющие форму близкую к равноосной, окружены пленкой фазы эвтектического происхождения. Концентрация легирующего элемента в твердом растворе вблизи границ ячеек максимальна и уменьшается ближе к их центру. При больших величинах концентрационного переохлаждения отдельные ячейки начинают расти быстрее остальных, образуя боковые ветви. Образуется дендритная структура.
Пересыщенный твердый раствор образуется при неравновесной кристаллизации со скоростями 70К/мин и выше расплава в том случае, если два его компонента очень сильно отличаются по температуре плавления и в абсолютном большинстве случаев сплав описывается перетектической диаграммой. Кроме того, расплав должен быть перегрет на 100-200K выше обычной температуры литья. Рассмотрим неравновесную кристаллизацию при быстром охлаждении в сплавах, характеризующихся перетектическим превращением на примере схематичной диаграммы Al-Zr. Сплав с составом С0 (0,6вес.%) при охлаждении пересекает ликвидус при температуре T1 (Рис.10). Для образования равновесной -фазы (Al3Zr содержит 53%Zr) необходима почти 100 кратная концентрационная флуктуация. Кроме того, необходима очень большая энергетическая флуктуация (Тпл =1577оС). Это делает кристаллизацию равновесной фазы маловероятным. Кристаллизация происходит по метастабильному продолжению линий FPF' и путем выделение пересыщенного твердого раствора Al. Причем он выделяется не при температуре T1, а при существенно меньшей температуре T2. Для начала кристаллизации пересыщенного твердого раствора Zr в Al требуются минимальная концентрационная флуктуация, что обуславливает высокую скорость данного процесса. Кроме того, жидкость находящая в равновесии с твердым раствором будет иметь состав СL2, который существенно больше состава СL2, находящегося в равновесии с равновесной -фазой. Это делает ненужным существенное обеднение жидкости Zr, скорость диффузии которого в жидкости при данной температуре низка. Начало неравновесной кристаллизации твердого - раствора делает невозможным выделение стабильной -фазой, поскольку в равновесии с ней может находиться только жидкость с меньшим содержанием Zr. Имеет место концентрационный перегрев расплава по отношению к стабильной фазе. Однако, по отношению к метастабильному твердому раствору имеет место концентрационное переохлаждение, которое наряду с быстрой скоростью кристаллизации обеспечивает высокую однородность пересыщенного твердого раствора Zr в Al. Следует отметить, что E=0,08%Zr, P=0,11%Zr. Неравновесная кристаллизация без выделения первичных частиц -фазы возможна при содержании в сплавах Zr до 0,6% при скорости охлаждения 100K/минуту и до 1.5%Zr при скорости охлаждения 1000K/минуту. В заключении следует отметить, что на Рис.10 диаграмма Al-Zr приведена схематична. На самом деле точки F и A совпадают; кристаллизация пересыщенного твердого раствора происходит по AES, то есть при температуре T2.
2.2 Свойства литого материала. Литой материал имеет следующие недостатки:
Низкая пластичность делает невозможным обработку давлением (прокатка, ковка, горячая штамповка). Это связано с тем, что неоднородность матрицы по химическому ставу приводит к разнице в прочности между отдельными участками из-за разности в величине твердорастворного упрочнения. Участки, обедненные легирующим элементом, имеют меньшие напряжения течения. Пластическая деформация будет идти, главным образом, в них. Участки, обогащенные легирующими элементами, имеют существенно большие напряжения течения и остаются недеформируемыми. Сильная локализация пластического течения приводит к очень низкой технологической пластичности материала. Наличие хрупких интерметаллидов, которых не должно быть при равновесной кристаллизации, также приводит к преждевременному разрушению.
Неравномерность химического состава в 10 и более раз уменьшает сопротивление коррозии из-за образования микрогальванических пар между участками матрицы, отличающимися свои химическим составом.
При нагреве под обработку металлов давлением возможно частичное расплавление литого сплава при температурах существенно ниже температуры солидуса, что приводит к ПЕРЕЖОГУ.
Структура и свойства литых сплавов нестабильны во времени.
