
- •1 Словарь основных терминов по дисциплине
- •2 Вопросы к коллоквиуму и контрольным опросам по дисциплине
- •3 Тест промежуточного контроля знаний по дисциплине
- •4 Примеры итоговой контрольной работы по дисциплине
- •1 Вариант
- •2 Вариант
- •5 Задания для самостоятельной работы студентов по дисциплине
- •Домашнее задание №1
- •Домашнее задание №2
- •Домашнее задание №3
- •Домашнее задание №4
- •6 Учебно-методические материалы по дисциплине Основная литература
- •Дополнительная литература
- •Методическая литература
1 Словарь основных терминов по дисциплине
«Стереохимия органических реакций»
Аксиальные и экваториальные связи
Двумя относительно устойчивыми конформациями циклогексана являются кресло и твист-ванна, тогда как ванна, поскольку ей соответствует относительный энергетический максимум, должна рассматриваться только как своеобразное переходное состояние между первыми двумя формами. По этой причине будем рассматривать подробно только конформацию кресла, реализующуюся, например, в молекулах стероидов.
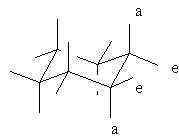
Заместители в этой конформации могут быть ориентированы в двух положениях. Заместители, расположенные параллельно оси симметрии С3 называются аксиальными и обозначаются символом (а), а заместители, которые лежат в плоскости, перпендикулярной этой оси, называются экваториальными и обозначаются символом (е). В случае молекул замещенных циклогексанов конформеры, содержащие заместители в экваториальных и аксиальных положениях, различаются прежде всего по своей свободной энергии. В то время как геометрические параметры, которые контролируют величины торсионных углов и напряжения, вызванные растяжением связей, в общем трудно подвержены влиянию заместителей в кольце, введение в аксиальное положение молекулы тех или иных группировок, больших по размеру, чем атом водорода, приводит к возникновению стерических взаимодействий этих группировок с валентно-несвязанными с ними другими двумя аксиальными заместителями, расположенными по ту же самую сторону кольца. Если аналогичный заместитель вводится в экваториальное положение молекулы, то подобного рода взаимодействия, естественно, малы по своей величине или даже полностью отсутствуют. Рассмотренные ситуации, например, имеют место в молекуле метилциклогексана, в которой расстояние между метильной группой и ближайшими соседними атомами водорода явно больше при экваториальной, чем при аксиальной, ориентации заместителя. При этом в последнем случае наименьшее расстояние наблюдается между метильной группой и двумя аксиальными атомами водорода, расположенными с ней по одну и ту же сторону кольца. Такого рода стерические взаимодействия валентно-несвязанных атомов проявляются весьма отчетливо и даже получили специальное название 1,3-диаксиалъные взаимодействия.
Асимметрический атом углерода
На примере молочной кислоты, существующей в виде двух оптических изомеров – мясомолочной кислоты и молочной кислоты брожения можно показать, что если четыре заместителя различны, то возможны два различных расположения, которые относятся друг к другу как предмет к своему зеркальному изображению. Таким образом, тетраэдрический углеродный атом можно рассматривать как центр диссимметрии, и его часто называют асимметрическим атомом углерода или (по современной терминологии) хиральным центром (от греческого слова сheir – рука). Два различных расположения представляют собой право- и левовращающие энантиомеры (зеркальные изомеры) хиральной молекулы; смесь равных количеств двух энантиомеров представляет собой рацемат.
Барьер вращения
В 1936 г. Д. Кемп и К. Питцер с целью согласования расчетных и экспериментальных термодинамических данных для этана предположили существование в нем барьера вращения вокруг простой С–С-связи, равного примерно 12 кДж/моль. Затем Питцер уточнил эту величину, определив, что она равна 12,05±0,52 кДж/моль. В случае этана можно представить существование двух конформаций – заслоненной j0 и заторможенной j1. Барьер вращения (12 кДж/моль) в данном случае соответствует разности внутренних энергий обеих конформаций. Более выгодна из них конформация j1.Энергетическую невыгодность заслоненных (четных) конформаций обычно считают следствием "пространственных препятствий" – перекрывания ван-дер-ваальсовых радиусов заслоненных атомов или групп.
Геометрические изомеры. E,Z-номенклатура
Олефины типа Саb=Саb существуют в виде стереоизомеров, причем необходимым и достаточным условием для такой стереоизомерии является неидентичность заместителей, т. е. a не равно b. Все атомы в соединении аbС=Саb обычно лежат в плоскости, и эта плоскость обязательно является плоскостью симметрии, если только а или b не представляют собой диссимметричные группы. Поэтому олефины обычно проявляют не энантиомерию, а цис- (от латинского слова сis – по одну сторону) и транс- (от латинского слова trans – напротив) изомерию, причем цис-транс-изомеры являются диастереомерами, называемыми также геометрическими изомерами. Для общей структуры аbС=Сcd воможно существование только двух изомеров; если же в соединении имеется n некумулированных двойных связей, то максимальное число стереоизомеров равно 2n, за исключением таких соединений, как, например, CH3-CH=CH-CH=CH-CH3, в которых благодаря наличию одинаковых заместителей при двойных связях число стереоизомеров уменьшается. Для гексадиена-2,4 существует три диастереомера: цис-цис, цис-транс и транс-транс, четвертый стереоизомер транс-цис идентичен цис-транс изомеру. Для олефинов типа аbC=Ccd предложена общая E,Z-номенклатура. Допустим, что согласно правилу старшинства, разработанному для энантиомеров, а старше b, с старше d. Если старшие заместители находятся в цис-положении, то конфигурацию относят к типу цис- и обозначают символом Z (от немецкого слова zusammen – вместе) перед названием соединения. Если же старшие группы находятся в транс-положении, то конфигурацию относят к типу транс- и обозначают символом Е (от немецкого слова entgegen – напротив).
Двугранный (торсионный) угол
В четырехатомных молекулах атомы могут располагаться по прямой (как, например, в случае ацетилена), в одной плоскости (как в случае формальдегида или трифторида бора) или в трехмерном пространстве (как в случае молекулы аммиака). Различными по своему характеру (линейными или с наличием разветвлений) могут быть и структурные отношения между атомами. При этом для описания линейных четырехатомных индивидуальных молекул (или четырехатомных фрагментов А–В–С–D, входящих в состав более сложных цепных систем) необходимо ввести еще один геометрический параметр, а именно, двугранный (он называется еще торсионным) угол φ.

Этот угол фактически отражает характер взаимного расположения двух трехъядерных фрагментов (А–В–С и В–С–D) четырехатомной молекулы, которые характеризуются своими собственными величинами валентных углов θ1 и θ 2. Наиболее наглядно двугранные углы изображаются в ньюменовских проекциях, при построении которых молекула рассматривается вдоль направления связи В–С, через которую проведен воображаемый диск (ближняя связь А–В при этом видна со стороны наблюдателя, а дальняя связь С-D проглядывается из-за этого диска).
Заслоненная и заторможенная конформации
В 1936 г. Питцер показал, что экспериментально найденные и рассчитанные термодинамические характеристики этана плохо согласуются, если не допустить существования энергетического барьера для свободного вращения вокруг простой С–С-связи, равного приблизительно 3,0 ккал/моль. Дальнейшие исследования позволили установить, что максимум энергии наблюдается, когда атомы водорода при соседних углеродных атомах сближены (заслоненная конформация), и минимум энергии соответствует максимальному удалению водородных атомов (заторможенная конформация). В заторможенной конформации величина двугранного угла между соседними вицинальными связями составляет 60°, в то время как в заслоненной форме этот угол равен примерно 0°.
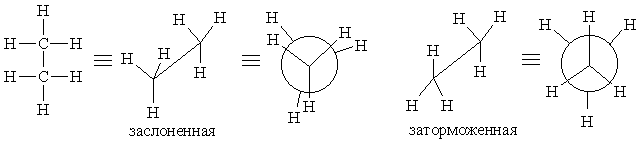
Этан (промежуточные конформации тоже возможны)
Благодаря наличию энергетического барьера большинство молекул этана существует при комнатной температуре в заторможенной или почти заторможенной конформации.
Конфигурация стереохимическая
характеризует относительное пространственное расположение атомов или групп атомов в молекуле химического соединения. Термин многозначен и смысл его зависит от конкретного понимания или определения пространственного порядка атомов. Его используют для характеристики фигуры или многогранника, образованного атомами молекулы. Например, говорят о тетраэдрической конфигурации молекулы метана, или тригонально-бипирамидальной конфигурации молекулы РСl5. Термин употребляют вместе с конкретным дополнительным определением или термином, характеризующим специфику пространственного расположения атомов. Так, можно говорить о цис- или транс-конфигурации, Z- или E-конфигурации, R- или S-конфигурации, D- или L-конфигурации, мезо-, трео- или эритро-конфигурации. При этом особенно часто понятие стереохимической конфигурации относится к расположению атомов или групп в пространстве вокруг асимметрического атома углерода. Например, аминокислоты относят к L-ряду, если в стереохимической проекции Фишepa аминогруппа расположена слева, как, например, в L-аланине. В сахарах конфигурация определяется асимметрическим атомом, соседним с первичной спиртовой группой, конфигурация которого сравнивается с конфигурацией асимметрического атома L- и D-глицеринового альдегида. Сравнение между собой конфигурации асимметрических атомов углерода в каких-либо молекулах называется корреляцией конфигураций, а определенные таким образом конфигурации – относительными конфигурациями. Замещение у асимметрического атома углерода может приводить к изменению конфигурации. Примером может служить обращение конфигураций в реакции бимолекулярного нуклеофильного замещения SN2. Методом аномального рассеяния рентгеновских лучей было установлено, что L-аланин, D- и L-глицериновые альдегиды действительно имеют конфигурацию, которая соответствует именно этим проекционным формулам. Поэтому если относительные конфигурации каких-либо асимметрических атомов определены путем сопоставления с этими структу-рами, то такие конфигурации называют также абсолютными конфигурациями. Конфигурация рассматривается как определенная характеристика энантиомерных объектов: молекулы, имеющие одинаковую последовательность связей между атомами и одинаковое относительное расположение атомов в пространстве, но являющиеся энантиомерными объектами, обладают различными конфигурациями. Конфигурация хиральной молекулы может сохраняться при значительной деформации этой молекулы, но переход одного энантиомера в другой всегда означает обращение конфигураций. Современное рассмотрение конфигурации связывает ее с понятием молекулярной топологической формы (МТФ) молекулы, под которой понимается геометрическая фигура (в топологическом смысле), характеризующая пространственное расположение ядер данного объекта в сочетании с особыми точками, как, например, центр инверсии. Конфиграция сохраняется при любых деформациях молекулы до тех пор, пока не исчезает хиральность и пока сохраняется МТФ. Учет конфигурации необходим при определении строения и планировании синтеза многих классов природных соединений, таких, как углеводы, пептиды и белки, антибиотики.
мезо-Форма
На рисунке показаны фишеровские проекции винных кислот. Действительно, первые две формулы представляют собой две активные формы, (–)- и (+)-винные кислоты, энантиомерные по отношению друг к другу. Однако третья и четвертая формулы представляют собой одну и ту же молекулу, так как одна формула может быть получена из другой вращением на 180° в плоскости бумаги, а такое вращение допустимо для проекционной формулы Фишера. Они представляют собой одну и ту же неактивную молекулу; это следует также из того факта, что молекула имеет плоскость симметрии (пунктирная линия). Таким образом, имеется винная кислота, диастереомерная по отношению к активным формам, но сама по себе неактивная. Эту кислоту называют мезо-винной. Все неактивные диастереомеры этого типа также называют “мезо-формами”.
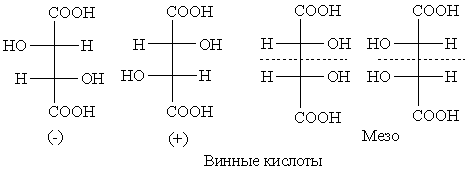
Мезо-винная кислота отличается от каждого из активных диастереомеров по физическим и химическим свойствам по той же самой причине, по какой один активный диастереомер отличается от другого. Например, мезо-винная кислота плавится при 140°, тогда как (+)- и (–)-формы винной кислоты плавятся при 170°; у мезо-кислоты меньшая плотность, она менее растворима в воде, является более слабой кислотой, чем оптически активные изомеры, и имеет более высокий дипольный момент. (–)-Винная кислота состоит из двух асимметрических атомов углерода с одинаковым расположением групп вокруг них. (+)-Винная кислота также состоит из двух асимметрических атомов углерода с одинаковым расположением заместителей, но противоположным расположению для (–)-энантиомера. С другой стороны, мезовинная кислота состоит из двух асимметрических атомов углерода с противоположным расположением групп вокруг них. Этот вывод можно сделать и из проекционной формулы, если отделить верхнюю половину от нижней по пунктирной линии и повернуть ее на угол 180°.
Молекулярная хиральность
Хиральными являются все те молекулы, у которых отсутствуют зеркально-поворотные оси симметрии Sn. Симметрия любой молекулы определяется как наличием тех или иных взаимосвязей между ее структурными субъединицами, так и их характером (т.е. идентичностью или неидентичностью), и геометрическим расположением. При этом в молекулах различных классов возможны самые разные типы взаимного расположения составляющих их субъединиц (лигандов) и их структурные сочетания. Однако, каково бы ни было при этом структурное разнообразие возможных молекулярных систем, в молекулах самых различных классов всегда можно выделить то или иное число воображаемых структурных элементов упорядоченности, основными из которых являются точка, ось, плоскость или спираль. Связанные с этими элементами типы хиральности принято подразделять соответственно на центральную, аксиальную, планарную или спиральную хиральность. Наряду с этим широко известны примеры молекул, которые могут содержать сразу несколько элементов хиральности (например, хиральных центров), одновременно являющихся и естественными элементами их структурной упорядоченности. Стереохимическая конфигурация хиральной молекулы (имеющая значение “смысла хиральности”, как ее еще называют), может быть строго определена через пространственное расположение ее лигандов вокруг тех или иных имеющихся в молекуле (перечисленных выше) элементов упорядоченности. При этом энантиомеры имеют противоположный смысл хиральности, т.е. противоположную конфигурацию.
Напряжения
Существует три основных различия между циклоалканами и углеводородами с открытой цепью. Прежде всего, в циклах с небольшим числом углеродных атомов существует значительное отклонение угла С–С–С от нормального тетраэдрического угла 109°28'. Например, в квадратной молекуле циклобутана С4Н8 угол составляет 90°, а в треугольной молекуле циклопропана С3Н6 угол равен 60°. Это отклонение от нормального тетраэдрического угла вызывает так называемое угловое напряжение: чтобы мог образоваться малый цикл, требуется энергия для деформации нормального тетраэдрического угла. Это напряжение (называемое также байеровским напряжением по имени открывшего его лауреата Нобелевской премии Адольфа фон Байера) можно измерить количественно как разность теплот сгорания рассматриваемого цикла и метиленовой цепи (СН2)n с таким же числом углеродных атомов. Теплота сгорания цепи (СН2)n берется равной n·157,4 ккал/моль, где величина 157,4 ккал/моль представляет среднее изменение теплоты сгорания при переходе от углеводорода СnН2n+2 к следующему гомологу. Для циклопропана теплота сгорания равна 499,8 ккал/моль и, следовательно, напряжение составляет 499,8 – 3·157,4 = 27,6 ккал/моль (или 9,2 ккал/моль в расчете на одну метиленовую группу). Соответствующие величины для циклобутана следующие: теплота сгорания 655,80 ккал/моль, общее напряжение 20,2 ккал/моль, напряжение в расчете на одну метиленовую группу 6,55 ккал/моль. Общее напряжение в циклобутане почти такое же, как в циклопропане, тогда как напряжение в расчете на одну метиленовую группу гораздо меньше, что отражает значительно меньшую деформацию валентных углов в циклобутане (от 109°28' до 90°) по сравнению с циклопропаном (от 109°28' до 60°).
Второе различие между алканами и циклоалканами заключается в том, что в алканах звенья цепи обычно находятся в заторможенных конформациях, чаще всего в трансоидной, тогда как для образования кольца некоторые звенья должны принять скошенную или даже заслоненную конформации. Примером может служить циклопентан: измеренное напряжение кольца 793,5 – 5·157,4 = 6,5 ккал/моль или 1,3 ккал/моль в расчете на одну метиленовую группу. Эта величина значительно меньше, чем напряжение в циклопропане или даже циклобутане. На первый взгляд кажется удивительным, что в циклопентане вообще имеется напряжение, поскольку угол правильного пятиугольника, равный 108°, настолько близок к тетраэдрическому, что угловое напряжение незначительно. Угловое напряжение приблизительно равно 0,017Dq2 ккал/моль, где Dq – отклонение (в градусах) от нормального валентного угла. Таким образом, напряжение составляет только 0,07, 1,7 и 6,8 ккал/моль при отклонении угла связи от нормального значения на 2, 10 и 20° соответственно. Последняя величина угла – это приблизительно деформация в циклобутане. Однако рассмотрение моделей показывает, что если молекуле циклопентана придать форму плоского пятиугольника, то все связи С–С и С–Н будут находиться в заслоненной конформации и в результате появится значительное напряжение заслонения, или торсионное напряжение (иногда называемое питцеровским напряжением по имени его открывателя К. Питцера), величина которого составила бы 10–15 ккал/моль. Однако в действительности молекула циклопентана несколько искажена; в результате напряжение заслонения значительно уменьшается.
R,S-номенклатура
Существующая в настоящее время система Кана-Ингольда-Прелога использует символы R или S для обозначения каждого хирального центра в зависимости от его конфигурации. Чтобы обозначить хиральный центр соответствующим символом R или S, определяют старшинство заместителей – а, b, с и d. Предположим, что последователь-ность будет а –> b –> c –> d. Тогда на хиральный центр смотрят со стороны удаленной от младшего заместителя d; если старшинство остальных заместителей уменьшается по часовой стрелке a –> b –> c, то такая конфигурация обозначается R, а если против часовой стрелки, то конфигурацию обозначают символом S (рис). R,S-обозначения можно определять и по проекционной формуле Фишера. Если в ней младший заместитель расположен в нижней части формулы, а старшинство заместителей a–>b–>c уменьшается по часовой стрелке, то конфигурацию обозначают знаком R, а если против часовой стрелки, то знаком S. Если в проекционной формуле Фишера внизу находится не младший заместитель, то можно с помощью перестановки трех заместителей подряд или четного числа перестановок двух заместителей привести формулу к такому виду, что младший заместитель займет положение внизу (одна такая перестановка приводит к обращению конфигурации).
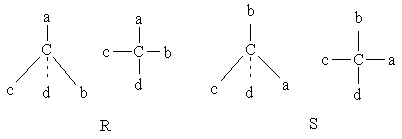
Для определения последовательности а, b, с и d используется следующее правило старшинства (или последовательности):
Атомы, связанные с хиральным центром, располагаются в порядке уменьшения их атомных номеров, например Вr > Сl> С > Н.
Если атомы, соединенные с хиральным центром, одинаковы, то учитывают связанные с ними заместители и, если необходимо, переходят далее к следующему слою и т.д. Согласно этому правилу, СН3СН2 > СН3 (так как С > Н) и СН3СН2СН2 > СН3СН2 (по той же причине; рассматривается еще более удаленный атом). Если два заместителя связаны с атомами одинакового атомного номера, но в различном числе то старшинство отдается заместителю с большим числом атомов. Это приводит к следующей последовательности: (СН3)3С > (СН3)2СН > СН3СН2 и СН(ОR)2 > СН2OR.
Атомы, связанные двойной связью, считаются за два атома (или за три в случае тройной связи); для атомов, имеющих менее четырех заместителей, отсутствующие заместители заменяются гипотетическими с нулевым атомным номером. Согласно этому правилу, группировка СНО имеет преимущество перед группировкой СН2ОН [но не перед СH(ОСН3)2], С6Н5 имеет преимущество перед С(СН3)3, а NН(СН3)2 старше N(СН3)3.
Если различие только в изотопном замещении, то старшим является атом с большим массовым числом (т. е. D>Н). Если два лиганда различаются только по их конфигурации, то R старше S, а цис- (определенное по системе Кана – Ингольда –Прелога) старше транс-.
Оптическая активность
проявляется во вращении плоскости поляризации света молекулами некоторых соединений, когда они находятся в газообразном, жидком или расплавленном состоянии или в растворе. Вращение наблюдают и измеряют с помощью довольно простого прибора, известного под названием поляриметра. Существуют устройства, позволяющие сравнивать интенсивности световых потоков с помощью фотоэлементов. Экспериментально наблюдаемый угол вращения оптически активной жидкости, газа или раствора обозначают символом α.. Оптическое вращение пропорционально концентрации. Измерения, выполненные при двух различных концентрациях, почти всегда однозначно определяют угол вращения α.Факторами, влияющими на величину оптического вращения, помимо природы образца, являются толщина образца (т. е. длина трубки), концентрация (или плотность в случае индивидуальной жидкости), растворитель, температура и длина волны. Здесь достаточно сказать, что некоторые изменения удельного вращения, связанные с температурой, растворителем и концентрацией, обусловлены изменениями во внутримолекулярных водородных связях, а также в ассоциации или диссоциации, либо в обеих вместе. Необходимое и достаточное условие оптической активности молекулы состоит в том, что такую молекулу нельзя совместить с ее зеркальным изображением. Молекула, совместимая с ее зеркальным изображением, не может быть оптически активной, тогда как любая молекула, не совместимая с ее зеркальным изображением (с учетом возможности внутреннего вращения), обязательно обладает оптической активностью. Согласно теории групп, свойства симметрии данной молекулы позволяют решить вопрос о том, совместима она со своим зеркальным изображением или нет. Молекулу, обладающую плоскостью, центром или зеркально-поворотной осью симметрии, можно совместить с ее зеркальным изображением. Молекулу, которая лишена элементов симметрии или имеет только простую ось симметрии (и ни одного из трех вышеуказанных элементов симметрии) невозможно совместить с ее зеркальным изображением. Следовательно, возможны два пути решения вопроса, является ли данная молекула оптически активной. Один из них заключается в том, что строят модели молекулы и ее зеркального изображения. Если они взаимно совместимы, то молекула оптически неактивна, в противном же случае она обладает оптической активностью. Другой путь состоит в следующем: отыскивают в молекуле элементы симметрии; если в ней есть плоскость, центр или зеркально-поворотная ось симметрии, то она неактивна, а если же в ней эти элементы симметрии отсутствуют, то она оптически активна, даже если обладает простой осью симметрии. Молекулы представляющие собой взаимные зеркальные изображения, называются энантиоморфными или энантиомерами и известны также под названием оптических антиподов или антимеров. Они вращают плоскость поляризации света в противоположных направлениях, но обладают одной и той же абсолютной величиной удельного вращения.Поскольку молекула может быть оптически активной и в том случае, если она обладает простой осью симметрии, то, следовательно, неправильно говорить, что оптически активные молекулы лишены элементов симметрии. Поэтому лучше не пользоваться терминами “оптически активный” и “асимметрический”в применении к молекулам в одном и том же контексте (см. Молекулярная хиральность).
Перспективные проекции «лесопильные козлы»
Перспективные формулы для 3-бромбутанолов-2
При перспективном изображении молекула показана в трех измерениях, причем связь между асимметрическими атомами углерода направлена по диагонали, удаляясь от наблюдателя слева направо, и несколько увеличена по длине. На рисунке приведены формулы такого типа для 3-бромбутанолов-2. Формулы расположены произвольно таким образом, что объемные метальные группы максимально удалены друг от друга.
Поворотные изомеры (конформеры)
Эта область стереохимии развилась, можно сказать, "вопреки Вант-Гоффу", который считал, что существует свободное вращение вокруг простых связей. Не изменяя ни валентных углов, ни длин связей, можно представить себе множество геометрических форм молекул, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их связи. Поворот этот характеризуется двугранными углами.
В зависимости от величины двугранного угла могут существовать разные конформации молекулы, причем при наличии многих С–С-связей можно представить себе множество конформаций по каждой связи.Применяемый иногда для этого явления термин “поворотная изомерия”нельзя признать целесообразным. Изомеры – это вещества с одинаковой молекулярной формулой, но разными свойствами. Конформеры отличаются от изомеров тем, что не могут (как правило) изолированы в индивидуальном состоянии: они находятся в равновесии и легко переходят друг в друга.Конформационные явления имеют огромное значение в органической химии. Они характерны практически для любого органического соединения, начиная с простейших. Как только появилась С–С-связь (начиная с этана), возможно разное взаимное положение углеродных тетраэдров, т.е. существование конформеров. Если же учесть вращение вокруг простых связей атома углерода с поливалентными гетероатомами (кислород, азот и др.), то конформеры могут появиться даже у молекул с одним атомом углерода, например у метанола, метиламина. Конформационные особенности служат фундаментом при современном рассмотрении механизмов реакций.Вращение вокруг простых связей – не единственный внутримолекулярный процесс, который может приводить к изменению геометрической формы молекул. Другие процессы иного рода – растяжение и сжатие связей, инверсия ("выворачивание") пирамидальных структур, на пример, у соединений азота. В связи с этим в литературе можно встретить разные определения понятия "конформация", из которых наиболее целесоообразным представляется данное Н.С. Зефировым и В.И. Соколовым: под конформацией следует понимать любое относительное положение совокупности ядер молекул в пространстве, достижимое без нарушения целостности молекулы.Энергии различных конформаций неодинаковы, а поэтому неодинакова и вероятность нахождения молекулы в определенной конформаций. Явно неустойчивы заслоненные конформации. Они практически не участвуют в конформационном равновесии. Заторможенным конформациям соответствуют минимумы на кривой внутренней энергии; именно с этими конформациями приходится считаться при рассмотренни конформационного равновесия. Для изображения конформеров используют проекционные формулы Ньюмена.
Проекционные формулы Фишера
Для изображения оптических изомеров (энантиомеров) обычно используют проекционные формулы Фишера. Для перехода от модели одного из энантиомеров к формуле Фишера, надо ориентировать тетраэдр таким образом, чтобы горизонтальная пара связей была обращена к наблюдателю, а вертикальная – удалена от него. Существуют определенные правила: в случае гидроксикислот и их производных вверху помещают карбоксильную группу, или альдегидную в случае углеводов, а углеродную цепь располагают сверху вниз. Это расположение переносят на плоскость бумаги.
Правила преобразования формул Фишера
Проекционные формулы можно вращать в плоскости чертежа на 180°, не меняя их стереохимического смысла. Одна (или любое нечетное число) перестановок заместителей у асимметрического центра приводит к формуле оптического антипода; любое четное число перестановок не изменяет стереохимического смысла фомулы. Вместо перестановок проекционные формулы можно преобразовывать, вращая три заместителя по часовой стрелке или против нее. Проекционные формулы нельзя выводить из плоскости чертежа; нельзя, например, рассматривать их “на просвет”, с обратной стороны бумаги, так как при этом мы увидели бы формулу антипода.
Рацемическая модификация
это совокупность равных количеств правовращающих (+) и левовращающих (–) молекул одного и того же вещества. Очевидно, рацемические модификации существуют только на макроскопическом, а не на молекулярном уровне; отдельные молекулы, если они хиральны, являются либо право, либо лево ориентированными, но не ориентированными в обе стороны одновременно. Процесс перехода от энантиомера к рацемической модификации называется рацемизацией, является термодинамически выгодным и может быть осуществлен различными путями (например, при нагревании, под действием кислот, оснований и металлических катализаторов). Синтез хиральных соединений из ахиральных (при отсутствии хиральных реагентов) всегда приводит к рацемическим модификациям.
Формулы Ньюмена
В проекционной формуле Ньюмена молекулу рассматривают в направлении связи, соединяющей асимметрические атомы углерода. Таким образом, эти два атома точно заслоняют друг друга, и их изображают двумя накладывающимися друг на друга кругами (фактически на рисунке виден только один круг). Связи и группы, соединенные с асимметрическими атомами углерода, проектируются на плоскость чертежа, перпендикулярную связи, соединяющей асимметрические атомы углерода. Связи каждого атома углерода располагаются подобно спицам колеса под углом 120° друг к другу, причем связи удаленного атома углерода повернуты на 60° относительно связей ближнего атома углерода. Для того чтобы различить обе системы связей, связи ближнего атома углерода продолжают до пересечения в центре круга, а связи – удаленного атома углерода оканчивают на окружности. Проекционные формулы Ньюмена для 3-бромбутанолов-2 показаны на рисунке.
Заслоненные конформации энергетически невыгодны и в конформационном равновесии практически не участвуют.
Элементы симметрии
Классификация по группам симметрии основана на существовании или отсутствии определенных элементов симметрии, а именно простых осей, зеркально-поворотных осей, центров или плоскостей симметрии. Осью симметрии n-го порядка называется ось, проходящая через молекулу таким образом, что при повороте вокруг нее на угол, равный 360°/n, молекула возвращается в положение, не отличимое от исходного. В качестве примера можно привести равносторонний треугольник, который имеет ось третьего порядка, проходящую через его центр перпендикулярно плоскости треугольника, n может принимать любые целые положительные значения (например, 8 для правильного восьмиугольника) или быть неопределенным (например, для круга). Плоскостью симметрии называется плоскость, проходящая через молекулу таким образом, что половина молекулы по одну сторону от плоскости представляет собой зеркальное изображение другой (плоскость симметрии играет роль зеркала). Так, для книги плоскость, проходящая посредине между двумя обложками и разрезающая корешок переплета пополам, будет плоскостью симметрии (если пренебречь текстом). Центром симметрии называется точка внутри предмета, характеризующаяся тем, что проведенная через нее прямая от любого элемента при продолжении на равное расстояние от этой точки встречает идентичный элемент. Так, центр шара является центром симметрии. Зеркально-поворотной осью n-го порядка называется ось, при повороте вокруг которой на угол 360°/n и последующем зеркальном отражении в плоскости, перпендикулярной оси, структура, обладающая такой осью, дает идентичную структуру. Этот элемент симметрии не так легко наблюдать; в качестве примера можно привести квадратную деревянную доску с двумя право ориентированными винтами, ввинченными в нее с одной стороны на первом и третьем углах, и двумя лево ориентированными винтами, аналогично ввинченными с другой стороны на втором и четвертом углах перпендикулярно доске. (В данном случае это зеркально-поворотная ось четвертого порядка, которая проходит перпендикулярно доске через ее центр.) Можно показать математически, что любой предмет, имеющий плоскость, центр или зеркально-поворотную ось симметрии, можно совместить с его зеркальным изображением; поэтому молекулы с этими элементами симметрии не могут проявлять энантиомерию, т. е. не могут существовать в оптически активной форме. Действительно, были синтезированы молекулы с каждым из этих элементов симметрии и было найдено, что они оптически не активны. Такие молекулы можно называть симметричными, но лучше использовать термин недиссимметричные или ахиральные (т. е. лишенные хиральности). С другой стороны, молекулы, имеющие только простые оси симметрии или полностью лишенные элементов симметрии, нельзя совместить с их зеркальными изображениями. Такие молекулы являются хиральными, или диссимметричными, и проявляют энантиомерию (т. е. могут существовать в оптически активной форме). Ясно, что термин “асимметричный”, встречающийся в литературе, применим только к таким молекулам, которые не имеют осей симметрии.
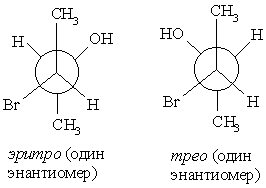
Эритро- и трео-изомеры
Названия эритро- и трео- происходят от названий углеводов эритрозы и треозы. Эти названия употребляют для указания взаимного положения заместителей у соединений с двумя асимметрическими атомами: эритро-изомерами называют те, у которых два одинаковых боковых заместителя стоят в стандартной проекционной формуле на одной стороне (справа или слева); трео-изомеры имеют одинаковые боковые заместители на разных сторонах проекционной формулы.
Два эритро-изомера представляют собой пару оптических антиподов, при их смешении образуется рацемат. Парой оптических антиподов являются и трео-формы, они тоже дают при смешении рацемат, отличающийся по свойствам от рацемата трео-формы. При дальнейшем росте числа асимметрических центров число пространственных изомеров возрастает, причем каждый новый асимметрический центр вдвое увеличивает число изомеров. Оно определяется формулой 2n, где n – число асимметрических центров.
