
ЗАНЯТИЕ 1
I. Тема: ХИМИЧЕСКОЕ СТРОЕНИЕ БЕЛКА
П. Цель занятия:
Изучить особенности строения и свойства природных аминокислот, усвоить принцип образования из них пептидов и белков
Использовать полученные знания для поникания сенов струю структурно-функционального многообразия белковых молекул.
Ш. План подготовки к занятию:
1. Общее понятие о белках. Их классификация и биологическая роль.
2. Аминокислоты, как структурны» единицы белковой молекулы.
3. Структура и биологические свойства пептидов. Представители.
4. Методы анализа белков (гидролиз, хроматография, солевое фракционирование, диализ, гельфильтрация, электрофорез, качественные цветные реакции на белки)
1У. Задания и упражнения:
1. Повторить формулы 20 универсальных аминокислот. Обратить внимание на альфа - углеродный атом, функциональные группы – NH2 и -COOH при чём и строение боковых радикалов ( R –групп).
2. Заполнить формулами аминокислот таблицу "Классификации аминокислот в соответствии с полярностью их R-групп. При заполнении таблицы отметить цветными карандашами ионогенные полярные группировки (-COOH, -NH2, -NH) неионогенные полярные группировки (-ОН, -SH –CONH2), неполярные радикалы (алифатические цепи, ароматические кольца, не содержащие функциональных групп).
Какие из них гидрофильны и легко гидратируются, а какие гидрофобные и не гидратируются?
Таблица
Классификация аминокислот в соответствии с полярностью их R -групп
|
||
Классификация аминокислот. |
Название |
Формула |
I. Неполярные R. -группы
|
||
1. Аланин
|
|
|
2. Валин
|
|
|
3. Лейцин
|
|
|
4. Изолейцин 5. Метионин
|
|
|
6. Фенилаланин
|
|
|
7. Триптофан
|
|
|
8. Пролин
|
|
|
II Неионогенные полярные R –группы
|
||
1. Глицин |
|
|
2. Серин |
|
|
3. Треонин |
|
|
4. Цистеин |
|
|
5. Тирозин |
|
|
6. Аспарагин |
|
|
7. Глутамин |
|
|
III. Ионизированные (отрицательно заряженные) полярные R. -группы |
||
1. Аспарагиновая кислота |
|
|
2. Глутаминовая кислота |
|
|
IV. Ионизированные (положительно заряженные) полярные R, -группы |
||
1. Аргинин |
|
|
2. Лизин |
|
|
3. Гистидин |
|
|
3. Выучить буквенные сокращенные названий аминокислот.
4. Написать тетрапептид: ала-сер-про-фен.
Обратить внимание:
1) на излом полипептидной цепи в месте включения пролин
2) на отсутствие атома водорода при атоме азота аминогруппы пролина, образующей пептидную связь с серином.
5. Изучить следующий пептид; назвать его:
H2N-CH-CO-NH-CH2-CO-NH-CH-CO-NH-CH—C-NH—CH-COOH
CH2OH CH2
CH3 O
CH2
CH
CH3
CH3





Выделить в нем цветными карандашами пептидов связи и R -группы. Отметить N -конец (со свободной NH2-группой и C конец со свободной СОOH группой). Указать гидрофобные и гидрофильные радикалы.
6. Познакомиться со схемой диссоциации пептида, общая формула которого
 COOH
COOH

 R
COOH
R
COOH
NH2




 COO-
+OH
COO +H+ COOH
+H+ COOH
COO-
+OH
COO +H+ COOH
+H+ COOH
R











 —COO-
R--COO
pH<7 R COO R COOH
—COO-
R--COO
pH<7 R COO R COOH
NH2 pH>7 NH3 NH3 pH<7 NH3
7.Написать формулу пептида: ала-глу-асн-лиз. Амино и карбокси - группы в боковых радикалах представить в ионизированном состоянии при рН = 7,0. Определить, как заряжен пептид?
Как изменится его заряд при рН > 7,0, при рН < 7,0?
8.Изучить следующую таблицу и объяснить, от чего зависит биологическая активность и специфичность указанных пептидов.
Таблица
Некоторые природные пептиды, обладающие
высокой биологической активностью
Название |
Строение |
Действие |
Вазопрессин |
цис-тир-фен-гли-асп-цис- про-лиз-гли-NH2. |
Антидиуретическое |
Окситоцин |
цис-тир-иле-глн-асн-цис-про-лей-гли-NH2
|
Стимулирует сокращение матки |
Брадикицин |
арг-лро-про-гли-фен-сер - про-фен-арг |
Противовоспалительное |
Энкефалин |
тир-гли-глу-фен-мет |
Анальгезирующее |
9. Назвать:
а) универсальные цветные реакции на белки;
б) специфические цветные реакции на аминокислоты. Объяснить, для каких целей используют эти две группе цветных реакций?
10. Объяснить, что такое гидролиз белков. Почему он является одним из важнейших методов исследования белков? Написать схему кислотного гидролиза белка. Объяснить, под контролем, какой цветной реакции следует вести гидролиз.
11. Вспомнить основы хроматографического анализа аминокислот.
С какой целые применяют этот метод анализа белков?
Какую цветную реакцию используют для идентификации аминокислот при хроматографическом анализе?
12. Написать формулу пептида, дающего следующие положительные цветные реакции:
а) биуретовую
б) ксантопротеиновую
в) Миллона
г) Фоля.
У. Литература:
1. Конспекты лекций.
2.Т.Т.Березов, Б.Ф.Коровкин "Биологическая химия", 1982 г., с.10-73, 630-632.
Дополнительная литература
1. Уайт "Основы биохимии", 1981 г., т.1, с.94-205.
2. Страйер "Биохимия", 1985 г., т.1, с.13-85.
3. Ленинджер "Основы биохимии", 1985 г., т.1, с.107-119,
ЗАНЯТИЕ № 2 Тема: ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Цель занятия:
Изучить особенности пространственной организации белковых молекул. Знать свойства нативного белка, факторы, вызывающие его денатурацию и механизм реакций осаждений.
План подготовки к занятию:
1. Уровни структурной организации белковой молекулы,
2. Силы, стабилизирующие нативную структуру белка.
3. Взаимосвязь между уникальной структурной организацией белков и их нативными свойствами.
4. Физико-химические свойства белков (заряд, гидратация, растворимость, факторы устойчивости в растворах).
5. Денатурация. Признаки денатурации. Факторы, вызывающие
I денатурацию.
6. Реакции осаждения белков:
а) высаливание
б) реакции необратимого осаждения.
Задания и упражнения:
1. Назвать уровни организации белковых молекул. Дать определение каждому из них.
2. Какие из перечисленных типов внутримолекулярных взаимодействий стабилизируют первичную, вторичную, третичную и
четвертичную структуру белка:
1. Пептидные
2. Дисульфидные
3.Водородные
4. Ионные
5. Гидрофобные
3. Изучить приведенный ниже пептид и определить, в образовании каких связей могут участвовать R-группы составляющих его аминокислот:

4. Среди предложенных аминокислот: асп, фен, лей, глу, илей, асн, глн, мет, лиз, вал, три, про выбрать высокогидрофильные и высокогидрофобные кислоты.
5. Чем обусловлена различная растворимость глобулярных и фибриллярных белков?
6. Какая аминокислота всегда находится на месте изгиба полипептидной цепи в молекулах глобулярных белков?
7. Назвать факторы устойчивости белков в водных растворах.
0. Почему изоэлектрическая точка различна для разных белков?
9. Написать тетрапептид асп-глу-тре-ала. В какой среде лежит его ИЭТ? Почему, белок наименее устойчив в изоэлектрическом состоянии?
10. Какие, из перечисленных физико-химических свойств белков обуславливают степень их гидратации?
1. Заряд
2. М.масса
3. Тип внутримолекулярных связей
4. Форма молекулы
5. Наличие полярных групп.
11. В молекулах всех белков есть центры связывания (активный центры) с разнообразными веществами (лигандами).
Знать, что:
а) эти активные центры представляют собой уникальное сочетание определенных аминокислотных остатков;
б) связи между белком и лигандом могут быть ковалентными, сложноэфирными, гликозидными, амидными) и нековалентными (водородными, ионным, гидрофобными);
в) белки проявляют высокую избирательность (специфичность по отношению к различным лигандам.
г) высокая специфичность обеспечивается химическим и пространственным соответствием (комплементарностью) структуры активного центра белка структуре лиганда
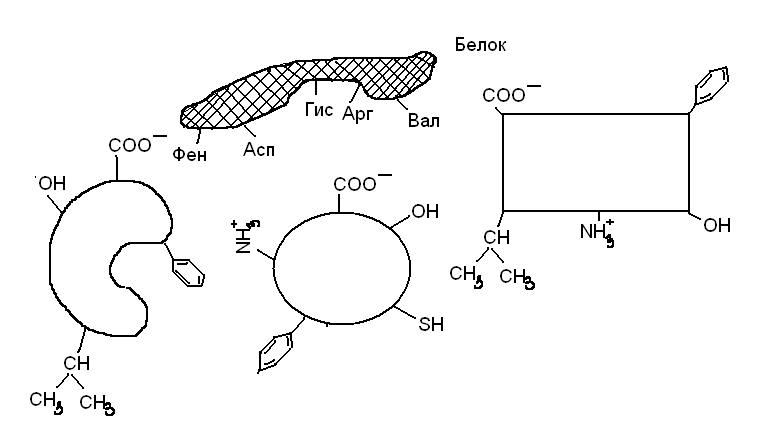
Изучить схему активного центра белка, ответить на вопросы:
1) Какой из перечисленных лигандов с наибольшей вероятностью будет взаимодействовать с активным центром данного белка?
2) Назовите типы связей между белком и лигандом.
3) На каком уровне организации белковой молекулы формируется ее активный центр?
12. Что такое обратимое осаждение, чем его можно вызвать, меняются ли нативные свойства белка при таком осаждении?
13. Дать определение денатурации. Какие уровни пространственной организации белка нарушаются при этом процессе?
14. Что обшего и чем отличаются друг от друга (по признакам) процессы высаливания и денатурации'
А - высаливание 1. Выпадение в осадок
В - для денатурации 2. Нарушение конформации
С - для обоих процессов 3. Растворение после диализа
Д - ни для одного 4. Сохранение нативной конформации
5. Гидролиз пептидных связей
Подберите каждой цифре буквенный ответ
15. Почему при отравлении солями свинца к мути рекомендуется принимать яичные и молочные белки с последующим промыванием желудка?
Литература
1. Конспекты лекций
2. Т.Т.Березов, Б.Ф.Коровкин "Биологическая химия"
Дополнительная литература
1. Уайт. "Основы биохимии
2. Страйэр "Биохимия
3. Ленинджер "Основы биохимии"
ЗАНЯТИЕ № 3 Тема: СЛОЖНЫЕ БЕЛКИ. ГЛИКО и ЛИПОПРОТЕИНЫ
Цель занятия:
Ознакомиться с классификацией сложных белков. Изучить строение и свойства простетических групп глико- и липопротеинов.
Знать биологические функции этих белков. Использовать эти знания, для понимания последующих разделов биохимии "Ферменты", 'Биологические мембраны", "Соединительная ткань".
План подготовки к занятию:
1. Классификация сложных белков.
2. Углеводсодержащие протеины. Структура простетических групп:
а), резервный гомополисахарид гликоген. Его структура и биологическая роль;
б) гликопротеины. Структура углеводов, входящих в состав их простетических групп. Биологическая роль;
в) протеогликаны. Структура простетических групп. Биологическая роль.
3. Липопротеины. Химическая характеристика простетических групп:
а) простые омыляемые липиды;
б) сложные омыляемые липиды (фосфолипиды, сфинголипиды, гликолипиды);
в) неомыляемые липиды.
4. Структура и функции липопротеинов:
а) плазмы крови;
б) биологических мембран.
Задания и упражнения:
1. Что такое "Сложные белки", чем они отличаются от простых. Приведите примеры простетических групп белков.
2. Написать фрагмент молекулы гликогена, указать точки ветвления, охарактеризовать тип связи между остатками глюкозы, какова его биологическая роль?
3. Изучать таблицу "Структурные компоненты простетических групп углеводсодержащих белков".
Гликопротеины |
Протеогликаны |
1. Моносахариды (глюкоза, галактоза, манноза) |
I. Гиалуроновал кислота (β - глюкуроновая. кислота + β ацетил-Д-гдюкозамин) |
2. Олигосахариды (мальтоза, лактоза, сахароза) |
2. Хондроитинсульфат (β-Д - галктуроновая кислота + N - ацетил-Д-глюкозамин-6-сульфат) |
3. Ацетилированные аминопроизводные Моносахаридов (N ацетилглюкозамин, N ацетил-галктозамин, N ацетилманноз - Амин) |
3. Гепарин ( 2-сульфат-Д- глюкуроновая кислота + N- сульфат-Д-глюкозамин-6-фосфат)
|
4. Дезоксисахароза (6-дезоксигалактоза- Фукоза) |
|
5. Нейраминовые и сиаловые кислоты.
|
|
Написать формулы указанных в таблице структурных компонентов гликопротеинов и дисахаридные единицы протеогликанов.
4. Назвать типы связей углеводов с белковой частью в молекулах углеводосо держащих белков.
5. Привести примеры гликопротеинов и протеогликанов. Охарактеризовать их функции.
6. Привести примеры омыляемых и неомыляемых липидов, назвать типы связей в молекулах омыляемых липидов.
7. Написать структурные формулы простого и смешанного триацилглицерина. В чем биологическая роль резервных липидов?
8. Напишите структурные формулы наиболее распространенных жирных кислот природных липидов:
1) Пальмитиновая
2) Стеариновая
3) Цереброновая
4) Олеиновая
5) Линоленовая
6) Арахидоновая
7) Линолевая
8) Нервоновая.
Как отражается строение жирных кислот на свойствах липидов. Написать структурную формулу фосфатидной кислоты.
10. Написать формулы:
а) фосфатидилсерина
б) фосфатидилэтаноламина
в) фосфатидилхолина
г) сфингомиелена
д) галактоцереброзида.
Охарактеризовать взаимосвязь между ними.
В написанных молекулах липидов отметить гидрофильные (полярные) и гидрофобные (неполярные) части.
11. Написать формулу холестерина и назвать биологически активные производные этого липида.
12. Назвать типы плазменных липопротеинов (1,2,3,4) Чем они отличаются друг от друга по составу и функциям?
13. Какие липида входят в состав биологических мембран?
14. Какова функция плазменных и мембранных липидов?
15. Охарактеризовать типы связей, стабилизирующих молекулы липопротеинов.
Литература
1. Конспекты лекций
2. Березов T.T, Коровкин Е.Ф. "Биологическая химия", I982 г.
Дополнительная литература
1. Уайт “Основы биохимии”, I98I
2. Ленинджер "Основы биохимии 1965 г.
3. Страйер "Биохимия", I985 г.
ЗАНЯТИЕ № 4
Тема: СЛОЖНЫЕ БЕЛКИ НУКЛЕО -, ФОСФО -, ХРОМОПРОТЕИДЫ
Цель занятия:
1. Изучить структуру и функции сложных белков (нуклео, фосфо -, хромопротеидов),
2. Изучать строение простетической группы и характер связи ее с белковым компонентам, в нуклео -, фосфо -, хромопротеидах.
План подготовки к занятию:
1. Строение и функции фосфопротеидов:
а) простетическая группа фосфопротеидсв;
б) характер связи простатической группы с белком;
в) представители фосфопротеидов их биологическое знание.
2. Строение и функции хромопротеидов:
а) простетические группы хромопротеидов (гем, ФАД, ФМН - понятие);
б) строение гема;
в) гемоглобин, его виды, функция Нв;
г) другие представители хромопротеидов, их функции в организме.
3. Строение и функция нуклеопротеидов;
а) простетическая группа нуклеопротеидов – нуклеиновые кислоты;
б) виды нуклеиновых кислот;
в) отличия в структуре РНК и ДНК;
г) первичная, вторичная и третичная структура НК;
д) белки нуклеопротеидов (HП) и особенности их строения;
а) характер связи простетической группы и белкового компонента нуклеопротеидов;
ж) локализация НП в клетке и их функция.
Вопросы, упражнения, задания:
1. Как связана простатическая группа фосфопротеидов с шелковым компонентом? Показать ее на примере аминокислоты треонина. С какой аминокислотой полипептидной цепи наиболее часто связывается простатическая группа фосфопротеидов? Роль фосфопротеидов в питании ребенка.
2. Написать формулу гема. Отметить характер связи между гемом и глобином. Объяснить за счет чего Fе2+ гемма может удерживать полипептидную цепь,
3. Виды гемоглобинов организма человека;
а) гемоглобин А
б) гемоглобин F
в) гемоглобин Р
г) патологические виды Нв.
4. Перечислить гемсодержащие хромопротеиды. Какие яз них выполняют функцию ферментов? В каких процессах? Какие из гемосодержащих хромопротеидов не выполняют ферментативной функции?
5. Какие продукты получаются на начальных стадиях гидролиза НП?
Написать гидролиз гуанилового нуклеотида., входящего в состав РНК; какие связи гидролизуются?
7. Написать фрагмент нуклеотидной цепи, содержащей тимидиловый, цитидиловый, адениловый нуклеотиды. В состав какого вида НК входит этот фрагмент?
Заполнить таблицы.
Таблица 1
Название класса сложного белка
|
Какими веществами представлена простетич .группа |
Особенности строения белкового компонента |
Характер связи между простетической группой и белковым компонентом |
1.Фосфопротеиды |
|
|
|
2.Хромопротеиды
|
|
|
|
3.Нуклеопротеиды |
|
|
|
Таблица 2
Хоромопротеиды |
|||
Виды хромопротеидов |
ферменты |
не ферменты |
Функции в организме |
Содержащие гем |
|
|
|
Содержание вит. В2 |
|
|
|
Таблица3
Нуклеопротеиды |
|
Продукты начальной стадии гидролиза |
|
продукты полного гидролиза |
|
Литература
1. "Биологическая химия", Т.Т.Березов, Б.Ф.Коровкин, М., "Медицина", 1982 г., с.77-78, 36-39, 94-113, 237-290,
2. "Биологическая химия", Е.А.Строев. М., "Высшая школа", 1985г., с.69-84, 102-103.
3. Лекции по теме «Сложные белки»
Дополнительная литература
1. "Основы биохимии" под редакцией проф. А.А.Анисимова, М., "Высшая шкала", 1986, 120-123, 178-200.
2. "Биологическая химия", Ленинджер.
Практическое занятие 5.
Коллоквиум по теме: «Белки».
Вопросы:
Белки – основа всех процессов жизнедеятельности.
Биологические функции белков.
Классификация белков (по Физико-химическим свойствам, функциональным и структурным признакам).
Аминокислоты – структурные мономеры белков. Зависимость структурной организации и физико-химических свойств белков от аминокислотного состава.
Уровни структурной организации белков и силы, их стабилизирующие
Физико-химические свойства белков (амфотерность, размер молекул, буферные свойства, коллоидные и осмотические свойства, вязкость, гидратация, растворимость).
Связь уникальной организации белковой молекулы с ее нативными свойствами.
Отличие белков от пептидов. Физико-химические и биологические критерии.
Специфические реакции на белки. Качественные цветные реакции и реакции осаждения. Принцип методов.
Представители глобулярных белков. Особенности их структурной организации.
Представители фибриллярных белков. Особенности их структурной организации.
Понятие о денатурации. Факторы, вызывающие денатурацию. Признаки денатурации.
Факторы устойчивости белков в растворах. Методы обратимого и необратимого осаждения белков.
Методы выделения и очистки белков (гомогенизация, экстракция, высаливание, диализ, ионообменная хроматография, гель-хроматография, электрофорез).
Методы изучения структуры белков (гидролиз, спектрополяриметрия, УФ-спектрофотометрия, ИК-спектрофотометрия, электронная микроскопия, хроматография, рентгеноструктурный анализ, электрофорез).
Классификация сложных белков.
Структурная организация гликопротеинов. Тип связи простетической группы с белком. Биологические функции. Представители.
Структурная организация протеогликанов. Распространение в организме. Биологические функции.
Классификация и свойства липопротеинов. Структурные компоненты небелковой части. Характер связи с белком.
Характеристика липопротеинов плазмы крови.
Функции плазменных липопротеинов.
Липопротеины клеточных мембран. Структура и функции.
Фосфопротеины. Особенности структуры. Характер связи небелковой части с белком. Представители. Биологические функции.
Структурная организация хромопротеинов. Классификация. Представители.
Гемопротеины. Строение гема, характер связи с белком. Представители, их биологические функции.
Гемоглобин, структура и функции. Типы гемоглобинов. Отличие от миоглобина.
Представители геминовых ферментов. Их биологическая роль.
Флавопротеины. Структура и функции. Представители.
Металлофлавопротеины. Структура. Представители.
Представление о структуре ДНК и РНК. Природа белкового компонента. Локализация в клетке.
Общая характеристика нуклеиновых кислот (ДНК и РНК). Физико-химические свойства нуклеиновых кислот. Денатурация и реактивная гибридизация и ее практическое значение.
Характеристика белков, входящих в состав ДНК и РНК. Природа химической связи между белком и простетической группой в нуклеопротеинах.
Компоненты нуклеиновых кислот. Сходство и различие в компонентах РНК и ДНК. Понятие о минорных основаниях и их роль в функционировании ДНК и РНК.
Нуклеотиды – структурные блоки нуклеиновых кислот. Свободные нуклеотиды и их биологическое значение.
Строение и уровни организации ДНК. Работы Чаргаффа, Уотсона, Крика. Природа сил, поддерживающих макромолекулярную структуру ДНК.
Биологическая роль нуклеиновых кислот (ДНК, мРНК, рРНК, тРНК).
Строение и уровни организации РНК. Классы РНК, их биологическая роль.
Вторичная структура ДНК (написать фрагмент двойной спирали). Работы Уотсона и Крика (1953). Характеристика двойной спирали.
тРНК, специфика их структурной организации и биологическая роль.
Строение рибосом и значение мРНК.
Проанализировать схему полного гидролиза ДНК.
Структурная организация ДНК в хромосомах (понятие о нуклеосомах, привести схему ее строения).
Пуриновые и пиримидиновые основания, входящие в состав нуклеиновых кислот. Понятие о нуклеотидах и нуклеозидах.
мРНК, строение и функция, локализация в клетке.
ЗАНЯТИЕ 6
Тема: «ОБЩИЕ СВОЙСТВА ФЕРМЕНТОВ. ВЛИЯНИЕ рН И ТЕМПЕРАТУРЫ СРЕДЫ НА АКТИВНОСТЪ ФЕРМЕНТОВ»
Цель занятия:
Изучить структуру и общие свойства ферментов. Ответить сходство и различие ферментов с белковыми катализаторами. Выявить влияние температуры и рH среды на активность ферментов. План подготовки к занятию:
I» Биологическая роль и химическая природа ферментов.
2. Сходство и различие ферментов с небиологическими катализаторами
3. Влияние температуры и рН среды на активность ферментов.
4. Классификация и номенклатура ферментов.
5. Изоферменты.
Задания и упражнения:
1. Что такое фермент?
2.Что таксе энергетический барьер реакции- как он преодолевается? Энергия активации, как ока меняется, а процессе катализа?
3. Что происходит с ферментами при действии температуры 1000С? ,
4.Какие связи разрушаются в молекуле, крахмала под действием амилазы?
5. Какие связи разрушаются в молекуле сахарозы под действием сахаразы?
6. Какие связи в белке рвутся При действии протеазы?
7. В какой класс ферментов следует включить сахаразу, мальтазу, уреазу, амилазу?
8. Определение, каких ферментов может иметь Значение для клиники?
9. Как называются ферменты, катализирующие одну и ту же реакцию, но отличающиеся по некоторым физико-химическим свойствам?
10. Каково оптимальное значение рН для действия амилазы слюны?
11. Написать уравнение реакции ферментативного Гидролиза крахмала
12. Написать уравнение реакции гидролиза мочевины уреазой.
13 Что понимают под общими свойствами ферментов?
14. Какой принцип положен в основу современной систематической номенклатуры ферментов?
15. Чем можно подтвердить белковую природу ферментов?
Литература
Г. Лекции по биохимии по теме "Ферменты".
2. "Биологическая химия", Т.Т.Березов, Б.Ф.Коровкин, с.114-122, 129-132, 141-144, 161-165.
3. "Биологическая химия", Е.А.Строев, с.122-129.
ЗАНЯТИЕ № 7
Тема: ОБЩИЕ СВОЙСТВА ФЕРМЕНТОВ. СПЕЦИФИЧНОСТЬ. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ"
Цель занятия:
Изучить структурно-функциональную организацию ферментов и механизм их действия. Объяснить действие активаторов и ингибиторов на активность ферментов.
План подготовки к занятию:
1. Структурно-функциональная организация ферментов.
2. Активный и аллостерический центры ферментов.
3. Специфичность и ее виды.
4. Активаторы и ингибиторы ферментов.
Задания и упражнения:
1. Что такое активный центр ферментов?
2. Какая пространственная структура белка необходима для создания активного центра ферментов?
3. Как называется участок активного центра ферментов, к которому присоединяется субстрат?
4. Какой участок фермента обеспечивает химические превращения субстрата?
5. Что такое специфичность ферментов и какие факторы ее определяют?
6. Какая специфичность называется абсолютной, относительной, стереохимической?
7. Какова роль молекулярной структуры апофермента, не участвующего в формирований активного центра фермента?
8. Что такое аллостерический центр и какова его роль в активности фермента?
9. Каков механизм действия активаторов ферментов?
10. Что такое конкурентное и неконкурентное игибирование?
11. В чем сущность действия некоторых лекарственных веществ и функцию ферментов?
Литература
I.Лекции по биохимии по теме «Ферменты»
II. "Биологическая химия", Т.Т.Березов, Б.Ф.Коровкин, с.114-122, 129-132, 141-144, 161-165.
III. Биологическая химия Е.А.Строев, с 122-129.
ЗАНЯТИЕ № 8
Тема: «Применение ферментов в медицинской практике. Энзимодиагностика. Энзимотерапия. Энзимапатия»
Цель занятия:
Изучить пути использования ферментов в медицинской практике для диагностики заболеваний, в качестве лекарственных препаратов; изучить заболевания, связанные с нарушением действия ферментов.
План Подготовки К Занятию Ферменты сыворотки крови. Классификация причины появления тканевых ферментов в крови.
Энзимодиагностика. Изоферменты, их использование в диагностике заболеваний.
Активность ферментов. Принципы определения активности ферментов.
Единицы активности ферментов (катал, международные единицы, понятие об удельной активности ферментов).
Энзимопатии. Причины и проявления фенилкетонурии.
Применение ферментов в клинической практике. Энзимотерапия.
Лактатдегидрогеназа, креатинфосфокиназа, их изоферменты. Трансаминазы. Клиническое значение определения активности этих ферментов.
Задания и упражнения.
Ферменты сыворотки крови. Классификация причины появления тканевых ферментов в крови.
Энзимодиагностика. Изоферменты, их использование в диагностике заболеваний.
Активность ферментов. Принципы определения активности ферментов.
Единицы активности ферментов (катал, международные единицы, понятие об удельной активности ферментов).
Энзимопатии. Причины и проявления фенилкетонурии.
Применение ферментов в клинической практике. Энзимотерапия.
Лактатдегидрогеназа, креатинфосфокиназа, их изоферменты. Трансаминазы. Клиническое значение определения активности этих ферментов.
