
- •Введение в обмен веществ. Биологическое окисление.
- •Катаболических (экзергонических) реакций;
- •Анаболических (эндергонических) реакций.
- •Дегидрирование - отщепление от субстрата атомов водорода:
- •Присоединение к веществу кислорода (одного атома или двух):
- •Дыхательная цепь
- •Блок-схема дыхательной цепи
- •Переносчики электронов
- •Механизм окислительного фосфорилирования
- •Строение дыхательной цепи и механизм окислительного фосфорилирования
Механизм окислительного фосфорилирования
На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования:
1. Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов.
2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.

Строение дыхательной цепи и механизм окислительного фосфорилирования
3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по которой электроны движутся (50-200 шт/сек) к своему конечному акцептору – кислороду. В результате образуется вода.
4. Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию.

Энергетические соотношения в дыхательной цепи митохондрий и участки переноса ионов Н+ через мембрану
Часть энергии электронов используется I, III, IV комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное представить в виде равенства:
![]()
5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосфорилирования). Они представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией.
Градиент (Δμ, "дельта мю") получил название электрохимический градиент или протонный градиент. Он имеет две составляющие – электрическую (ΔΨ, "дельта пси") и концентрационную (ΔрН):
Δμ = ΔΨ + ΔрН
Название "участки сопряжения" возникло из-за того, что появление протонного градиента в результате окислительных процессов обеспечивает в дальнейшем фосфорилирование АДФ до АТФ. Именно благодаря этим трем ферментным комплексам энергия реакций окисления может передаваться на фосфорилирование, т.е. существует сопряжение (связывание) двух процессов.
6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу (Н+-транспортирующая АТФ-аза, КФ 3.6.3.14.). Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла:
![]()
Структурная организация цепи переноса электронов
Электроны, мигрирующие по дыхательной цепи, движутся по сложным траекториям. Особенность их движения состоит в петлеобразных движениях в пределах каждого из ферментативных комплексов дыхательной цепи. В каждый комплекс поступают 4 протона на одну пару электронов.
Комплекс I (F-цикл). Суммарно можно представить, что молекула НАДН вносит 2 электрона в митохондриальную мембрану, еще 2 электрона поступают от FeS-
белков и вместе с 4 протонами из матрикса совместно с 2 молекулами ФМН образуют комплекс ФМН-Н2, который перемещается к внешней поверхности мембраны.

Вблизи от поверхности мембраны комплекс распадается на 2 пары электронов, 4 протона и 2 ФМН.
Следует учитывать, что в комплексе I присутствует одна молекула ФМН, которая успевает 2 раза переместиться поперек мембраны, чтобы перенести 4Н+. Две пары электронов связываются двумя FeS-белками, имеющими более высокий электрохимический потенциал и переносятся к внутренней стороне мембраны к ФМН (одна пара электронов) и коэнзиму Q (вторая пара электронов). ФМН возвращается обратно, а протоны не имеют центров связывания и поэтому покидают мембрану. Участки выброса протонов из мембраны представляют собой 10-14 параллельных а-спиральных участков полипептидный цепей, поднимающихся от ферментативных комплексов перпендикулярно внешней стороне мембраны. Протоны передаются в межмембранное пространство по системе водородных связей, стабилизирующих а-спиральные участки.
Комплекс III (Q-цикл). Через систему FeS-белков 2е" (от комплекса I) переносятся к внутренней поверхности мембраны и с 2 протонами из матрикса взаимодействуют с коэнзимом Q (убихиноном), формируя комплекс QH2;, который представляет собой восстановленный убихинон. Еще одна молекула QH2 формируется в результате взаимодействия 2е" (их переносят в комплекс III цитохромы bj и Ь2), с 2 протонами из матрикса и коэнзимом Q. Убихинон, являясь подвижным переносчиком электронов и протонов, переносит их к внешней митохондриальной мембране, где происходит распад этой молекулы. В области внешней стороны мембраны 2 молекулы QH2, распадаются на 2е", 4 протона и 2 молекулы Q*~ (се-михинона). Электроны перехватывают FeS-белки (они содержат 2 Fe2S2 центра). Протоны покидают мембрану, а 2 молекулы Q' ~ передают 2 электрона цитохро-мам Ь] и Ь2 которые, в свою очередь, переносят их к коэнзиму Q. 2 Молекулы се-михинона (Q'"), передав свои неспаренные электроны цитохромам Ъ\ и Ь2, превращаются в форму коэнзима Q и возвращаются к внутренней стороне мембраны. Два электрона через FeS-белки мигрируют к цитохрому С\. Цитохром Q, в свою очередь, передает электроны цитохрому С, который перемещается по внешней поверхности мембраны и является подвижным переносчиком электронов между III и IV комплексами.
Комплекс IV (О-цикл). В IV комплекс электроны вносит цитохром С. Через цитохромы а и а3 электроны поступают к внутренней поверхности мембраны, где совместно с протонами и молекулой кислорода превращаются в пероксид водорода (Н2О2). Он мигрирует к внешней поверхности мембраны и вновь распадается на кислород, электроны и протоны. Протоны выталкиваются из мембраны, а электроны с помощью цитохромов а и а3 вновь доставляются к внутренней поверхности мембраны где, уже утратив свою высокую энергию, взаимодействуют с кислородом и протонами из матрикса и образуют эндогенную воду. Особенность функционирования IV комплекса состоит в переносе через мембрану только 2-х протонов из матрикса. Это объясняется тем, что два другие протона из 4-х поступающих в IV комплекс расходуются на образование воды.
Протонный цикл - замкнутый процесс перемещения Н+ в митохондриях. Функцией протонного канала является первичное запасание энергии электронов в виде мембранного потенциала с последующим использованием ее для синтеза АТФ, а также для переноса веществ через митохондриальную мембрану (каналы транспортных систем).
Строение АТФ-синтазы и синтез АТФ
АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1.
Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
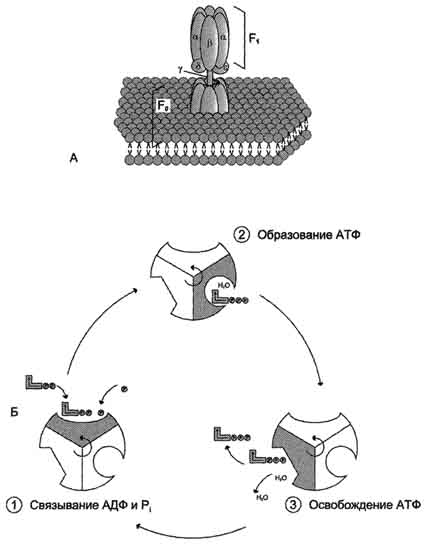
Строение и механизм действия АТФ-синтазы. А - F0 и F1 - комплексы АТФ-синтазы, В состав F0 входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β ("головка"), прикрывающие стержневую часть, которая состоит из 3 субъединиц γ, δ и ε. γ и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ. Б - Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 - связывание АДФ и Н3РО4; 2 - образование фосфоангидридной связи АТФ; 3 - освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ.
Дыхательный контроль
Работа дыхательных ферментов регулируется с помощью эффекта, который получил название дыхательный контроль.
Дыхательный контроль – это прямое влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ и АДФ, количественная сумма которых в клетке практически постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Возрастание протонного градиента возникает при снижении количества АДФ и накоплении АТФ (состояние покоя), т.е. когда АТФ-синтаза лишена своего субстрата и ионы Н+ не проникают в матрикс митохондрии. При этом ингибирующее влияние градиента усиливается и продвижение электронов по цепи замедляется. Ферментные комплексы остаются в восстановленном состоянии. Следствием является уменьшение окисления НАДН и ФАДН2 на I и II комплексах и замедление катаболизма в клетке.
Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ , т.е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+. При этом градиент, естественно, снижается, поток электронов возрастает, в результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое "проваливание" через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН и ФАДН2 (как источников электронов) и снимается ингибирующее влияние НАДН на цикл лимонной кислоты и пируватдегидрогеназный комплекс. Как итог – активируются реакции катаболизма углеводов и жиров.
Коэффициент Р/О (коэффициент окислительного фосфорилирования) является мерой эффективности дыхания как поставщика энергии для синтеза АТФ. Коэффициент Р/О (или Р/2е) численно равен отношению количества синтезированного АТФ к количеству атомов потребленного кислорода. Чем выше коэффициент, тем больше синтезируется АТФ в расчете на каждую пару перенесенных электронов. В случае полной дыхательной цепи Р/О близок к 3, в случае укороченной к 2.
Микросомальное окисление
Окисление может происходить не только в митохондриях, но и в микросомах и пероксисомах. В этих структурах тоже имеются цепи транспорта электронов (т.е. процесс окисления), но не ведущие к синтезу АТФ. Эти цепи включают НАДФ, ФМН, ФАД, FeS-белки, аскорбиновую кислоту, цитохромы другие: b5 , P450. Цель этих цепей окисления: окисление циклических веществ, чтобы сделать их более растворимыми для выведения через почки, гидроксилирование - для тех же целей стероидных гормонов, обезвреживание токсинов, лекарственных веществ, чужеродных молекул (ксенобиотиков).
