
- •15 Біосинтез пуринових нуклеотидів
- •16 Біосинтез піримідинових нуклеотидів
- •17 Біосинтез дезоксирибонуклеотидів
- •18 Катаболізм нуклеотидів
- •19 Біологічне значення реплікацїї днк. Напівконсервативний механізм реплікації
- •20 Послідовність етапів ферменти реплікації днк у прокаріотів та
- •21 Ферменти та механізми транскрипції рнк
- •22 Сигнали транскрипції процесинг
1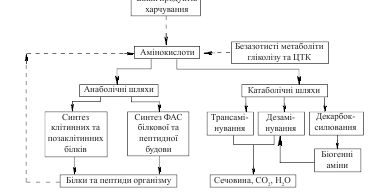 .
Потік амінокислот, що виходить з
амінокислотного пулу, включає анаболічні
і катаболічні шляхи перетворення
вільних амінокислот і складається з
таких
компонентів:
1. Використання
амінокислот для синтезу білків організму.
Цей потік у дорослих людей, що споживають
збалансовану дієту, забезпечує покриття
протеолізу
власних
білків — стан азотистої рівноваги. Для
синтезу власних ферментних,
структурних
білків та фізіологічно активних сполук
білкової і пептидної природи
(на анаболічні
потреби) використовується близько
75-80 % амінокислот, що вивільняються при
розщепленні тканинних білків, та
амінокислот, які надходять із
кишечника.
2. Використання
амінокислот, які не включені в анаболічні
процеси, в катаболічних реакціях. При
цьому молекули амінокислот розщеплюються
з утворенням
діоксиду
вуглецю, води (через цикл лимонної
кислоти) та кінцевих продуктів
азотистого
обміну (у людини — переважно сечовини).
Певна частина безазотистого вуглецевого
скелета амінокислот використовується
для утворення глюкози(глюконеогенезу)
та кетонових тіл (кетогенезу).Розщепленню
підлягають усі амінокислоти, що не
використовуються для синтезу білків
або фізіологічно активних сполук (ФАС)
незалежно від джерела походження,
оскільки резерви білків у тваринних
організмах не утворюються (на
відміну
від вуглеводів та ліпідів). Разом з тим,
біоенергетичне значення катаболізму
амінокислот у здорової людини незначне,
порівняно з вуглеводами та ліпідами
(близько 10 % від загальних енергетичних
потреб), суттєво збільшуючись
лише за
умов голодування..
.
Потік амінокислот, що виходить з
амінокислотного пулу, включає анаболічні
і катаболічні шляхи перетворення
вільних амінокислот і складається з
таких
компонентів:
1. Використання
амінокислот для синтезу білків організму.
Цей потік у дорослих людей, що споживають
збалансовану дієту, забезпечує покриття
протеолізу
власних
білків — стан азотистої рівноваги. Для
синтезу власних ферментних,
структурних
білків та фізіологічно активних сполук
білкової і пептидної природи
(на анаболічні
потреби) використовується близько
75-80 % амінокислот, що вивільняються при
розщепленні тканинних білків, та
амінокислот, які надходять із
кишечника.
2. Використання
амінокислот, які не включені в анаболічні
процеси, в катаболічних реакціях. При
цьому молекули амінокислот розщеплюються
з утворенням
діоксиду
вуглецю, води (через цикл лимонної
кислоти) та кінцевих продуктів
азотистого
обміну (у людини — переважно сечовини).
Певна частина безазотистого вуглецевого
скелета амінокислот використовується
для утворення глюкози(глюконеогенезу)
та кетонових тіл (кетогенезу).Розщепленню
підлягають усі амінокислоти, що не
використовуються для синтезу білків
або фізіологічно активних сполук (ФАС)
незалежно від джерела походження,
оскільки резерви білків у тваринних
організмах не утворюються (на
відміну
від вуглеводів та ліпідів). Разом з тим,
біоенергетичне значення катаболізму
амінокислот у здорової людини незначне,
порівняно з вуглеводами та ліпідами
(близько 10 % від загальних енергетичних
потреб), суттєво збільшуючись
лише за
умов голодування..
2.Амінотрансферазні реакції
У різних тканинах організму людини і тварин міститься більше десяти різних
амінотрансфераз, що розрізняються за своєю субстратною специфічністю. Найбільш поширеними є такі амінотрансферази:Глава 17. Метаболізм амінокислот 237 (1) аланінамінотрансфераза (глутамат-піруваттрансаміназа — ГПТ): L-аланін + ααααα-кетоглутарат піруват + L-глутамат (2) аспартатамінотрансфераза (глутамат-оксалоацетаттрансаміназа — ГОТ): L-аспартат + ααααα-кетоглутарат оксалоацетат + L-глутамат (3) тирозинамінотрансфераза: L-тирозин + ααααα-кетоглутарат p-гідроксифенілпіруват + L-глутамат (4) лейцинамінотрансфераза: L-лейцин + ααααα-кетоглутарат ααααα-кетоізокапроат + L-глутамат Реакції трансамінування, що каталізуються амінотрансферазами, активно перебігають в багатьох органах, найактивніше — в печінці, скелетних м’язах, міокарді, головному мозку, нирках. Визначення активності аланінамінотрансферази (аланінової трансамінази — АлТ) та аспартатамінотрансферази (аспарагінової трансамінази — АсТ) широко застосовується в медичній практиці з метою діагностики пошкоджень внутрішніх органів. Внаслідок виходу цих ферментних білків через ушкоджені клітинні мембрани в кров при інфаркті міокарда спостерігається значне підвищення активності в сироватці крові АсТ, при вірусних та токсичних пошкодженнях печінки — АлТ. Механізм дії амінотрансфераз Амінотрансферази є складними білками-ферментами, простетичною групою в яких є коферментні форми вітаміну В6 (піридоксину, піридоксолу) — піридоксальфосфат (ПАЛФ) та піридоксамінфосфат (ПАМФ), що утворюється з ПАЛФ у процесі переносу аміногрупи. Утворення коферменту з вітаміну В6, що надходить в організм із продуктами харчування, відбувається шляхом фосфорилювання піридоксолу до піридоксол- фосфату (ПОЛФ) за дії АТФ-залежної кінази з подальшим окисленням ПОЛФ до ПАЛФ специфічним флавопротеїном. У складі ферменту амінотрансферази кофермент (ПАЛФ) сполучений з поліпептидним ланцюгом за рахунок утворення альдімінного зв’язку (основи Шиффа) з εεεεε-аміногрупою залишку лізину (Lys-258).У процесі каталітичного акту трансамінування відбувається циклічне перетворення ПАЛФ на ПАМФ: Амінокислота1 ПАМФ Амінокислота2 ααααα-Кетокислота1 ПАЛФ ααααα-Кетокислота2 Процес складаєтья з двох напівреакцій: 1) взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату: амінокислота1 + ПАЛФ-Е ααααα-кетокислота1 + ПАМФ-Е238 Розділ III. Метаболізм основних класів біомолекул Механізм реакції полягає у взаємодії амінокислоти з ПАЛФ-Е із заміною альдимінного зв’язку у складі ПАЛФ-Е на альдимінний зв’язок між коферментом та амінокислотою (1а); після внутрішньомолекулярного перегрупування (1б) відбувається гідроліз кетиміну (1в) з утворенням коферментної форми, що містить аміногрупу (ПАМФ), та ααααα-кетокислоти1: Біохімічне значення реакцій транс амінування Як випливає з наведеного, в реакціях трансамінування не відбувається дезамінування, тобто вивільнення аміаку, оскільки аміногрупа, що відщеплюється від ααααα-L-амінокислоти, акцептується відповідною ααααα-кетокислотою, здебільшого — ααααα-кетоглутаровою. Біохімічне значення трансамінування суттєво відрізняється в різних органах. У печінці роль трансамінувавання полягає в його колекторній функції, тобто збиранні аміногруп від різних амінокислот переважно в одній молекулярній формі — у вигляді L-глутамінової кислоти. Біохімічний сенс такого процесу поля- гає в тому, що саме L-глутамат є основним субстратом реакцій дезамінування, тобто постачальником аміногруп на метаболічний шлях утворення сечовини — кінцевого продукту азотистого катаболізму. У м’язах спрямованість реакцій трансамінування призводить до утворення значної кількості аланіну (за рахунок переамінування амінокислот з піруватом), що виділяється в кров’яне русло і поглинається гепатоцитами; в печінці аланін знову перетворюється на піруват, який використовується в глюконеогенезі (глю- козо-аланіновий цикл . 3. Непряме дезамінування L-амінокислот Оскільки L-глутамат є амінокислотою, що утворюється при транс амінуванні більшості L-амінокислот, течія L-глутаматдегідрогеназної реакції є центральним біохімічним механізмом, завдяки якому здійснюється дезамінування більшості вільних
амінокислот і утворюється основна кількість аміаку в тваринному організмі.240 Розділ III. Метаболізм основних класів біомолекул Таке дезамінування вільних L-амінокислот за механізмом спряження реакцій трансамінування з ααααα-кетоглутаратом і окислювального дезамінування L-глутамату отримало назву непрямого дезамінування: Найбільш активно непряме дезамінування амінокислот за участю глутамат- дегідрогенази відбувається в печінці, де аміак, що звільнюється, надходить у цикл сечовиноутворення. Дезамінування амінокислот Процес відщеплення аміногрупи від амінокислоти з утворенням вільного аміаку називається дезамінуванням і може здійснюватись різними шляхами, характерними для різних видів живих організмів. У вищих тварин основним шляхом є окиснювальне дезамінування, при якому, крім аміаку, утворюється α-кетокислота.
![]() В
організмі людини є декілька ферментів,
що каталізують такі реакції, різної
специфічності й біологічного значення
печінці і нирках є неспецифічна оксидаза
L-амінокислот,
Простетичною групою оксидази L-амінокислот
служить ФМН. Значно
активніша в організмі
людини
оксидаза D-амінокислот, ФАД-залежний
фермент, що виділений із нирок, печінки
й мозку. Фермент каталізує окиснювальне
дезамінування тільки D-ізомерів
амінокислот, що не входять до складу
білків, Окиснювальне дезамінування
глутамінової кислоти відбувається в
мітохондріях
печінки (а також інших органів) з
утворенням аміаку,
НАДН+Н+ і
α-кетоглутарової кислоти, яка може бути
використана у
циклі
лимонної кислоти. Ця реакція є основним
джерелом аміаку в організмі
людини.
В
організмі людини є декілька ферментів,
що каталізують такі реакції, різної
специфічності й біологічного значення
печінці і нирках є неспецифічна оксидаза
L-амінокислот,
Простетичною групою оксидази L-амінокислот
служить ФМН. Значно
активніша в організмі
людини
оксидаза D-амінокислот, ФАД-залежний
фермент, що виділений із нирок, печінки
й мозку. Фермент каталізує окиснювальне
дезамінування тільки D-ізомерів
амінокислот, що не входять до складу
білків, Окиснювальне дезамінування
глутамінової кислоти відбувається в
мітохондріях
печінки (а також інших органів) з
утворенням аміаку,
НАДН+Н+ і
α-кетоглутарової кислоти, яка може бути
використана у
циклі
лимонної кислоти. Ця реакція є основним
джерелом аміаку в організмі
людини.

Реакція декарбоксилювання амінокислот полягає у відщепленні діоксиду вуглецю від молекули амінокислоти з утворенням амінів (біогенних амінів) Реакція каталізується ферментами — декарбоксилазами амінокислот, коферментом яких є піридоксальфосфат, що в ході каталітичного акту утворює зГлава 17. Метаболізм амінокислот 241 амінокислотами шифові основи, подібні до розглянутих в реакціях трансамінування. Декарбоксилази амінокислот є стереоспецифічними ферментами, що діють тільки на L-стереоізомери. Фізіологічне значення декарбоксилювання амінокислот.
5.Головним у кількісному відношенні джерелом накопичення аміаку в організмі людини є окислювальне дезамінування амінокислот, тобто білковий катаболізм. Додатковими джерелами ендогенного аміаку є реакції дезамінування біогенних амінів, азотистих основ, які утворюються при катаболізмі нуклеотидів. Значна кількість вільного аміаку всмоктується в кров із системи ворітної вени Утворення аміаку в головному мозку Основним джерелом утворення аміаку в тканині головного мозку є реакція гідролітичного дезамінування АМФ до інозинмонофосфату (ІМФ), що каталізується ферментом аденозиндезаміназою: Аміак, що вивільняється, знешкоджується в результаті глутамінсинтетазної реакції, утворюючи з L-глутамату глутамін, який виводиться з головного мозку. Механізми знешкодження аміаку Висока токсичність аміаку призвела до формування в еволюції тваринних організмів спеціальних біохімічних механізмів його знешкодження. Залежно від молекулярної форми, у вигляді якої екскретуються кінцеві продукти азотистого (амінного) катаболізму, існує три типи тваринних організмів: 1) амоніотелічні організми — такі, що виводять амінний азот у вигляді розчинного іону амонію (до них належить більшість хребетних, що мешкають у воді); 2) урикотелічні організми — такі, що виводять амінний азот у вигляді сечової кислоти (птахи, наземні рептилії); 3) уреотелічні організми — основним продуктом знешкодження та екскретування аміаку у яких є сечовина (більшість наземних хребетних, включаючи ссавців, зокрема організм людини). Біосинтез сечовини відбуваєтья виключно в печінці. Додатковим механізмом детоксикації аміаку у місцях утворення є його зв’язування у формі глутаміну за участю глутамінсинтетази.
6.Біосинтез сечовини
синтез сечовини відбувається з аміаку та вугільної кислоти в результаті циклічного процесу, в якому каталітичну роль відіграють амінокислоти аргінін,
орнітин та цитрулін (орнітиновий цикл Кребса-Хензелайта): Як випливає з наступного, джерелами двох аміногруп, що використовуються
для утворення молекули сечовини, є аміак, який вивільняється при окислювальному дезамінуванні L-глутамату, та аміногрупа амінокислоти L-аспартату.
Ферментативні реакції синтезу сечовини
1. Утворення з аміаку та діоксиду вуглецю за участю АТФ карбамоїлфосфату: Реакція каталізується карбамоїлфосфатсинтетазою. Джерелом аміногрупи
(у вигляді молекули аміаку) є глутаматдегідрогеназна реакція.
2. Перенесення карбамоїльної групи на орнітин з утворенням цитруліну (фермент — орнітин-карбамоїлтрансфераза): 3. Акцептування другої аміногрупи шляхом взаємодії цитруліну з L-аспартатом (фермент — аргініно-сукцинатсинтетаза): 4. Розщеплення аргініносукцинату при дії ферменту аргініно-сукцинатліази; продуктами реакції є аргінін — безпосередній попередник сечовини та фумарат:
ферменту аргінази з утворенням сечовини та регенерацією орнітину (завершення метаболічного циклу):
14 Метаболізм порфіринів будова гему схема реакцій біосинтезу протопорфір.спадков порушеня Порфірини та їх комплекси з металами — металопорфірини — є простетич-
ними групами багатьох гемопротеїнів — білків, які беруть участь в окислювально-
відновлювальних реакціях у тваринних та рослинних клітинах. Представниками
гемопротеїнів, що містять металопорфіринові групи, є Fe2+-вмісні гемоглобін
(О2 — транспортуючий білок еритроцитів) і міоглобін (О2 — запасаючий білок
м’язів), (Fe2+-Fe3+)- та (Cu1+-Cu2+)-вмісні цитохроми, (Fe2+-Fe3+)-вмісні ферменти
каталаза, пероксидази, триптофанпіролаза, Mg2+-вмісний хлорофіл рослин.

Спадкові порушення обміну порфіринів
Спадкові порушення біосинтезу порфіринів
(порфірії) — дефекти метаболізму (ензимопатії), за яких порфірини та їх попередники в надмірних кількостях накопичуються в тканинах людського організму, зокрема в шкірі і підшкірній клітковині, та екскретуються з сечею і фекаліями. Існують декілька найбільш поширених клініко-біохімічних типів порфірій, що відрізняються типом дефектного гена та характером прояву ензимопатії. Описані
порфірії, які розвиваються в результаті дефектів майже всіх ферментів синтезу гему.
Успадковуються порфірії як автосомно-рецесивні або автосомно-домінантні хвороби. Основними клінічними проявами порфірій є підвищення чутливості до світла та неврологічні порушення.
Світлочутливість Аномальне відкладення порфіринів різної молекулярної структури в шкірі призводить до її фотосенсибілізації та розвитку фотодерматитів. Молекулярною основою таких патологічних проявів є утворення під дією сонячного світла з довжиною хвилі близько 400 нм активних форм кисню типу синглетного кисню
1О2 та перекисних радикалів порфіринів типу RO2·, які пошкоджують клітинні мембрани і призводять до загибелі клітин. Неврологічні порушення
Неврологічні порушення при порфіріях проявляються патологічними симптомами
з боку як периферичної (дизестезії, порушення моторики кишечника, нерво-м’язової
провідності, параліч дихальних м’язів тощо), так і центральної нервової системи. Структура порфіринів Порфірини — сполуки циклічної будови, основою структури яких є ароматична гетероциклічна система — порфін. Порфін, в свою чергу, є тетрапіролом, який утворюється при сполученні між собою метенільними (–СН=) містками чотирьох кілець азотистого гетероциклу піролу. Природні порфірини, що в комплексі з металами входять до складу багатьох фізіологічно важливих гемопротеїнів, це сполуки, в яких вісім атомів водню порфіринового ядра заміщені різними вуглеводневими радикалами. Залежно від будови бічних радикалів, розрізняють декілька класів порфіринів: уропорфірини, копропорфірини, протопорфірини, етіопорфірини, гематопорфірини, мезопорфірини, дейтеропорфірини. Кожен клас порфіринів містить декілька ізомерів, що позначаються літерами латинського
алфавіту. Метаболічні попередники порфіринів мають назву порфіриногенів (уропорфіриногени, копропорфіриногени тощо). На відміну від порфіринів, порфіриногени не містять спряжених метенільних структур (в їх молекулах
піроли сполучені насиченими метиленовими (–СН2–) містками); вони є безбарвними сполуками і перетворюються на забарвлені порфірини при ферментативному або
неферментативному (під дією кисню повітря) окисленні. До складу гему кисеньзв’язуючих білків організму людини — гемоглобіну, міоглобіну та цитохромів дихальних ланцюгів входить порфірин, що позначається як протопорфірин ІІІ (за старою номенклатурою Фішера цей порфірин класифікувався як протопорфірин ІХ — номенклатурне позначення, що використовується і в даний час).
15 Біосинтез пуринових нуклеотидів
Ферментні системи організму людини і тварин здатні до синтезу нуклеотидних
структур на основі біомолекул-попередників. У процесі біосинтезу пуринових
нуклеотидів беруть участь молекули амінокислот (гліцину, аспартату та глутаміну)
та каталітично активні одновуглецеві групи у формі похідних тетрагідрофолату
(Н4-фолату) і активного СО2, що приєднуються безпосередньо до пентозної части-
ни нуклеотиду - рибозо-5-фосфату. Реакції біосинтезу ІМФ Послідовність ферментативних реакцій, що призводять до утворення ІМФ, є
такою (1) взаємодія -D-рибозо-5-фосфату з АТФ з утворенням 5-фосфорибозил-1-
пірофосфату (ФРПФ); (2) взаємодія ФРПФ із глутаміном з утворенням 5-фосфорибозиламіну; (3) взаємодія 5-фосфорибозиламіну з гліцином з утворенням гліцинамід- рибозил-5-фосфату (ГАР); (4) взаємодія ГАР з активною формою з утворенням форміл-ГАР; (5) взаємодія форміл-ГАР з глутаміном (донором аміногрупи) з утворенням формілгліцинамідино-рибозил-5-фосфату (форміл-ГАМ);
(6) взаємодія форміл-ГАМ з АТФ із замиканням імідазольного кільця, тобто
утворенням сполуки, що містить п’ятичленне кільце пуринового циклу — аміно-
імідазол-рибозил-5-фосфату (АІР); (7) карбоксилювання АІР з утворенням аміноімідазолкарбоксилат-рибозил- 5-фосфату (АІКР); (8) взаємодія АІКР із аспартатом (донором аміногрупи) з утворенням проміжної сполуки аміноімідазолсукцинілкарбоксамід-рибозил-5-фосфату (АІCКР);
(9) розщеплення АІСКР з елімінацією фумарату та утворенням аміноіміда-
золкарбоксамід-рибозил-5-фосфату (АІКАР); (10) формілювання АІКАР за -групи N10-форміл-Н4-фолату з утворенням формамідоімідазолкарбоксамід-рибозил-5-фосфату (ФАІКАР); (11) дегідратація та циклізація ФАІКАР з утворенням першого пуринового
нуклеотиду — інозинмонофосфорної (інозинової кислоти, ІМФ).
Утворення АМФ та ГМФ Інозинмонофосфат є попередником в утворенні інших пуринових рибонуклеотидів — аденозинмонофосфату (АМФ) та гуанозинмонофосфату (ГМФ). Синтез АМФ здійснюється шляхом таких реакцій: 1) заміщення кисню при С-6 пурину на аміногрупу, донором якої є аспарагінова кислота; проміжний продукт реакції — аденілосукцинат, утворення якого потребує хімічної енергії у формі макроергічного зв’язку ГТФ; 2) розщеплення аденілосукцинату з вивільненням фумарату та утворенням
аденозин-5'-монофосфату. Синтез ГМФ відбувається також у дві стадії: 1) окислення вуглецю (С-2) в кільці пурину з утворенням ксантилової кислоти (ксантозин-5' монофосфату); реакція потребує наявності НАД+ як акцептора водню;_ _ Синтез пуринових нуклеотидів регулюється за принципом негативного зворотного зв’язку — кінцеві продукти біосинтетичного шляху
( АМФ,
ГМФ, АТФ, ГТФ) гальмуют певні ферментативні
реакції їх утворення. Враховуючи
біологічну
важливість
для самого існування
клітини
координованого синтезу
нуклеотидів
як попередників в
АМФ,
ГМФ, АТФ, ГТФ) гальмуют певні ферментативні
реакції їх утворення. Враховуючи
біологічну
важливість
для самого існування
клітини
координованого синтезу
нуклеотидів
як попередників в
утворенні ДНК і РНК, контроль їх кількісного складу здійснюється на декількох регуляторних ділянках.
1. Контроль ранньої стадії син-тезу пуриннуклеотидів реалізується двома механізмами:
1.1. Шляхом зменшення при дії
АМФ та ГМФ активності ферменту,
що перетворює -D-рибозо-5-фосфат
на 5-фосфорибозил-1-пірофосфат (ФРПФ) — 5-фосфорибозил-1-пірофосфат-
синтетази. 1.2. Шляхом інгібірування при дії ІМФ, АМФ та ГМФ активності регуляторного алостеричного ферменту, що перетворює ФРПФ на 5-фосфорибозиламін — глутамін-ФРПФ-амідотрансферази; це — найважливіший пункт контролю
швидкості всього біосинтетичного шляху. 2. Контроль пункту розгалуження в синтезі пуриннуклеотидів, тобто перетворення ІМФ на АМФ та ГМФ відбувається за такими механізмами: 2.1. АМФ гальмує власне утворення з ІМФ шляхом інгібірування активності ферменту аденілосукцинатсинтетази, який перетворює ІМФ на аденілосукцинат; 2.2. ГМФ гальмує власне утворення з ІМФ шляхом інгібірування ферменту ІМФ-дегідрогенази, який перетворює ІМФ на ксантозинмонофосфат.
2.3. АТФ та ГТФ є джерелами метаболічної енергії для синтезу один одного:
АТФ необхідний для перетворення ІМФ на ГМФ (та ГТФ), тоді як ГТФ необхід-
ний для перетворення ІМФ на АМФ (та АТФ); тому збільшення (зменшення)
концентрації кожного з нуклеозидтрифосфатів призводить до відповідних змін у
швидкості утворення іншого нуклеозидтрифосфату, що забезпечує їх коорди-
нований синтез.
