
- •Глава 1.Взаимодействие биополимеров с лигандами и между собой
- •1.1.Термодинамика взаимодействия биополимеров с лигандами
- •1.1.1.Взаимодействие биополимеров с недостатком лиганда
- •1.1.2.Взаимодействие биополимера с избытком лиганда
- •1.1.3.«Направленные» конформационные переходы
- •1.1.4.Кооперативное связывание лигандов
- •1.2.Биологическое «узнавание»
1.2.Биологическое «узнавание»
Термин биологическое узнавание часто используется в биохимии для описания специфического связывания лигандов с биополимерами и биополимеров между собой. Если из множества лигандов в смеси биополимер образует прочный комплекс лишь с одним, то принято говорить, что биополимер узнает этот лиганд. Мерой специфичности узнавания является константа ассоциации. Точность такого узнавания в случае белков удивительно высока. Так, как правило, белковые биомолекулы распознают один из двух энантиомеров в рацемической смеси.
Какие же особенности строения белков обеспечивают столь прочное и специфичное связывание с лигандами?
Исследования показали, что белки, обладающие способностью специфического узнавания, имеют на своей поверхности центр связывания (в случае ферментов называемый активным центром). В процессе миллионнолетней эволюции центр связывания подстраивался под пространственную форму специфического лиганда. Считается, что первым принцип геометрического соответствия сформулировал Эмиль Фишер в начале 20 века (гипотеза «ключ-замок»). Однако корни этой идеи много старше. Еще 2000 лет назад Лукреций писал: "Вещи, в которых их ткань совпадает взаимно с другою, так что, где выпуклость есть, у другой оказалась бы там же впадина, — это их связь окажется самою тесной".
Дальнейшие исследования показали, что кроме геометрического соответствия существует и зарядовое соответствие, так что против положительно заряженной группы лиганда в центре связывания находится отрицательно заряженный остаток белковой цепи. Но и этого мало. Существует более тонкое электронное соответствие связывающего центра электронной конфигурации лиганда (в частности, как правило, дипольные моменты лиганда и центра связывания расположены антипараллельно). Более того, против групп лиганда, которые могут служить донорами протона в водородной связи, располагаются акцепторы протона, а против гидрофобных групп лиганда — гидрофобные группы связывающего центра.
В случае белок-белкового узнавания ситуация значительно отличается от рассмотренной выше. Вследствие соизмеримости размеров партнеров, образование связывающего центра невозможно и имеет место поверхностное взаимодействие. Специфичность связывания обеспечивается тем, что аминокислотные остатки, составляющие контактные площадки, обеспечивают взаимное соответствие этих площадок с точки с точки зрения максимального числа заряд-зарядовых взаимодействий, водородных связей, гидрофобных и ван-дер-ваальсовых контактов.
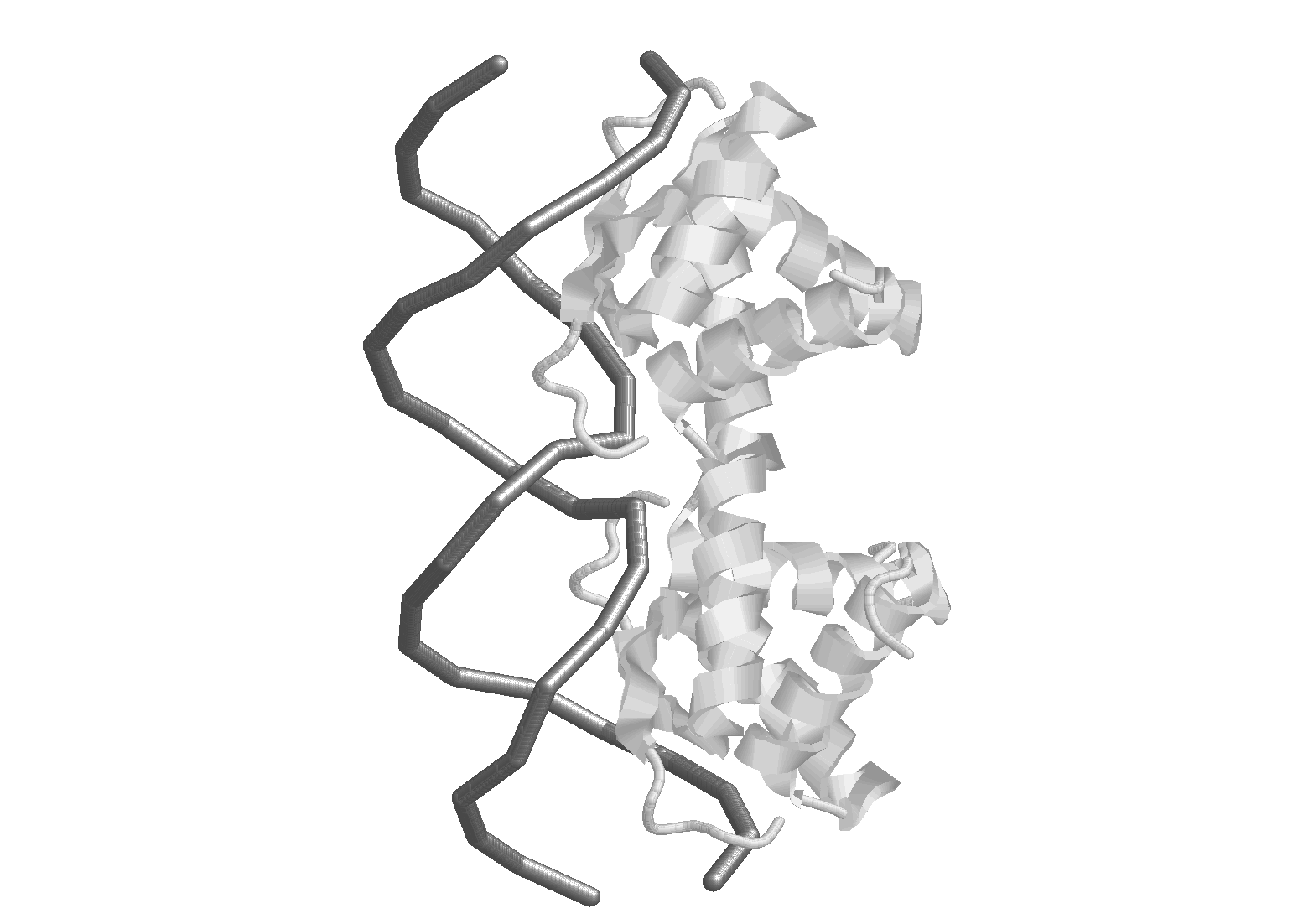
Наконец, коротко рассмотрим белок-нуклеиновые взаимодействия. В силу своей биологической функции (хранение и перенос генетической информации) нуклеиновые кислоты имеют линейную структуру. По этой же причине пространственная структура НК очень консервативна. Еще одной особенностью является то, что при нейтральных рН НК отрицательно заряжены. Поэтому, как правило, белки, предназначенные для связывания с НК, имеют в своем составе аномально много положительно заряженных аминокислотных остатков. Ион-ионное взаимодействие обеспечивает прочность связывания, но не может обеспечить специфичность взаимодействия. Специфичность реализуется за счет образования водородных связей между аминокислотными остатками и уникальной нуклеотидной последовательностью связывающего участка НК. Поскольку основные функциональные группы выходят в большой желобок ДНК, большее число специфических контактов приходится на большой желобок, что хорошо видно на Рис. 4 .13. Первоначально в результате ион-ионного взаимодействия на ДНК образуется множество не очень прочных неспецифических комплексов, которые превращаются в специфический комплекс за счет перемещения белка вдоль цепи ДНК (одномерная диффузия) до встречи со специфической последовательностью. Формально процесс перемещения белка очень напоминает то, как гусеница ползет по ветке дерева.
Рис.
4.13. Специфический
комплекс АРС-белка с синтетическим
фрагментом ДНК (данные рентгено-структурного
анализа). ДНК представлена ходом
сахаро-фосфатного остова; белок либо
ходом пептидного остова (слева),
либо в элементах вторичной структуры
(справа).
Видно, что большинство контактов
приходится на большой желобок ДНК.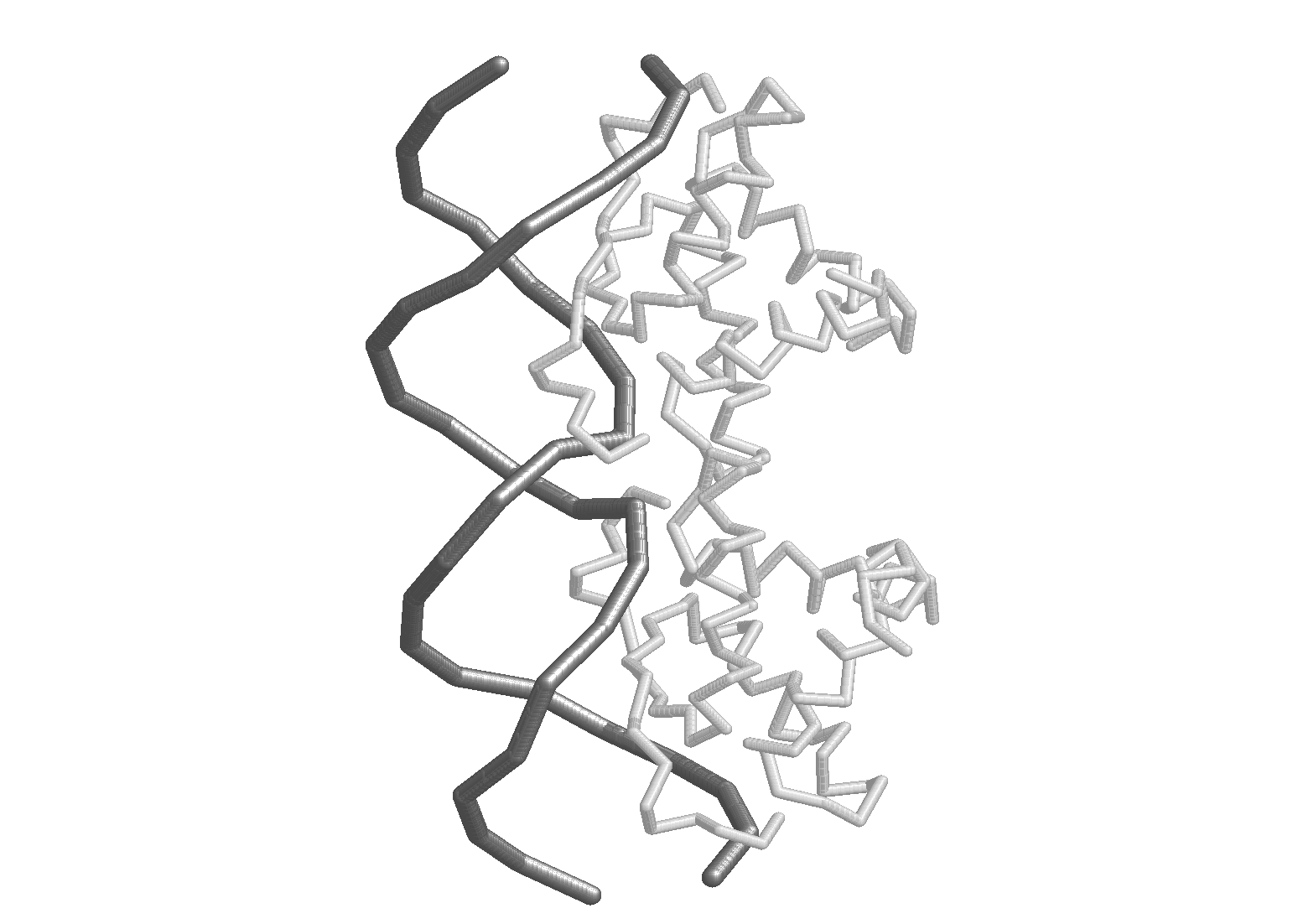
1 Молекулы гидрофобных красителей, будучи растворенными в воде, стремятся уменьшить площадь контакта с водой и слипаются в агрегаты (см. Раздел Error: Reference source not found). В присутствии ДНК они внедряются (интеркалируют) между соседними парами оснований двойной спирали ДНК.
