
- •Глава 1.Матричный синтез биополимеров
- •1.1.Репликация днк
- •1.1.1.Исправление ошибок в процессе репликации
- •1.2.Мутагенез
- •1.2.1.Репарация днк
- •1.3.Рекомбинация днк
- •1.4.Транскрипция генетической информации
- •1.4.1.Посттранскрипционный процессинг
- •1.4.2.Рибозимы
- •1.4.3.Обратная транскрипция
- •1.5.Трансляция генетической информации
- •1.5.1.Генетический код
- •1.5.2.Транспортные рнк
- •1.5.3.Синтез белка на рибосоме
- •1.6.Особые случаи репликации и транскрипции у вирусов
1.5.2.Транспортные рнк
Прежде, чем аминокислота будет присоединена к растущей полипептидной цепи, необходимо активировать ее карбоксильную группу и затем поместить в конец растущей белковой цепи именно ту активированную аминокислоту, которая соответствует очередному кодону мРНК. В обоих этих процессах непосредственное участие принимают транспортные РНК (тРНК). тРНК — это короткая РНК, обладающая специфичной структурой.
Необходимость активации аминокислоты вызвана тем, что прямое взаимодействие аниона кислоты с концевой аминогруппой растущей цепи полипептида энергетически невыгодно. В таких случаях кислоту обычно предварительно превращают в высоко активный сложный эфир, который и вводят во взаимодействие с аминогруппой. Точно так же поступает и клетка. На этом этапе каждая из 20 аминокислот ковалентно присоединяется к определенной тРНК. Эти реакции катализируются 20 ферментами, называемыми аминоацил-тРНК-синтетазами, каждая из которых специфична по отношению к какой-то одной аминокислоте и соответствующей тРНК, при этом используется энергия АТР. Общий вид катализируемой ими реакции имеет вид:

Процесс состоит из двух стадий. На первой стадии в активном центре фермента в результате взаимодействия АТР и аминокислоты образуется связанное с ферментом промежуточное соединение — аминоациладенилат (Рис. 6 .12). На второй стадии аминоацильный остаток переносится с аминоациладенилата на соответствующую специфическую тРНК (Рис. 6 .13Б), при этом аминоацильный остаток связывается со свободной 2- или 3-гидроксигруппой концевого остатка аденозина в молекуле тРНК.
Аминоацил-тРНК-синтетазы очень специфичны по отношению как тРНК, так и по отношению к соответствующей ей аминокислоте. Частота ошибок не превышает трех на 10000. После присоединения к соответствующей тРНК аминокислота уже не участвует в определении специфичности аминоацил-тРНК, ибо сама по себе аминоацильная группа не узнается ни рибосомой, ни тРНК. Специфичность аминоацил-тРНК обеспечивается исключительно структурой тРНК за счет уотсон-криковской комплементарности антикодонового триплета кодоновому триплету мРНК (Рис. 6 .13В).
Рис.
6.12. Структура
аминоациладенилата, образующегося в
активном центре аминоацил-тРНК-синтетаз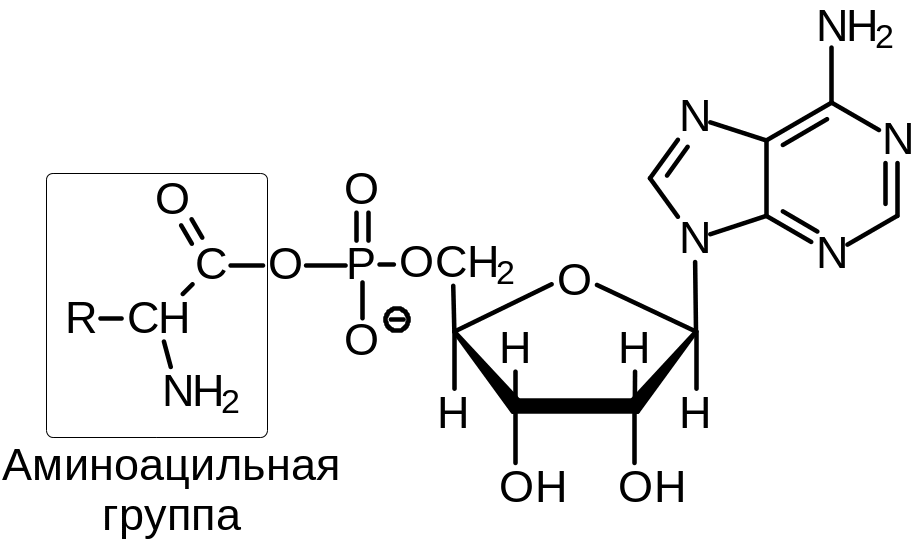
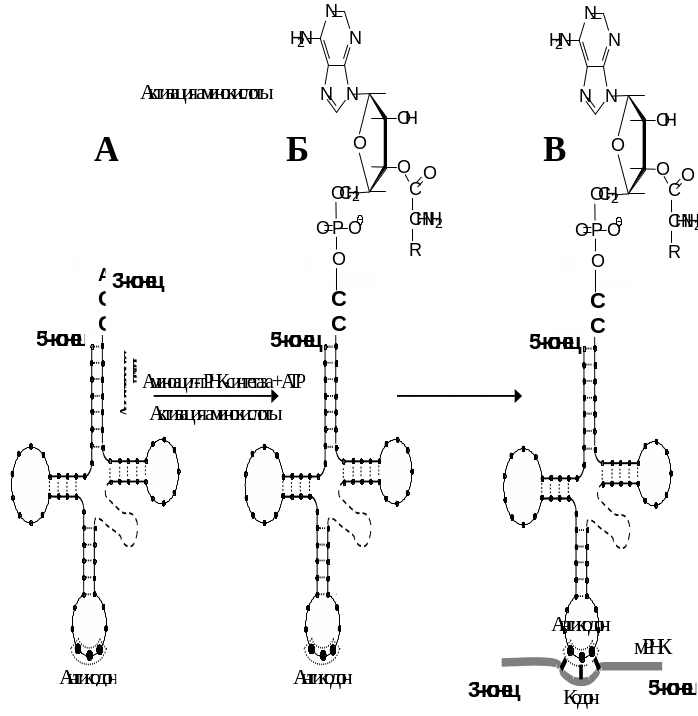
Рис. 6.13. Схема активации аминокислот (Б) и специфического взаимодействия аминоацил-тРНК с матричной РНК
Выше уже было сказано, что комплементарность кодона данной аминокислоте определяется первыми двумя (с 5-конца) нуклеотидами, третья же буква может отличаться (Раздел «Генетический код», стр. 25). Для объяснения это явление Фрэнсис Крик предложил гипотезу «качания» (wobble hypothesis). Суть гипотезы состоит в следующем:
1. Два первых (с 5-конца) основания кодона всегда образуют прочные уотсон-криковские пары (Рис. 6 .14 вверху).
2. Третье основание кодона и первое с 5-конца основание антикодона, как привило, образуют менее прочную «качающуюся» пару (Рис. 6 .14, внизу). Если первое основание антикодона C или А, то такой антикодон способен «читать» только один кодон; если U или G, то такой антикодон может прочитать два разных кодона. Наконец, если первое основание гипоксантин (основание нуклеозида инозина (I), см. Рис. 6 .14, внизу), то антикодон может прочитать три антикодона
3. Кодоны для данной аминокислоты, отличающиеся по одному из первых двух оснований, требуют разных тРНК.
4. Для трансляции всех кодонов (число этих кодонов 61) необходимо как минимум 32 тРНК.
В клетках, как правило, присутствует большее число тРНК, но меньше 61.


Рис. 6.14. Строение прочных уотсон-криковских пар (вверху) и относительно слабых «качающихся» пар (внизу). I — инозин.
