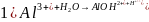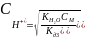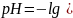- •«Электролиты. Реакции в растворах электролитов»
- •Экспериментальная часть
- •1. Сильные и слабые электролиты. Зависимость степени диссоциации от природы электролита.
- •1.1 Ход и данные опыта.
- •1.2. Анализ результатов опыта
- •2. Смещение равновесия диссоциации слабого электролита
- •2.1. Влияние разбавления раствора на степень электролитической диссоциации
- •2.1.1. Ход и данные опыта.
- •2.1.2. Анализ результатов опыта
- •2.2. Влияние введения одноименных ионов на степень диссоциации слабых электролитов
- •2.2.1. Ход и данные опыта.
- •2.2.2А. Анализ результатов опыта
- •2.2.2Б. Анализ результатов опыта
- •3. Гидролиз солей. Образование кислых и основных солей при ступенчатом Гидролизе
- •3.1.1. Ход и данные опыта.
- •3.1.2. Анализ результатов опыта
- •3.2.1. Ход и данные опыта.
- •3.2.2. Анализ результатов опыта
- •4. Влияние температуры на степень гидролиза солей
- •4.1. Ход и данные опыта.
- •4.2. Анализ результатов опыта
- •5. Необратимый гидролиз
- •5.1. Ход и данные опыта.
- •5.2. Анализ результатов опыта
- •Ответы на контрольные вопросы
5. Необратимый гидролиз
5.1. Ход и данные опыта.
Налейте в пробирку равные объемы (1 – 2 мл) растворов солей Al2(SO4)3 и Na2CO3. Наблюдайте выпадение осадка и выделение пузырьков газа.
5.2. Анализ результатов опыта
5.2.1. Напишите ионно-молекулярное и молекулярное уравнения реакции
гидролиза с учетом наблюдений в эксперименте.
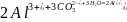
5.2.2. Объясните необратимость процесса гидролиза исследуемых солей.
Необратимость гидролиза объясняется выводом продуктов реакции из реакционного пространства.
Ответы на контрольные вопросы
1. Вычислите концентрацию цианид-ионов в 0,1 М растворе синильной кислоты HCN. Как изменится концентрация этих же ионов, если pH раствора HCN будет равен 3?
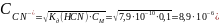 (М).
(М).
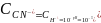 (М).
(М).
2. Одинаковы ли значения pH растворов KOH и NH4OH одинаковой концентрации, равной 0,01 М? Ответ обосновать уравнением диссоциации и расчетами.
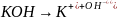
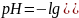
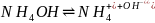
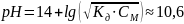
3. Запишите в ионно-молекулярной и молекулярной формах уравнения ступенчатого гидролиза CuSO4 и Na3PO4. Как избежать гидролиза этих солей при приготовлении их водных растворов? Ответ пояснить с позиций принципа смещения равновесия гидролиза.
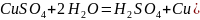
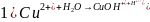
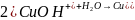
Для избежания гидролиза среда раствора pH<7, и наличие в растворе солей сульфата.
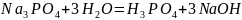
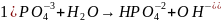
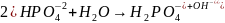
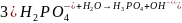
Для избежания гидролиза среда раствора pH>7, и наличие в растворе солей натрия.
4. Рассчитайте pH 0,5 М раствора AlCl3, учитывая только первую ступень гидролиза.