
Билет №1.
Роль химии в развитии важнейших отраслей промышленности.
Явления, при которых из одних веществ образуются другие, новые вещества, называются химическими. Изучением таких явлений занимается химия. Химия-это наука о превращениях веществ. Она изучает состав и строение веществ, зависимость свойств веществ от их состава и строения, условия и пути превращения одних веществ в другие.
В современной жизни, особенно в производственной деятельности человека, химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Природа даёт нам лишь исходное сырьё - дерево, руду, нефть и др. Подвергая природные материалы химической переработке, получают разнообразные вещества, необходимые для сельского хозяйства, для изготовления промышленных изделий и для домашнего обихода - удобрения, металлы, пластические массы, краски, лекарственные вещества, мыло, соду и т. д. Для химической переработки природного сырья необходимо знать общие законы превращения веществ, а эти знания даёт химия.
В царской России не существовало крупной химической промышленности. Это сильно сказывалось на состоянии русской химической науки, не имевшей материальной базы для своего развития. Научные исследования лишь в редких случаях встречали поддержку со стороны государства. Однако, несмотря на крайне неблагоприятные условия работы, русские учёные-химики внесли крупнейший вклад в мировую химическую науку.
В дальнейшем были организованы научно-исследовательские институты и лаборатории, а также множество химических учебных заведений. Развернулась в крупных масштабах научно-исследовательская работа, охватывающая все отрасли химии. Были построены горнохимические комбинаты, заводы минеральных удобрений, синтетического аммиака, синтетического каучука, пластических масс и др. Значительно расширились такие отрасли химической промышленности, как азотная, калийная, пластических масс, синтетического каучука, органического синтеза, хлора и его производных. Было создано производство синтетических волокон, синтетического этилового спирта, органических преператов для борьбы с вредителями сельскохозяйственных культур и т.д.
Значение химии в развитии промышленности страны очень велико. На химии основана важнейшая отрасль промышленности - металлургия, т.е. наука о промышленных способах получения металлов. Вся металлургическая промышленность основана на окислительно-восстановительных процессах, в ходе которых металлы выделяются из природных соединений. В процессе химических реакций получают чугун и сталь, а также некоторые цветные металлы.
Химические реакции протекают с выделением или с поглощением энергии. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, - эндотермическими. Энергетические изменения, сопровождающие протекание химических реакций, имеют очень большое практическое значение. Иногда они даже важнее, чем происходящее при данной реакции образование новых веществ. В качестве примера достаточно вспомнить реакции горения топлива. Поэтому тепловые эффекты реакций уже давно тщательно изучаются. Раздел химии, посвящённый количественному изучению тепловых эффектов реакций, получил название термохимии.
Химия играет огромную роль борьбе с таким процессом, как самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называемым коррозией.
С помощью внедрения в производство достижений современной химической науки разрабатываются новые технологии производства промышленных товаров высокого качества, необходимых во всех отраслях народного хозяйства. Развитие химической промышленности - одно их важнейших условий технического прогресса.
Билет 2
Молекула - наименьшая частица вещества, обладающая его химическими свойствами. Молекулы в свою очередь состоят из атомов.
Атом - это наименьшая частица элемента, обладающая его химическими свойствами.
Элемент – вид атомов, характеризующийся определенной совокупностью свойств. При соединении друг с другом атомов одного и того же элемента, образуются простые вещества, сочетание же атомов различных элементов дает или смесь простых веществ или сложное вещество.
Относительная атомная масса – отношение массы атома элемента к 1/12 части массы атома 12С.
Относительная молекулярная масса простого или сложного вещества - отношение массы его молекулы к 1/12 части массы атома 12С.
Моль – количество вещества, содержащее столько молекул, атомов, ионов, элементов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа 12С. Число структурных единиц, содержащихся в 1 моле вещества (постоянная Авогадро) – 6,02∙1023 моль-1.
Мольная масса – масса 1 моля вещества, выраженная в граммах.
Закон Авогадро: в равных объёмах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. (6,02∙1023 моль-1). Согласно закону Авогадро, при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
Способы определения молекулярных масс веществ, находящихся в газообразном состоянии:
I сп. (по относительной плотности):
![]()
![]() -
относительная плотность первого газа
по второму.
-
относительная плотность первого газа
по второму.
![]() ,
M1=D∙M2
,
M1=D∙M2
II сп.(объединенное уравнение Бойля-Мариотта и Гей-Люссака):
![]()
V (p, T) – объем газа при p и T
V0 (p0, T0) – объем газа при н.у.:
p0=101,3 кПа (760 мм рт. ст.)
T0=273 К (00 С)
![]()
![]()
![]()
![]()
III сп. (Уравнение Бойля-Мариотта):
![]()
p - (Па) m - (г)
V - (м3) M - (г/моль)
Т - (К)
R=8,3![]()
Билет 10,11
Скорость химических реакций. Понятие об активных молекулах, энергии активизации. Гомогенные и гетерогенные системы. Закон действия масс. Зависимость скорости реакции от природы реагирующих веществ, от концентрации, от температуры. Константа скорости реакции.
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет, десятилетий и ещё более длительных отрезков времени. Кроме того одна и та же реакция в зависимости от условий может протекать с разной скоростью. Раздел химии, изучающий скорости химических реакций, называется химической кинетикой. При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе и в гетерогенной системе.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной - система, состоящая из нескольких фаз. Фазой называется часть системы, отделённая от других её частей поверхностью раздела, при переходе через которую свойства меняются скачком. Примером гомогенной реакции может служить любая газовая смесь или раствор нескольких веществ в одном растворителе. В качестве примера гетерогенной системы можно привести такие, как вода со льдом, насыщенный раствор с осадком и т.д. Если реакция протекает в гомогенной системе, то она идёт во всём объёме этой системы. Если реакция протекает в гетерогенной системе, то она может идти только на поверхности раздела фаз, образующих систему.
Скорость гомогенной реакции равна отношению количества вещества, вступившего в реакцию или образующегося при реакции за единицу времени в единице объёма. Это уравнение можно упростить. В результате получаем: скорость реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию млм образующихся при реакции, происходящее за единицу времени. Скорость гетерогенной реакции равна отношению количества вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени на единицу поверхности.
К важнейшим факторам, влияющим на скорость химической реакции, относятся: природа реагирующих веществ, их концентрация, температура, площадь поверхности соприкосновения (гетерогенные системы), присутствие в системе катализаторов. Скорость некоторых гетерогенных реакцийзависят также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция.
1. Чем активнее реагирующие вещества, тем реакция идёт быстрее.
2. Закон действующих масс. При постоянной температуре скорость химической реакции пропорциональна произведениюконцентраций реагирующих веществ, причём каждая концентрация входит в произведение в степени, равной коэффициенту, стоящей перед формылой данного вещества в уравнении реакции. Коэффицмент пропорциональности называется константой скорости данной реакции. Она не зависит от концентрации реагирующих веществ, а зависит от их природы, температуры и присутствия катализаторов. При увеличении концентрации скорость увеличивается.
3. Правило Вантгофа: скорость Х.Р. увеличивается в 2-4 раза при увеличении температуры на 10 градусов.
Для образования новых веществ необходимо, чтобы происходило соударение молекул реагирующих веществ, а следовательно, ослабление или разрыв связей между атомами. Но чтобы разорвать или ослабить связь молекулы должны обладать большой энергией. Не все молекулы такой энергией обладают. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активизации данной реакции. Энергию активизации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуты число активных молекул возрастает. Отсюда следуе, что скорость реакции должна увеличиться с повышением температуры.
4. Скорость выше, если площадь соприкосновения больше (мел).
5. катализатор - это химическое вещество, ускоряющее х.р. Ингибитор - это х. вещество, замедляющее х.р.
БИЛЕТ 17
Ионные реакции обмена. Смещение ионных равновесий. Поведение амфотерных гидроксидов.
При составлении ионных уравнений реакций следует учитывать:
1. простые вещества, оксиды, нерастворимые кислоты, основания и соли не диссоциируют;
2. для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов;
3. если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым;
4. сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Обычно сначала записывают молекулярное уравнение реакции, затем с помощью таблицы растворимости определяют растворимость каждого вещества, составляют полное ионное уравнение и наконец, краткое ионое уравнение путём исключения ионов из левой и правой частей уравнения, которые в ходе реакции не претерпели изменений.
Реакция ионного обмена - это реакция между ионами, образовавшимися в результате диссоциации электролитов. Они протекают до конца в следующих случаях:
1. если образуется осадок;
2. если выделяется газ;
3. если образуется малодиссоциирующее вещество - вода.
Если в растворах нет таких ионов, которые могут связываться между собой с образованием осадка, газа или воды, то такая реакция называются обратимой.
Равновесие в растворах электролитов, также как и всякое химическое равновесие, сохраняется неизменным, пока определяющие его условия не меняются; изменение условий влечёт за собой нарушение равновесия.
Так, равновесие нарушается при изменении концентрации одного из участвующих в этом равновесии ионов: при её увеличении происходит процесс, в ходе которого эти ионы связываются.
1. Введение в раствор слабого электролита одноимённых ионов уменьшает степень диссоциации этого элемента;
2. растворимость электролитоа уменьшается от введения в раствор одноимённых ионов.
1 и 2 влекут за собой изменение концентрации ионов.
Основания
- этоэлектролиты, диссоциирующие в
растворах с отщеплением гидроксид-ионов.
Чем больше константа диссоциации данного
основания, тем оно сильнее. Существуют
гидроксиды, способные вступать во
взаимодействие и образовывать соли не
только с кислотами, но и с основаниями.
К таким гидроксидам принадлежит гидроксид
цинка. При взаимодействии его, например,
с соляной кислотой образуется хлорид
цинка, а при взаимодействии с гидроксидом
натрия - цинкат натрия. Гидроксиды,
обладающие этим свойством, называются
амфотерными гидроксидами или амфотерными
электролитами. Явление амфотерности
объясняется тем, что в молекулах
амфотерных электролитов прочность
связи между металлом и кислородом
незначительно отличается от прочности
связи между кислородом и водородом.
Диссоциация таких молекул возможна,
следовательно, по местам обеих этих
связей.Если обозначить амфотерный
электролит через ROH,
то его диссоциацию можно выразить
схемой:![]() .
Таким образом, в растворе амфотерного
электролита существует сложное
равновесие, в котором участвуют продукты
диссоциации как по типу кислоты, так и
по типу основания.
.
Таким образом, в растворе амфотерного
электролита существует сложное
равновесие, в котором участвуют продукты
диссоциации как по типу кислоты, так и
по типу основания.
БИЛЕТ 18
Электролитическая диссоциация воды. Водородный показатель pH. Ионное произведение воды. Понятие об индикаторах.
Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы. По величине электропроводности чистой воды можно определить концентрацию ионов водорода и гидроксид-ионов в воде.
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул в воде практически равна общей концентрации воды, поэтому из выражения для константы диссоциации воды получакм, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными. В кисдых растворах больше ионов водорода, в щелочных - гидроксид-ионов. Но произведение их концентраций всегда постоянно. Это означает, что если известна концентрация ионов водорода в водном растворе, то тем самым и определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щёлочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
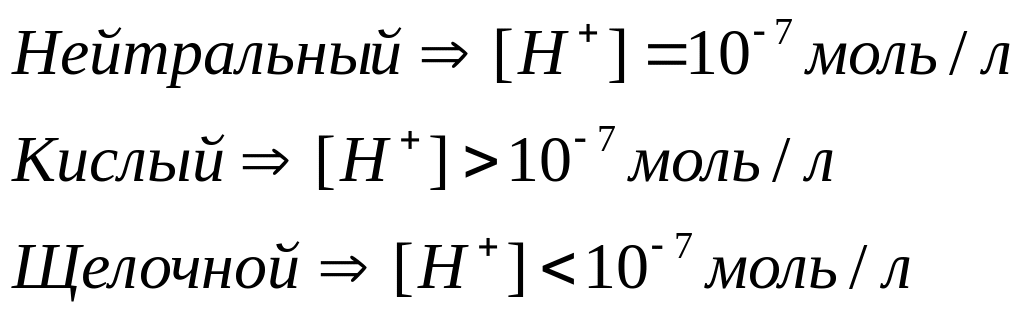
Кислотность
или щёлочность раствора можно выразить
более удобным способом: вместо концентрации
ионов водорода указывают её десятичный
логарифм, взятый с обратным знаком.
Последняя величина называется водородным
показателем и обозначается рН:
![]() .
Отсюда ясно, что в нейтральном растворе
pH=7;
в кислых растворах рН<7 и тем меньше,
чем кислее раствор; в щелочных растворах
рН>7, и тем больше, чем больше щёлочность
раствора.
.
Отсюда ясно, что в нейтральном растворе
pH=7;
в кислых растворах рН<7 и тем меньше,
чем кислее раствор; в щелочных растворах
рН>7, и тем больше, чем больше щёлочность
раствора.
Для измерения рН существуют различные методы. Приближённо реакцию раствора можно определить с помощью специальных реакторов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространены метиловый оранжевый, метиловый красный, фенолфталеин и лакмус.
Билет 12
Обратимые и необратимые реакции. Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье. Смещение химического равновесия в гомогенных и гетерогенных системах.
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают только в одном направлении до конца - до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция может протекать как в прямом, так и в обратном направлении.
Рассмотрим изменение скоростей прямой и обратной реакций с течением времени. Внаяале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной равна нулю. По мере протекания реакции исходные вещества расходуются и их концентрация уменьшается, вследствие чего уменьшается скорость прямой реакции. Одновременно идёт процесс образования новых веществ. Их концентрация увеличивается, а значит растёт и скорость обратной реакции. Когда скорости прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие. Химическое равновесие называют динамическим. Этим подчёркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной
характеристикой химического равновесия
служит величина, называемая константой
химического равновесия. При постоянной
температуре константа равновесия
обратимой реакции представляет
собойпостоянную величину, показывающую
то соотношение между концентрациями
продуктов реакции и исходных веществ,
которое устанавливается при равновесии:
![]()
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечёт за собой изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношене между ними вновь отвечает константе равновесия. Численное значение константы равновесия в первом приближении характеризует выход данной реакции. В случае гетерогенных реакций в выражение константы равновесия, так же как и в закон действия масс, входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Величина константы равновесия зависит от природы реагирующих веществ и от температуры и не зависит от присутствия катализаторов.
Химическое равновесие сохраняется до тех пор, пока остаются неизменными концентрация реагирующих веществ, температура и давление. Смещение химического равновесия происходит по принципу Ле-Шателье: при изменении внешних условий химическое равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это внешнее воздействие. Таким образом, при повышении температуы равновесие смещается в сторону эндотермической реакции, а при понижении - в сторону экзотермической реакции; при повышении давления химическое равновесие смещается в сторону уменьшения объёма, а при понижении давления - в сторону увеличения объёма; при увеличении концентрации равновесие смещается в сторону уменьшения её. Введение катализатора не влечёт за собой смещение химического равновесия, т.к. одновременно увеличиваются скорость как прямой, так и обратной реакций.
БИЛЕТ 13
Способы выражения состава раствора
I сп. Массовая доля (ω) показывает какую часть от данной массы раствора составляет масса растворенного вещества.
![]()
II сп. Молярная концентрация (С(х)) определяется числом молей растворенного вещества, содержащихся в 1 литре расвора.
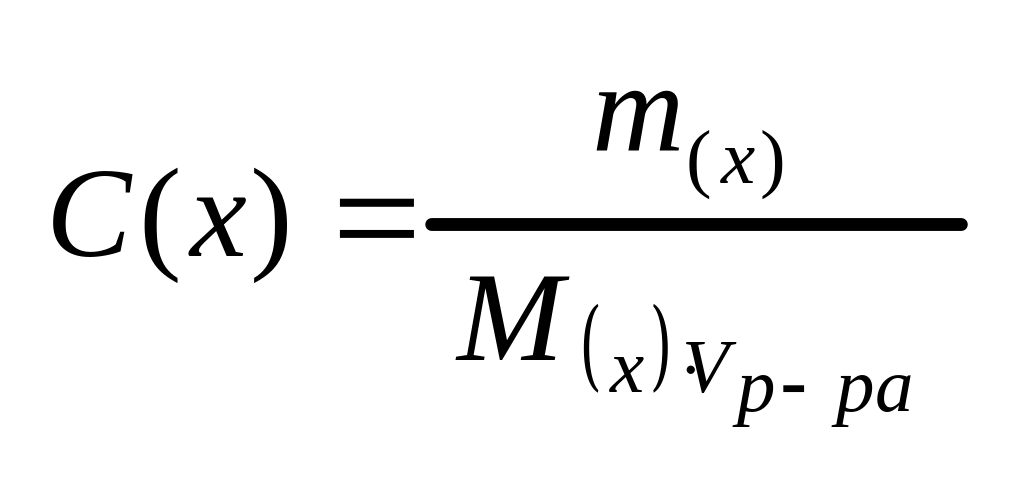
![]()
III
сп.
Молярная концентрация эквивалента (![]() )
определяется
числом молей эквивалентного вещества,
содержащегося в 1 литре раствора.
)
определяется
числом молей эквивалентного вещества,
содержащегося в 1 литре раствора.
![]()
![]()
IV сп. Моляльная концентрация (СМ(х)) определяется числом молей растворенного вещества, приходящегося на 1 кг растворителя.
![]()
V сп. Титр раствора определяется массой растворенного вещества в граммах, содержащегося в 1 мл раствора.
![]()
![]()
![]()
Раствором называется твердая или жидкая гомогенная система, состоящая из 2 или более компонентов, относительное количество которых может изменяться в широких размерах.
Раствор, находящийся в равновесии с молекулами растворенного вещества называется насыщенным.
Растворитель + кристалл = молекула в растворе
Гидраты и кристаллогидраты:
Количество теплоты, которое выделяется или поглощается при растворении 1 моля вещества называется теплотой растворения вещества.
Соединения, образующиеся при взаимодействии молекул или ионов растворенного вещества с молекулами растворителя называются сольватами, процесс образования сольватацией.
Если растворителем является вода, соединения называются гидратами, а процесс гидратацией.
Вещества, в состав которых входят молекулы воды называются кристаллогидратами.
БИЛЕТ 14
Растворы электролитов. Неподчтнение растворов электролитов законам Вант-Гоффа и Рауля.
Электролиты
- это вещества, растворы и расплавы
которых проводят электрический ток
(кислоты, соли, щёлочи). Эти растворы
сильно отклоняются от всех рассмотренных
законов. Для них осмотическое давление,
понижение давления пара, изменения
температур кипения и замерзания всегда
больше, чем это отвечает концентрации
раствора. Например, понижение температуры
замерзания раствора, содержащего 1г
NaCl
в 100 г воды, почти вдвое превышает
изменение температуры замерзания,
вычисленное по законам Рауля. Во столько
же раз и осмотическое давление этого
раствора больше теоретической величины.
Чтобы распространить уравнение
осмотического давления на растворы
электролитов, Вант-Гофф ввёл в него
поправочный коэффициент i
(изотонический коэффициент), показывающий,
во сколько раз осмотическое давление
данного раствора больше "нормального":
![]() .
Коэффициент i
определяется для каждого раствора
экспериментальным путём - например по
понижению давления пара, или по понижению
температуры замерзания, или по повышению
температуры кипения:
.
Коэффициент i
определяется для каждого раствора
экспериментальным путём - например по
понижению давления пара, или по понижению
температуры замерзания, или по повышению
температуры кипения:
![]()
Способность электролитов в растворах проводить электрический ток и их отклонения от законов Рауля и Вант-Гоффа объясняет теория электролитической диссоциации Аррениуса.
Теория электролитической диссоциации. Зависимость направления диссоциации от характера химических связей в молекуле.
Способность электролитов в растворах проводить электрический ток и их отклонения от законов Рауля и Вант-Гоффа объясняет теория электролитической диссоциации Аррениуса.
1. В растворах молекулы электролитов диссоциируют на положительно и отрицательно заряженные ионы. Раствор в целом электронейтрален. Благодаря наличию электрически заряженных частиц, через раствор электролитов проходит электрический ток.
2. Свойства ионов отличаются от свойств нейтральных атомов.
3. Ионы движутся беспорядочно, но при пропускании электрического тока приходят в направленное движение. Положительно заряженные ионы движутся к катоду и называются катионами (металлы и водород); отрицательно заряженные ионы движутся к аноду и называются анионами (кислотные остатки и гидроксид ионы).
4. Объясняет отклонения растворов электролитов от законов Рауля и Вант-Гоффа. Это связано со способностью молекул элекиролита диссоциировать на ионы. Понижение температуры кристаллизации и повышении температуры кипения зависит исклюсительно от числа растворённых частиц.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Этой теории противостояла химическая теория растворов Менделеева, в основе которой лежало представление о взаимодействии растворённого вещества с растворителем. В преодалении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому учёному Каблукому, впервые высказавшему предположение о гидратации ионов. Развитие это идеи привело в дальнейшем к объединению этих теорий.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая. Один из них это диссоциация растворяющихся солей, т.е. кристаллов с ионной связью в молекуле, второй - диссоциация при растворении кислот, т.е. веществ, состоящих из полярных молекул с ковалентной связью.
Когда кристалл соли попадает в воду происходит постепенное его растворение. Слой за слоем полярные молекулы воды, находящиеся в движении в результате соударений отделяют ионы от кристалл и переводят их в раствор. Иначе протекает диссоциация полярных молекул. Молекулы воды вызывают расхождение полюсов притянутой молекулы - поляризуют её. Такая поляризация в комбинации с колебательным тепловым движением атомов, а также с непрерывным тепловым движением окружающихеё молекул приводит к распаду полярной молекулы на ионы и они гидратируются. При этом ион водорода Н+ прочно связывается с молекулой воды и образует ион гидроксония Н3О+.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому кроме воды, многие жидкости, состоящие из полярных молекул, являются ионизирующими растворителями.
БИЛЕТ 15-16
Степень электролитической диссоциации, её зависимости от концентрации. Сильные и слабые электролиты.
Если бы электролиты полностью диссоциировали на ионы, то осмотическое давление и другие пропорциональные ему величины всегда были бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Но ещё Вант-Гофф установил, что коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует на ионы, и ввёл понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые. Сильные электролиты в водных растворах диссоциированы практически полностью. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. К сильным электролитам принадлежат почти все соли и основания. К слабым электролитам относятся большинство органических кислот, слабые неорганические кислоты, гидрат аммония и др.
Степень диссоциации принято обозначать греческой буквой альфа и выражать либо в долях единицы, либо в процентах. Степень диссоциации зависит от концентрации. И для слабых, и для сильных электролитов степень диссоциации возрастает при разбавлении раствора, а с ростом концентрации степень диссоциации падает. Но для первых это происходит вследствие образования молекул, а для вторых - вследствие увеличения тормозящего действия ионной атмосферы.
Константа диссоциации слабых электролитов. Ступенчатая диссоциация.
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы рвновесия. Тогда в числителе дроби будут стоять концентрации ионов - продуктов диссоциации, а в знаменателе - концентрация недиссоциированных молекул. Константа равновесия , отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Первое равновесие - диссоциация по первой ступени - характеризуется константой диссоциации К1, второе - диссоциация по второй ступени - константой К2 и т.д. Суммарному равновесию отвечает суммарная константа диссоциации К. Эти величины связаны друг с другом соотношением: К=К1К2К3... . Аналогичные соотношения характеризуют и ступенчатую диссоциацию оснований многовалентных металлов.
Константа диссоциации
Константа равновесия, отмечающая диссоциации слабого электролита называется константой диссоциации.
H2CO3=H++HCO3- I ступень

HCO3-= H++CO32- - II ступень

Суммируем КI + КII
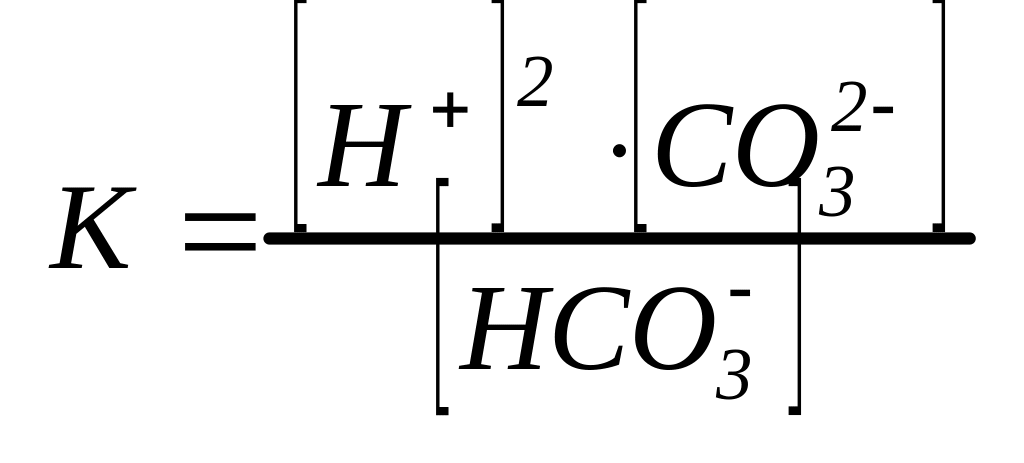
К=КI∙КII
Обозначив через С-концентрацию электролита, способного дисоциировать на 2 иона
Сα-концентрация каждого из видов ионов
С(1-α)- концентрация нераспавшихся
![]()
![]()
![]()
![]()
Пусть
α<<1, тогда α![]()
С разбавлением раствора степень диссоциации увеличивается
БИЛЕТ 19
Гидролиз солей. Типичные случаи гидролиза. Константа гидролиза.
Гидролизом
назыается взаимодействие вещества с
водой, при котором составные части
вещества соединяются с составными
частями воды. Гидролизу подвержены
соединения различных классов. Рассмотрим
гидролиз солей. Реакция взаимодействия
солей с водой с образованием кислоты и
основания есть гидролиз солей. В реакции
гидролиза вступают соли, образованные
слабой кислотой и слабым основанием,
или слабой кислотой и сильным основанием,
или слабым основанием и сильной кислотой.
Соли, образованные сильной кислотой и
сильным основанием гидролизу не
подвергаются; нейтрализация в этом
случае сводится к процессу:
![]() ,
а обратная реакция - разложение воды на
ионы - протекает в ничтожно малой степени.
,
а обратная реакция - разложение воды на
ионы - протекает в ничтожно малой степени.
Гидролиз соли, образованной сльным основанием и слабой кислотой идёт ступенчато, в основном по первой ступени. Растворы таких солей имеют щелочную реакцию. При гидролизе солей, образованных слабым основанием и сльной кислотой образуются растворы, имеющие кислую реакцию. Соли, образованные слабым основанием и слабой кислотой, подвергаются полному гидролизу, т.е. не остаётся ни ионов водорода, ни гидроксид-ионов.
Запишем
уравнение гидролиза в общем виде:
![]() .
.
Этому равновесию соответствует константа:
![]() .
.
Концентрация воды практически постоянная величина.
Обозначая К[H2O]=Kг, получим:
![]() .
.
Величина Кг называется константой гидролиза соли. Её значение характеризует способность данной солиподвергаться гидролизу; чем больше Кг, тем в большей степени протекает гидролиз.
Для случая соли, образованной слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации кислоты зависимостью:
![]() .
.
Это
уравнение показывает, что чем слабее
кислота, тем в большей степени подвергаются
гидролизу её соли. Аналогично, для солей,
образованных слабым основанием и сильной
кислотой:
![]() .
Поэтому, чем слабее основание, тем в
большей степени подвергаются гидролизу
образованные им соли.
.
Поэтому, чем слабее основание, тем в
большей степени подвергаются гидролизу
образованные им соли.
БИЛЕТ 20
Реакция Окисления-восстановления (ОВР). Степень окисления. Окислительное число. Методика составления уравнений ОВР. Важнейшие окислители и восстановители.
Неравномерность распределения электронов между атомами в соединениях получила название окисленности. Степенью окисления атома в молекуле называется заряд данного атома, вызванный смещением валентных электронов в сторону более электроотрицательного атома. При этом элемент, электроны которого смещаются к атомам другого элемента, проявляет положительную степень окисления, а тот элемент, к атомам которого эти электроны смещаются, - отрицательную. Число электронов, смещённых от одного атома данного элемента или к одному атому данного элемента, называется окислительным числом.
Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстановительными. Процесс отдачи электронов, сопровождающийся повышением степени окисления элемента, называется окислением. А процесс присоединения электронов, сопровождающийся понижением степени окисления элемента, называется восстановлением. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, - окислителем.
Суть ОВР: число электронов, отдаваемых молекулами восстановителя, равно числу электронов, присоединяемых молекулами окислителя.
Составление уравнений ОВР проводится в определённом порядке:
1. Составить схему реакции с указанием исходных и образующихся веществ;
2. определить степени окисления элементов в веществах правой и левой части схемы; отметить элементы, степень окисления которых изменилась;
3.составить уравнения процессов восстановления и окисления; найти отношение числа электронов, принимаемых при восстановлении и отдаваемых при окислении;
4. Сложить уравнения окисления и восстановления с учётом найденного отношения числа электронов.
Типичными восстановителями являются активные металлы, такие как аллюминий, магний, натрий, калий, цинк и др., соединения металлов, в которых степень окисления металла велика: аммиачный раствор оксида серебра, сульфата меди; хлорид ртути, диоксид свинца и др. Восстановителям могут также быть соединения, которые содержат неметаллы, проявляющие отрицательную степень окисления. Важнейшими восстановителями являются водород, углерод и оксид углерода (II).
К сильным окислителям принадлежат неметаллы верхней части VI и VII групп периодической системы. Самые сильные окислители - это фтор, но на практике чаще всего используют кислород, хлор и бром. К соединениям, используемым в качестве окислителей, относятся кислоты, особенно, соляная, серная и азотная.
БИЛЕТ 23-25
Понятие об электродных потенциалах. Водородный электрод. Понятие о стандартных потенциалах. Ряд напряжений. Уравнение Нернста.
Устройства, которые применяют для непосредсьвенного преобразования энергии химической реакции в электрическую энергию, называются гальвоническими элементами.
Когда ОВР протекает в ГЭ или осуществляется путём электролиза, то каждая полуреакция (О или В) протекает на соответствующем электроде: на аноде - окисление, на катоде - восстановление.; поэтому полуреакции называют также электродными процессами. В соответствии с разделением ОВР на две полуреакции, ЭДС также принято представлять в виде разности двух величин, каждая из кторых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов: 1) от природы веществ - участников электродного процесса, 2) от активностей веществ и 3) от температуры.
Эта зависимость выражается уравнением:
![]() .
.
Для
ЭДС ГЭ имеем аналогичную зависимость:![]() .Для
стандартной температуры имеем
соответственно:
.Для
стандартной температуры имеем
соответственно:
![]() .
Здесь
0-
стандартный электродный потенциал
данного процесса - константа; Е0-
стандартная ЭДС. Последняя зависимость
носит название формулы Нернста.
.
Здесь
0-
стандартный электродный потенциал
данного процесса - константа; Е0-
стандартная ЭДС. Последняя зависимость
носит название формулы Нернста.
Физический смысл стандартного потенциала становится ясным при рассмотрении случая, когда концентрации, а значит и активности всех веществ, участвующих в данном процессе, равны единице. При этом условии второе слагаемое правой части уравнения обращается в нуль и уравнение принимает вид:.Концентрации (активност), равные единице, называются стандарнтными. Поэтому и потенциал, отвечающий этому условию, называется стандартным потенциалом.
Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы берут электродный потенциал водородного электрода. Водородный электрод представляет собой платиновую пластинку, электролитиически покрытую губчатой платиной и погружённую в раствор кислоты, через который пропускается водорд. Водород хорошо растворяется в платине; пр этом молекулы водорода распадаются на атомы. На поверхности соприкосновения платины с раствором кислоты модет протекать окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет роль губки, пропитанной атомарным водородом.
Если
из всего ряда стандартных электродных
потенциалов выделить только те электродные
процессы, которые отвечают общему
уравнению:
![]() ,
то получим ряд напряжений металлов. В
этот ряд всегда помещают, кроме металлов,
также водород, что позволяет видеть,
какие металлы способны вытеснять водород
из водных растворов кислот. Положение
того или иного металла в ряду напряжений
характеризует его способность к ОВ
взаимодействиям в водных растворах при
стандартных условиях.
,
то получим ряд напряжений металлов. В
этот ряд всегда помещают, кроме металлов,
также водород, что позволяет видеть,
какие металлы способны вытеснять водород
из водных растворов кислот. Положение
того или иного металла в ряду напряжений
характеризует его способность к ОВ
взаимодействиям в водных растворах при
стандартных условиях.
Стандартные потенциалы
Ряд стандартных потенциалов:
2Н++2ē=Н2 (φ0=0)
Чем дальше в ряду стандартных потенциалов металлов находится металл, тем более сильными окислительными свойствами обладают его ионы.
Чем ближе металл находится к началу ряда, тем более сильными восстановительными свойствами обладают его ионы.
Металлы начала ряда стандартных потенциалов – активные металлы от Li до Mg способны вытеснять водород из воды.
Металлы, расположенные до Н способны вытеснять из кислот.
БИЛЕТ 26
Электролиз. Последовательность разрядов ионов на электродах. Явление перенапряжения. Электролиз с растворимыми и нерастворимыми электродами.
Электролизом называется ОВ процесс, протекающий при пропускании постоянного электрического тока через раствор или расплав электролита. Возможные процессы: на катоде могут восстанавливаться ионы водорода, если среда кислая, ионы водорода из воды, если щелочная, ионы металла, на аноде могут окисляться кислотные остатки, могут окисляться гидроксид ионы, если среда щелочная, воды - если кислая или нейтральная.
Из растворов солей химически активные Ме, стоящие в ряду стандартных потенциалов до аллюминия включительно, на электроде не восстанавливаются, а восстанавливаются ионы водорода. На катоде легче всего восстанавливаются ионы менее активных Ме, стоящих в РСП после водорода. Из растворов солей Ме, которые расположены между аллюминием и водородом, восстанавливаются, но и возможно восстановление ионов водорода.
Процессы, протекающие при электролизе обратны процессам, идущим при работе гальвонического элемента: при электролизе химическоя реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Таким образом при электролизе возникает ГЭ (зарядка).
При рассмотрении анодных процессов следует иметь в виду, что на аноде может идти процесс окисления материала самого электрода. В связи с этим различают электролиз с растворимым и нерастворимым анодом. Нерастворимым называется анод, материал которого не претерпевает окисления в ходе электролиза. Растворимым называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для первого случая чаще всего применяют графит, уголь, платину. На нерастворимом аноде при электролизе водных растворов щелочей и фторидов происходит электрохимическое окисление воды с выделением кислорода. При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы (отрицательно заряженные ионы). Эта аномалия связана со значительным перенапряжением второго из этих процессов - материал анода оказывает тормозящее действие на процесс выделения кислорода.В случае растворимого анода число конкурирующих окислительных процессов возрастает до трёх : электрохимическое окисление воды с выделением кислорода, разряд аниона и электрохимическое окисление металла анода. Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в РСП раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Перенапряжение - это дополнительное напряжение, необходимое для того, чтобы прцесс электролиза пошёл. Чтобы процесс электролиза протекал, внешнее напряжение должно быть по крайней мере равно ЭДС возникшего ГЭ. Это напряжение называется теоретическим потенциалом разложения. Но на практике внешнее напряжение должно быть несколько больше, чем ЭДС возникшего ГЭ и подбирается практически.
Существует таблица перенапряжений. Перенапряжением выделения водорода называется смещение или сдвиг потенциала выделения водорода в сторону более отрицательных значений при при его выделении на данном материале по сравнению с выделением его на чернёной платине.
БИЛЕТ 28
Применение электролиза. Законы Фарадея.
С количественной стороны процесс электролиза впервые был изучен в 30-х годах 19 века выдающимся английским физиком Фарадеем, который в результате своих исследований установил законы электролиза:
1. Количество вещества, выделяющееся на электродах, пропорционально количеству пропущенного электричества и не зависит от других причин:
![]()
, где k- электрохимический эквивалент.
2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств вещества:
![]() ,
где Мэ - молярная масса эквивалента
вещества, F-
число Фарадея (F=96500
Кл=26,8 А*ч);
,
где Мэ - молярная масса эквивалента
вещества, F-
число Фарадея (F=96500
Кл=26,8 А*ч);
![]() ,
где V-
объём выделяющегося газа при н.у. в
литрах, Vэ
- объём моля эквивалентов газа.
,
где V-
объём выделяющегося газа при н.у. в
литрах, Vэ
- объём моля эквивалентов газа.
Важнейшее применение электролиз находит в металлургической и химической промышленности м в гальванотехнике. В металлургической промышленности электролизом расплавленных соединений получают металлы, а также производят электролитичесок рафинирование - очистку металлов от вредных примесей и извлечение ценных компонентов.
К гальванотехнике относятся гальваностегия и гальванопластика. Процессы гальваностегии представлюят собой нанесение путём электролиза на поверхность металлических изделий слоёв других металлов для предохранения этих изделий от коррозии, для придания их поверхностьи твёрдости, а также в декоративных целях. Важнейшими являются хромирование, цинкование и никелирование. Гальванопластикой называются процессы получения точных металлических копий с рельефных предметов электроосаждением металла. Путём гальванопластики изготовляют матрицы для прессования различных изделий, для тиснения кожи и бумаги; печатные радиотехнические схемы и др. К гальванопластике относятся также другие виды электрохимической обработки: электрополирование стали, оксидирование аллюминия, магния. Это приводит к повышению коррозиционной стойкости металла, а также металл преобретает красивый внешний вид.
В химической промышленности методом электролиза получают различные вещества.
БИЛЕТ 29-32
Коррозия металлов. Основные виды коррозии. Сущность процесса электрохимической коррозии. Коррозия под действием блуждающих токов. Формы коррозий. Методы защиты металлов от коррозии. Защитные покрытия. Металлические покрытия (анодные и катодные). Протекторная защита. Ингибиторы коррозии.
Коррозия - это химическое или электрохимическое разрушение под воздействием окружающей среды. Различают химическую и электрохимическую коррозию. Химическая коррозия возникает при действии на Ме сухих газов (атмосферного кислорода, водорода, сероводорода) или жидкостей неэлектролита (бензин, спирт). Химической коррозии подвергаются Ме при высоких температурах (в ракетных двигателей).
Электрохимическая коррозия возникает при действии на Ме жидкости электролита. При этом образуется короткозамкнутые ГЭ или коррозионные пары. Появляется местные электрические токи. Сущность электрохимической коррозии: технические Ме не бывают чистыми. Пусть в контакте находятся два Ме. Во влажном воздухе или в жидкости идёт атмосферная коррозия.
Коррозия, сопровождающаяся восстановлением молекул кислорода, растворённого в электролите, называется коррозией с кислородной деполяризацией. Коррозия, сопровождающая восстановлением молекул водорода, называется коррозией с водородной деполяризацией.
Причины коррозии.
Внутренние факторы коррозии:
1. природа самого Ме. s-элеметы легко подвергаются коррозии, d-элементы подвергаются коррозии в меньшей степени, т.к. покрываются оксидной плёнкой, которая предохраняет их от коррозии (пассивирование).
2. наличие красителей. Химически чистые Ме коррозии почти не подвергаются.
3. шероховатости на поверхности Ме. Чем лучше отполирована поверхность Ме, тем коррозия меньше.
Внешние факторы:
1. влияние среды. Сильно влияет рН среды. В концентрированной серной и азотной кислотах происходит пассивирование Ме и Ме подвергается коррозии в меньшей степени. Особенно энергично протекает коррозия в растворах соляной и разбавленной серной кислотах.
2. температура. С повышением температуры коррозия увеличивается. Если среда водная, а температура высокая, то температура может препятствовать коррозии, т.к. растворимость кислорода в воде уменьшается. При перемешивании электролита коррозия увеличивается.
Коррозия под действием блуждающих токов.
Блуждающие токи возникают от рельсового электротранспорта. Токи уходят в землю и замыкаются подземными металлическими конструкциями. В рельсах имеются стыки. Если стык не защищён, его сопротивление большое и токи уходят в землю. Происходит процесс с растворимыми анодами: на аноде идёт окисление железа. Идёт коррозия в этом месте. Те электроны, которые отдаёт железо и составляют блуждающий ток. Они восстанавливают растворённый кислород из влажной почвы. Основной ток дальше идёт по трубопроводу и возвращается в рельс. Идёт коррозия самого рельса.
Виды коррозии: 1) равномерная, 2) пятна на поверхности Ме, 3) точечная (маленькие язвы), 4) питтинг (глубокие язвы), 5) межкристаллическая (самая опасная, разрушающая структуру Ме).
Методы защиты Ме от коррозии.
1) обработка коррозионной среды - удаление из раствора, в котором эксплуатируется деталь, растворённого кислорода или добавление ингибиторов, т.е. веществ, замедляющих коррозию. Защитное действие последних обусловлено тем, что их молекулы или ионы адсорбируются на поверхности Ме и каталитически снижают скорость коррозии, а некоторые из них приводят Ме в пассивное состояние.
2) покрытия: химические (оксидирование - создание на поверхности Ме оксидных плёнок под действием сильных окислителей; анодирование - покрытие Ме оксидной плёнкой путём электролиза; фосфотирование - создание на поверхности Ме плёнки из солей фосфорной кислоты. Эта плёнка пористая и является хорошей основой для лакокрасочных покрытий), нехимические (лаками, красками, эмалями, полимерными материалами) и металлические (различают два вида металлических покрытий: катодное и анодное. В первом случае защищаемое вещество покрывают слоем никеля (катод). На катоде идёт восстановление молекул кислорода, а сам материал катода не разрушается. Во втором случае материал покрывается кадмием (анод). На катоде восстанавливается ионы водорода и молекулы кислорода, а целостность покрытия нарушается).
3) протекторная защита. Металлические конструкции приводятся в соприкосновение с большой поверхностью более активного Ме. Ме разрушается, а конструкция сохраняется. Так защищают днища судов от коррозии.
4) электрозащита. К внешнему источнику тока присоединяют защищаемую конструкцию (к катоду), а к аноду присоединяют ненужный металлолом. Идёт коррозия с растворяемым анодом.
БИЛЕТ 37
Строение электронных оболочек атома. Принцип Паули и наименьшей энергии. Правило Гунда. S-,P-,D-,F-электроны.
В зависимости от значений главного квантового числа, существуют 7 различных элекиронных слоев (оболочек), которые ещё называют энергетическими уровнями. Для энергетических уровней в атоме, соответствующих различным значениям n, приняты следующие обозначения: 1-K,2-L,3-M,4-N,5-O,6-P,7-Q. Энергетические уровни состоят из энергетических подуровней, которые определяются значением орбитального квантового числа. Этим подуровням присвоены следующие обозначения: 0-s,1-p,2-d,3-f. В соответсвии с этими обозначениями говорят об s-подуровне, p-подуровне и т.д. Электроны, характеризующиеся значениями побочного квантового числа 0,1,2,3, называют, соответсвенно, s-электронами, p-электронами, d-электронами, f-электронами. При данном значении главного квантового числа наименьшей энергией обладают s-электроны, затем p-,d-,f-электроны.
Орбитальное квантовое число определяет форму электронного облака. Вывод об этом вытекает из физического смысла квантового числа l: оно определяет знеачение орбитального момента количества движения электрона. Например, электронное облако s-электрона имеет форму шара, p-электрона - форму гантели или двойной груши, d-электрона - "четырёхлепесковой фигуры" и т.д.
На каждом энергетическом уровне, как и на каждом энергетическом подуровне может находиться фиксированное число электронов. Их максимальное количество можно подсчитать, пользуясь принципом Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Из этого следует, что каждая атомная орбиталь, характеризующаяся определёнными значениями n,m и l, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными. Таким образом, максимальное число электронов на энергетических подуровнях выражается формулой 2(2l+1), а на энергетическом уровне: 2n2. Распределение электронов по атомным орбиталям идёт по принципу наименьшей энергии.Наиболее устойчивое состояние электрона в атоме соответствует минимальному возможному значению его энергии. Любое другое его состояние является возбуждённым, неустойчивым: из него электрон самопроизвольно переходит в состояние с более низкой энергией. Поэтому сначала заполняется 1s-подуровень, затем 2s,2p,3s,3d,3d и т.д. В самом энергетическом подуровне порядок размещения электронов в атоме подчиняется общей закономерности, выражаемой правилом Гунда: устойчивому состоянию атома соответсвует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
БИЛЕТ 38
Последовательность заполнения электронных орбиталей в атомах
На каждом энергетическом уровне, как и на каждом энергетическом подуровне может находиться фиксированное число электронов. Максимальное число электронов на энергетических подуровнях выражается формулой 2(2l+1), а на энергетическом уровне: 2n2. Распределение электронов по атомным орбиталям идёт по принципу наименьшей энергии. Наиболее устойчивое состояние электрона в атоме соответствует минимальному возможному значению его энергии. Любое другое его состояние является возбуждённым, неустойчивым: из него электрон самопроизвольно переходит в состояние с более низкой энергией. Поэтому сначала заполняется 1s-подуровень, затем 2s,2p,3s,3d,3d и т.д.
Правило Клечковского:
При увеличении заряда ядра атома последовательное заполнение электронных орбиталей приосходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы.
При одинаковых значениях суммы (n+l) заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа n.
БИЛЕТ44
Донарно-акцепторная связь. Понятие о комплексных соединениях. Водородная связь.
Во многих случаях ковалентная связь возникает не только за счёт свободных электронов, но и за счёт спаренных электронов, имеющихся во внешнем электронном слое атома (донара электронной пары) и свободной орбитали другого атома (акцептора электронной пары). Такой способ образования ковалентной связи называется донарно-акцепторным.
Комплексные соединения - это обширный и разнообразный класс соединений., имеющих в своём составе комплексные ионы. Основоположником теории комплексных соединений является Вернер. Он объяснил их строение. Чугаев изучил свойства комплексных соединений, а Черняев изучил влияние на них лигандов. Комплексные соединения состоят из внутренней сферы (комплексного иона), которая включает в себя комплексообразователь и лиганды, т.е. некоторое число противоположно ему заряженных ионов или электронейтральных молекул, и внешней сферы, т.е. остальных ионов. Координационное число - это число лигандов. Метод валентных связей в приложении к комплексным соединениям базируется на тех же представлениях, что и в простых соединениях. При этом принимается во внимание, что химические связи, возникающие при комплексообразовании, имеют донарно-акцепторное происхождение. Комплексные соединения применяются в аналитической химии для распознавания веществ, для разделения металлов, для устранения жёсткости воды, в качестве биостимуляторов и красителей, в строительстве, в химической промышленности, биотехнологии, здравоохранении и экологии.
Связь между атомом водорода и атомом сильноэлектроотрицательного элемента, называется водородной. Условием образования водородной связи является высокая электроотрицательность атома, непосредственно связанного в молекуле с атомом водорода. Водородная связь характерна для соединений самых электроотрицательных элементов: сильнее всего она проявляется у соединений фтора и кислорода, слабее - у соединений азота и ещё слабее - у соединений хлора и серы. Энергия водородной связи значительно меньше энергии обычной ковалентной связи. Водородная связь служит причиной некоторых важных особенностей воды, она в значительной степени определяет свойства и таких биологически важных веществ как белки и нуклеиновые кислоты
БИЛЕТ 33
