
- •Laboration – Allt du lärt dig
- •Värden för elektronegativiteter och valenselektroner hos de ämnen som ingick I laborationen:
- •Värden för massa, molmassa och substansmängd för den jod och zink VI hade före reaktionen:
- •Vattnets massa mättes aldrig och dessa värden kan därför inte beräknas för vatten. För att kunna göra fler beräkningar bör VI vid nästa laboration tänka på att mäta även vattnets massa och volym.
Laboration – Allt du lärt dig
Syfte:
Befästa de begrepp vi jobbat med under året.
Hypotes:
Jag tror att det kommer att bildas zinkjodid (ZnI2) när zinken och joden blandas. När det avjonade vattnet sedan tillsätts tror jag att det bildas zinkoxid (ZnO), jodgas (I2) och vätgas (H2) enligt formlerna nedan:
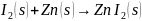
Jod har 7 valenselektroner och vill alltså ha en till, medan zink har två valenselektroner och gärna vill ge ifrån sig dessa. Detta gör det troligt att två jodatomer tar upp var sin valenselektron från en zinkatom.
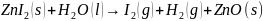
Zink är en väteutdrivande metall, det vill säga oädlare än väte samtidigt som jod är ädlare än väte. Detta borde innebära att jod lätt återgår till sin grundform (I2). Även väte har lättare att vara i grundform än zink, vilket borde göra att zink är kvar i jonform och binder med vattnets syre samtidigt som vätet blir fritt i form av vätgas.
Materiel:
Del I
Pulveriserad zink
Jod
2 Bägare 50-100 ml
Glasstav
Doppelektrod
2 Vågskepp
Vit bricka
Avjonat vatten
Del II
Ämnet från del I
Värmeplatta
Avjonat vatten
Spänningsaggregat
2 Elsladdar och elektroder
Vitt papper
Utförande:
Del I
0,3 gram jod vägdes upp i ett vågskepp.
Joden fördes över till en bägare och finfördelades med en glasstav.
0,2 gram zink vägdes upp i ett vågskepp.
Zinken fördes över till samma bägare som joden.
Bägaren placerades på en vit bricka i ett dragskåp och innehållet blandades med glasstaven.
Några droppar avjonat vatten tillsattes försiktigt.
Avjonat vatten tillsattes så att bägarens botten täcktes.
Vätskan rördes om med glasstaven och fick sedan stå i ca en minut.
Vätskan dekanterades av i en annan bägare med hjälp av glasstaven.
En doppelektrod placerades i bägaren för att kontrollera om väskan ledde ström.
Doppelektroden togs ur vätskan och bägaren lämnades i ca 5 dygn för att låta vattnet avdunsta.
Del II
Bägaren med ämnet från del I placerades på en värmeplatta tills det sista vattnet avdunstat.
Ämnet löstes upp i några kubikcentimeter avjonat vatten.
Bägaren placerades på ett vitt papper.
Elektroderna kopplades till spänningsaggregatet och stoppades ner i lösningen.
Aggregatet startades och spänningen ökades tills reaktioner var synliga vid båda elektroderna (vid ca 7,5 V).
Elektroderna plockades ur bägaren och ströks av mot ett vitt papper.
Resultat:
Del I
Lila gas bildas vid första tillsättningen av avjonat vatten.
Bägaren blir varm
När mer avjonat vatten tillsätts bildas en gul lösning i bägaren.
Små svarta bitar finns olösta i bägaren.
Den dekanterade lösningen leder ström.
Del II
När vattnet avdunstat återstår ett vitt salt.
När ström tillsätts bildas ett svart lager runt den negativa elektroden. Så småningom fälls svarta bitar från elektroden.
Vid ca 7,5 Volt spänning börjar lösningen bli gulare vid den positiva elektroden.
När elektroderna torkas av mot ett vitt papper blir det svart från den negativa elektroden och gult från den positiva.
Slutsats och diskussion:
