
- •8 Вопрос:
- •12 Вопрос: Изопроцессы
- •13 Вопрос:
- •Вывод основного уравнения мкт
- •Уравнение среднеквадратичной скорости молекулы
- •15 Вопрос: Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
- •16 Вопрос: Число степеней свободы молекулы и закон равномерного распределения энергии по степеням свободы молекул
- •17 Вопрос: Внутренняя энергия
- •Идеальные газы
- •19 Вопрос:
- •Раздел 2. Электричество. Постоянный ток. Магнетизм.
- •24 Вопрос: Работа по перемещению заряда в электрическом поле. Потенциал
- •26 Вопрос:
- •28 Вопрос: 1.8. Электрический ток. Закон Ома
- •30 Вопрос: Закон Ома для неоднородного участка цепи
- •32 Вопрос: Закон Био - Савара - Лапласа и его применение к расчету магнитного поля
- •34 Вопрос:
- •35 Вопрос: Сила Лоренца
- •36 Вопрос: Закон полного тока
- •Ток смещения
- •37 Вопрос: Основные формулы
- •38 Вопрос: Явление электромагнитной индукции.
- •Закон Фарадея
- •40 Вопрос: Уравнения Максвелла для электромагнитного поля
- •Раздел 3. Оптика и атомная физика
- •45 Вопрос: Дифракция Света
- •47 Вопрос: фракция Фраунгофера на одной щели
- •48 Вопрос: Дифракция Фраунгофера на дифракционной решетке. Условия минимумов и максимумов.
- •Энергетическая светимость тела
- •52 Вопрос: 1.2. Законы Кирхгофа
- •53 Вопрос: Формулы Рэлея - Джинса и Планка
- •54 Вопрос: Модели атома Томсона и Резерфорда
- •55 Вопрос: Формула Бальмера
- •История создания формулы Бальмера и ее значение
- •57 Вопрос: Квантовые числа и их физический смысл
- •58 Вопрос: Состав атомного ядра
- •1919 Г. Э. Резерфорд. Ядерная реакция. 14n(α,p)17o
- •1919 Г. Э. Резерфорд. Ядерная реакция. 14n(α,p)17o
- •1932 Г. Дж. Чедвик. Открытие нейтрона
- •Нейтроны
- •Размер ядра
- •Размер ядра и закон сил
- •Характеристики свободных нейтрона и протона
- •59 Вопрос: Закон радиоактивного распада
17 Вопрос: Внутренняя энергия
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
 —
подведённая к телу теплота,
измеренная в джоулях
—
подведённая к телу теплота,
измеренная в джоулях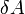 [1] —
работа,
совершаемая телом против внешних сил,
измеренная в джоулях
[1] —
работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
![]()
где
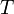 —
температура,
измеренная в кельвинах
—
температура,
измеренная в кельвинах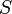 —
энтропия,
измеренная в джоулях/кельвин
—
энтропия,
измеренная в джоулях/кельвин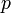 —
давление,
измеренное в паскалях
—
давление,
измеренное в паскалях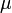 —
химический
потенциал
—
химический
потенциал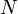 —
количество частиц в системе
—
количество частиц в системе
Идеальные газы
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа не зависит от давления или
объёма. Исходя из этого факта, можно
получить выражение для изменения
внутренней энергии идеального газа. По
определению молярной
теплоёмкости при постоянном
объёме,
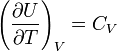 .
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
.
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
 .
.
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных
процессах); в общем случае
![]() является
функцией и температуры, и объёма.
является
функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
![]() ,
,
где
![]() —
количество вещества,
—
количество вещества,
![]() —
изменение температуры.
—
изменение температуры.
18 вопрос: Теплоемкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин. Если сообщение телу количества тепла dQ повышает его температуру на dT, то теплоемкость по определению равна:
![]() (1).
(1).
Молярной теплоемкостью называют теплоемкость одного моля газа, а удельной теплоемкостью — теплоемкость единицы массы газа.
Теплоемкость газа, находящегося в постоянном объеме, называется теплоемкостью при постоянном объеме (Cv), а газа, находящегося при постоянном давлении — теплоемкостью при постоянном давлении (Cp).
Если нагревание происходит при постоянном объеме, тело не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела:
dQv=dU (2).
Из (2) вытекает, что теплоемкость любого тела при постоянном объеме равна:
![]() (3).
(3).
Известно, что внутренняя энергия произвольной массы газа m будет равна:
![]() (4).
(4).
Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая над другими телами положительную работу. Следовательно, для повышения температуры газа на один кельвин в этом случае понадобится больше тепла, чем при нагревании при постоянном объеме, так как часть тепла будет затрачиваться на совершение работы. Поэтому теплоемкость при постоянном давлении больше чем теплоемкость при постоянном объеме.
Напишем уравнение первого начала термодинамики для моля газа:
![]() (5).
(5).
В данном случае тепло сообщается газу в условиях, когда давление постоянно. В уравнении (5) на это указывает индекс р при Q. Разделив уравнение (4) на dT, получим выражение для молярной теплоемкост газа при постоянном давлении:
![]() (6).
(6).
Величина
![]() представляет
собой приращение объема моля газа при
повышении температуры на один кельвин,
получающееся в случае, когда р постоянно.
Из уравнения состояния известно, что
представляет
собой приращение объема моля газа при
повышении температуры на один кельвин,
получающееся в случае, когда р постоянно.
Из уравнения состояния известно, что
![]() .
Дифференцируя это выражение по Т, полагая
р = const, находим:
.
Дифференцируя это выражение по Т, полагая
р = const, находим:
![]() (7).
(7).
Подставив данный результат в (6), получим
![]() (8).
(8).
Таким образом, работа, которую совершает моль идеального газа при повышении его температуры на один кельвин при постоянном давлении, оказывается равной газовой постоянной R. Отметим, что соотношение (8) получено с использованием уравнения состояния идеального газа, и справедливо только для идеального газа.
Величина
![]() представляет
собой характерную для каждого газа
величину. Для одноатомных газов это
отношение близко к 5/3, для двухатомных
— к 7/5, для трехатомных — к 4/3.
представляет
собой характерную для каждого газа
величину. Для одноатомных газов это
отношение близко к 5/3, для двухатомных
— к 7/5, для трехатомных — к 4/3.
Из уравнения (8) получим :
![]() (9).
(9).
Используя выражение (9) можно получить выражение для определения внутренней энергии идеального газа:
![]() (10).
(10).
Рассмотрим
процесс, в уравнении которого фигурирует
отношение теплоемкостей
,
называемый адиабатическим. Адиабатический
процесс — это процесс, протекающий без
теплообмена с внешней средой. Наиболее
близкими к адиабатическому являются
быстропротекающие процессы. Найдем
уравнение, связывающее параметры
состояния для идеального газа. Для этого
запишем первое начало термодинамики
для адиабатического процесса
![]() и
поскольку
и
поскольку
![]() равно
нулю, то:
равно
нулю, то:
![]()
следовательно
![]() (11).
(11).
Воспользуемся уравнением Менделеева-Клапейрона:
![]() (12).
(12).
Подставим (12) в уравнение (11). Получим:
![]() ,
иначе
,
иначе
![]() (13).
(13).
Иначе
![]()
Значит
![]() =
const.
=
const.
Или
![]()
![]() по-иному
по-иному
![]() (14).
(14).
Заменив Т на
![]() ,
,
получаем
соотношение
![]() (15),
называемое уравнением Пуассона.
(15),
называемое уравнением Пуассона.
ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ. Лабораторная установка для определения теплоемкостей включает в себя прибор для осуществления адиабатического процесса, компрессор и датчик температур, соединенный с цифровым вольтметром, градуированным в единицах температуры. Прибор для осуществления процесса адиабатического расширения представляет собой баллон с двумя кранами, соединенный с манометром. С помощью датчика температуры фиксируется момент времени, когда воздух в баллоне приходит в тепловое равновесие с атмосферным воздухом.
ЗАДАНИЯ:
Определить величину отношения теплоемкостей .
Рассчитать абсолютную и относительную погрешность измерения γ.
Данные измерений занести в таблицу 1.
ХОД РАБОТЫ:
Рабочей формулой для расчета γ являлось следующее уравнение:
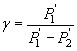 (16),
где
(16),
где
![]() —
давление
воздуха, соответствующего показанию
манометра в момент времени, когда
температура в баллоне станет равной
температуре атмосферного воздуха, после
нагнетания воздуха компрессором и его
последующего нагревания и охлаждения,
—
давление
воздуха, соответствующего показанию
манометра в момент времени, когда
температура в баллоне станет равной
температуре атмосферного воздуха, после
нагнетания воздуха компрессором и его
последующего нагревания и охлаждения,
![]() —
давление соответствующее показаниям
манометра в момент времени, когда воздух
нагреется до температуры окружающей
среды после охлаждения вследствие
адиабатического расширения.
—
давление соответствующее показаниям
манометра в момент времени, когда воздух
нагреется до температуры окружающей
среды после охлаждения вследствие
адиабатического расширения.
Для расчета погрешности применяли следующую формулу:
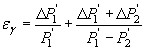 и
и
![]()
Таблица 1
№ опыта |
Р1’ |
P2’ |
Р1’- P2’ |
γ |
Δγ |
1 |
43 |
3 |
40 |
1.08 |
0.04 |
2 |
41 |
5 |
36 |
1.13 |
0.05 |
3 |
38 |
6 |
32 |
1.18 |
0.06 |
Получили ответы:
γ = 1.08 ± 0,04
γ = 1.13 ± 0,05
γ = 1.18 ± 0,06
